HPLC梯度洗脱法同时测定泻痢宁片中秦皮甲素秦皮乙素黄芩苷和鞣花酸含量
文才华
(广西医科大学附属肿瘤医院药剂科,南宁 530021)
HPLC梯度洗脱法同时测定泻痢宁片中秦皮甲素秦皮乙素黄芩苷和鞣花酸含量
文才华
(广西医科大学附属肿瘤医院药剂科,南宁 530021)
目的 采用高效液相梯度洗脱法测定泻痢宁片中秦皮甲素、秦皮乙素、黄芩苷和鞣花酸的含量。方法 Hypersil C18色谱柱(4.6 mm×250 mm,5 μm);流动相A为甲醇-乙腈(4:1),流动相B为0.1%磷酸溶液,梯度洗脱;流速:1.1 mL·min-1;检测波长λ1=334 nm(检测秦皮甲素和秦皮乙素),检测波长λ2=280 nm(检测黄芩苷),检测波长λ3=254 nm(检测鞣花酸)。结果 秦皮甲素、秦皮乙素、黄芩苷和鞣花酸分别在0.058 6~1.172 0 μg(r=0.999 2)、0.015 4~0.308 0 μg(r=0.999 8)、0.447 2~8.944 0 μg(r=0.999 6)、0.072 6~1.452 0 μg(r=0.999 5)范围内进样量与峰面积呈良好的线性关系,平均加样回收率分别为97.24%,97.76%,98.43%,96.89%,RSD(n=6)分别为0.78%,1.11%,0.93%,0.62%。结论 该方法简便、准确、灵敏、重复性好,可作为泻痢宁片中秦皮甲素、秦皮乙素、黄芩苷和鞣花酸的含量控制方法。
泻痢宁片;秦皮甲素;秦皮乙素;黄芩苷;鞣花酸
泻痢宁片为中药复方制剂,处方来源于《卫生部药品标准中药成方制剂第十七册》,由秦皮、黄芩、地锦草、地榆四味药材组成。具有清热燥湿、凉血解毒、止泻止痢之功效,可用于大肠湿热、血热毒盛、泻泄腹痛、下痢后重、肠炎菌痢见上述证候者的治疗[1]。原部颁标准仅进行了性状和薄层色谱鉴别控制,未对方中的任何药物进行定量测定,不能有效保证产品的质量和疗效。笔者在本实验中采用高效液相梯度洗脱法对秦皮中秦皮甲素、秦皮乙素和黄芩中黄芩苷,以及地锦草中鞣花酸进行含量测定方法研究,为完善该制剂质量标准提供依据。
1 仪器与试药
1.1 仪器 Agilent 1200 高效液相色谱仪;G1322A脱气机、G1329A自动进样器、G1311A四元泵、Chemstation色谱工作站;G1315B可变波长检测器。
1.2 试药 秦皮甲素对照品(批号:110740-200104,纯度:96.4%)、秦皮乙素对照品(批号:110741-200506,含量:98.1%)和黄芩苷对照品(批号:110715-201117,含量:91.7%)购于中国食品药品检定研究院;鞣花酸对照品(批号:476-66-4,含量:98.7%)购于上海同田生物技术股份有限公司;泻痢宁片(规格:每片0.42 g,批号:131011,131016,131019)购于天津格斯宝药业有限公司;磷酸(广州化学试剂二厂,分析纯,批号:120706);甲醇 (天津市康科德科技有限公司,色谱纯,批号:1315026) ;乙腈(安徽时联特种溶剂股份有限公司,色谱纯,批号:13025006)。
2 方法与结果
2.1 色谱条件 C18色谱柱(4.6 mm×250 mm,5 μm);流动相A为甲醇-乙腈(4:1),流动相B为0.1%磷酸溶液,梯度洗脱(0~21 min,45.0%A;>21~31 min,45.0%→20.0%A;>31~45 min,20.0%A);流速:1.1 mL·min-1;检测波长(0~21 min,λ1=334 nm;>21~31 min,λ2=280 nm;>31~45 min,λ3=254 nm)。该系统条件下所测组分与其他组分分离效果良好,理论板数按秦皮甲素、秦皮乙素、黄芩苷和鞣花酸计均不得低于2 500,分离度均应> 2[2-10]。
2.2 样品的制备
2.2.1 混合对照品溶液的制备 分别取秦皮甲素、秦皮乙素、黄芩苷和鞣花酸对照品适量,精密称定,加75%甲醇制成混合对照品溶液(秦皮甲素为0.058 6 mg·mL-1,秦皮乙素为0.015 4 mg·mL-1,黄芩苷为0.447 2 mg·mL-1,鞣花酸为0.072 6 mg·mL-1)。
2.2.2 供试品溶液的制备 取本品10片,除去包衣,精密称定,研细,取约 2.0 g,精密称定,置50 mL具塞锥形瓶,精密加入75%甲醇50 mL,密塞,称定质量,超声处理(300 W,40 kHz)45 min,再称定质量,用75%甲醇补足减失的质量,摇匀,过滤,取续滤液即得供试品溶液。
2.2.3 阴性对照实验 按泻痢宁片处方比例称取除秦皮的其余药味、除黄芩的其余药味和除地锦草的其余药味各一份,按泻痢宁片的生产工艺分别制成缺秦皮的阴性样品、缺黄芩的阴性样品和缺地锦草的阴性样品,按照上述供试品溶液的配制方法制成缺秦皮的阴性对照溶液、缺黄芩的阴性对照溶液和缺地锦草的阴性对照溶液。分别精密吸取供试品溶液、混合对照品溶液、缺秦皮的阴性对照溶液、缺黄芩的阴性对照溶液以及缺地锦草的阴性对照溶液各10 μL,按上述方法测定,结果在与秦皮甲素、秦皮乙素、黄芩苷和鞣花酸对照品色谱图相应的保留时间处,供试品溶液色谱图中有吸收峰,而阴性对照色谱图中未显示吸收峰(图1)。
2.3 方法学考察
2.3.1 线性关系考察 分别精密量取混合对照品溶液0.5,2.5,5.0,7.5,10.0 mL置于10 mL量瓶中,用75%甲醇稀释至刻度,即得系列标准溶液。按“2.1”项色谱条件每次进样20 μL测定,以峰面积(Y)与进样量(X),得回归方程为:秦皮甲素Y=2.254 7×106X+253.7,r=0.999 2;秦皮乙素Y=1.265 8×106X-398.2,r=0.999 8;黄芩苷Y=2.364 9×106X+823.8,r=0.999 6;鞣花酸Y=2.7935×106X-419.2,r=0.999 5。秦皮甲素、秦皮乙素、黄芩苷和鞣花酸分别在0.058 6~1.172 0,0.015 4~0.308 0,0.447 2~8.944 0,0.072 6~1.452 0 μg范围内进样量与峰面积线性关系良好。
2.3.2 精密度实验 取“2.2.1”项混合对照品溶液,按“2.1”项色谱条件重复进样6次,记录秦皮甲素、秦皮乙素、黄芩苷和鞣花酸的峰面积,RSD分别为0.75%(秦皮甲素)、0.87%(秦皮乙素)、0.39%(黄芩苷)和0.66%(鞣花酸)。结果表明仪器具有良好精密度。
2.3.3 重复性实验 称取同一批样品6份,按“2.2.2”项供试品溶液制备方法制备6份供试品溶液,依法进样测定,计算含量,求得素皮甲素、秦皮乙素、黄芩苷和鞣花酸RSD分别为0.87%,0.42%,0.89%和0.73%。结果表明本法测定重现性良好。
2.3.4 稳定性实验 精密吸取同一供试品溶液,在室温下放置0,1,2,4,6,8 h后,每次进样10 μL,测定其峰面积值,求得秦皮甲素、秦皮乙素、黄芩苷和鞣花酸RSD分别为0.69%、0.53%、0.36%和0.75%。结果表明供试品溶液8 h内基本稳定。
2.3.5 加样回收率实验 取已知含量的同一批泻痢宁片(秦皮甲素为1.462 mg·g-1,秦皮乙素为0.386 mg·g-1,黄芩苷为11.24 mg·g-1,鞣花酸为1.826 mg·g-1)10片,除去包衣,精密称定,研细,取约 1.0 g,精密称定,置50 mL具塞锥形瓶中,分别精密加入混合对照品溶液25 mL、用75%甲醇稀释至刻度,按“2.2.2”项供试品溶液配制方法制备加样供试品试液。按“2.1”项色谱条件进样测定,计算各组分回收率,结果见表1。
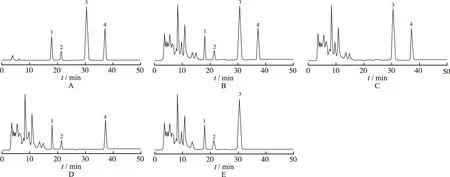
A.对照品;B.供试品;C.缺秦皮阴性对照品;D.缺黄芩阴性对照品;E.缺地锦草阴性对照品;1.秦皮甲素;2.秦皮乙素;3.黄芩苷;4.鞣花酸
图1 5种溶液的HPLC色谱图
A.reference substance;B.samples;C.negative control without fraxini cortex;D.negative control without scutellariae radix;E.negative control without euphorbiae humifusae herba;1.aesculin;2.aesculetin;3.baicalin;4.ellagic acid
Fig.1 HPLC chromatogram of five kinds of solutions
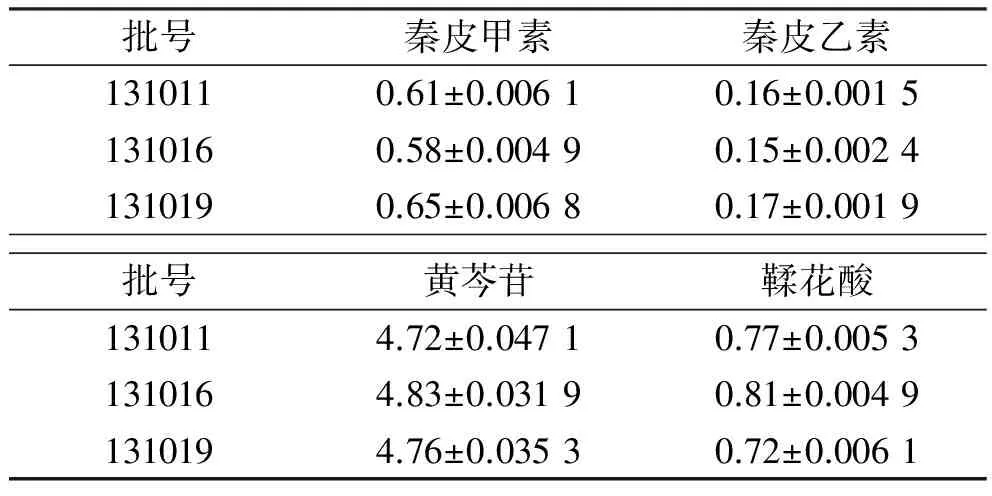
2.4 样品测定 取3批样品,按“2.2.2”项供试品制备方法,按“2.1”项色谱条件测定本品每片中秦皮甲素、秦皮乙素、黄芩苷和鞣花酸含量,结果见表2。
表2 每片样品中4种成分含量测定结果
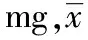
3 讨论
取秦皮甲素、秦皮乙素、黄芩苷和鞣花酸对照品各适量,分别加75%甲醇溶解制成每毫升含0.04 mg的溶液,在波长200~400 nm处进行紫外扫描,结果秦皮甲素和秦皮乙素对照品溶液均在334.1 nm处有最大吸收,黄芩苷对照品溶液在280 nm处有最大吸收,鞣花酸对照品溶液在254 nm处有最大吸收。故选择334 nm作为秦皮甲素和秦皮乙素的测定波长,280 nm作为黄芩苷的测定波长,254 nm作为鞣花酸的测定波长。
本实验结果表明,所采用的方法简便、准确、灵敏、重复性好,可作为泻痢宁片中秦皮甲素、秦皮乙素、黄芩苷和鞣花酸的质量控制方法。
[1] 中华人民共和国卫生部药典委员会.中华人民共和国卫生部药品标准中药成方制剂第十七册[S].北京:人民卫生出版社,1998:149.
[2] 国家药典委员会.中华人民共和国药典(一部)[S].北京:中国医药科技出版社,2010:118,254,282-283,附录30,附录36.
[3] 张庆,马骏,辛俐华.高效液相色谱法测定鳖甲煎丸中芍药苷和黄芩苷的含量[J].医药导报,2013,32(3): 356-359.
[4] 牟英迪,林吉茂.HPLC程序波长法测定牛黄上清丸中黄芩苷、连翘苷和盐酸小檗碱[J].中成药,2013,35(9):1933-1936.
[5] 周蓬,宋青,马帅.HPLC法同时测定小儿豉翘清热颗粒中栀子苷、芍药苷、黄芩苷、黄芩素和汉黄芩素[J].中成药,2013,35(8):1693-1696.
[6] 马力,严慧娟,曲佳佳,等.高效液相色谱法测定对节白蜡中秦皮甲素的含量[J].医药导报,2010,29(4):525-527.
[7] 于红艳,许成刚,崔永霞.退黄丸的质量标准研究[J].中成药,2013,35(1):79-86.
[8] 张苏阳,陈佳正,李晓英,等.藏药八味秦皮丸中秦皮甲素、秦皮乙素和麝香酮的定量测定[J].中成药,2011,33(6):984-988.
[9] 黄彩虹,刘海涛,雷鹏,等.高效液相色谱法测定地锦草中鞣花酸的含量[J].中南药学,2013,11(2): 136-138.
[10] 金欣,王锋,姚岚,等.HPLC测定野老鹳草中没食子酸和鞣花酸的总量[J].中成药,2010,32(7): 1172-1176.
DOI 10.3870/yydb.2015.03.027
Simultaneous Determination of Four Ingredients inXieliningTablets by HPLC
WEN Caihua
(DepartmentofPharmacy,theAffiliatedTumourHospital,GuangxiMedicalUniversity,Nanning530021,China)
Objective To develop a HPLC method for determination of aesculin, aesculetin,baicalin and ellagic acid inXieliningtablets. Methods The hypersil C18column was used with the flow rate of 1.1 mL·min-1.The mobile phase A consisted of methanol-acetonitrile(4:1),the mobile phase B consisted of 0.1% phosphoric acid solution; The detection wavelengths wereλ1=334 nm(aesculin and aesculetin),λ2=280 nm(baicalin),andλ3=254 nm(ellagic acid). Results There was a good linear relationship between the peak area values and concentrations of aesculin,aesculetin,baicalin and ellagic acid.The quantitation range of aesculin,aesculetin,baicalin and ellagic acid was 0.058 6-1.172 0 μg(r=0.999 2), 0.015 4-0.308 0 μg(r=0.999 8),0.447 2-8.944 0 μg(r=0.999 6),and 0.072 6-1.452 0 μg(r=0.999 5), respectively.The average recovery was 97.24%(RSD=0.78%),97.76%(RSD=1.11%),98.43%(RSD=0.93%) and 96.89%(RSD=0.62%), respectively. Conclusion The method is convenient,accurate,sensitive,reproducible and may be used in the determination of aesculin, aesculetin,baicalin and ellagic acid inXieliningtablets.
Xieliningtablets; Aesculin; Aesculetin; Baicalin; Ellagic acid
2013-12-08
2014-01-20
文才华(1971-),男,湖北孝感人,主管药师,学士,主要从事医院药学和药品质量控制工作。E-mail:wencaihualunwen@163.com。
R286;R927.1
B
1004-0781(2015)03-0384-04

