地塞米松预处理减轻小肠缺血-再灌注损伤*
袁伟,杨娟,陈美雪,潘莉萍
(1.三峡大学消化疾病研究所、宜昌市中心人民医院消化内科,宜昌 443000;2.华中科技大学同济医学院附属同济医院肾内科,武汉 430030)
地塞米松预处理减轻小肠缺血-再灌注损伤*
袁伟1,杨娟2,陈美雪2,潘莉萍1
(1.三峡大学消化疾病研究所、宜昌市中心人民医院消化内科,宜昌 443000;2.华中科技大学同济医学院附属同济医院肾内科,武汉 430030)
目的 探讨地塞米松对小鼠小肠缺血-再灌注损伤的作用及其机制。方法 健康雄性C57BL/6小鼠18只,随机分为3组(n=6),分别为假手术组、模型对照组和地塞米松组。假手术组和模型对照组缺血前30 min腹腔注射0.9%氯化钠溶液,地塞米松组缺血前30 min腹腔注射地塞米松10 mg·kg-1,模型对照组和地塞米松组小鼠用血管夹夹闭肠系膜上动脉,置于32 ℃温箱30 min后松开血管夹。再灌注24 h后处死小鼠,收集血清和小肠标本。苏木精-伊红染色后观察小肠黏膜病理形态学变化并进行损伤评分,聚合酶链反应(PCR)检测白细胞介素6(IL-6)、干扰素(IFN-γ)和肿瘤坏死因子(TNF-α),Western blotting 检测p-AKT和AKT。 结果 假手术组、模型对照组和地塞米松组小肠损伤评分分别为(4±2),(13±3),(7±2)分。模型对照组IL-6、IFN-γ和TNF-α mRNA水平明显上调,p-AKT表达明显增加。与模型对照组比较,地塞米松组小肠损伤评分下降,IL-6、IFN-γ 和TNF-α表达降低,p-AKT表达进一步增加。结论 地塞米松预处理可通过激活AKT信号通路抑制炎症反应,从而减轻小肠缺血-再灌注损伤。
地塞米松;损伤,缺血-再灌注,小肠;炎症
在腹部外伤、失血性休克、严重创伤、感染、烧伤等病理状态下,往往存在肠道缺血-再灌注损伤和功能障碍,肠屏障功能降低,肠内细菌和毒素通过受损的肠黏膜进入体循环,激活网状内皮系统,引起大量炎症递质和细胞因子释放,造成全身炎症反应综合征(systemic inflammatory response syndrome,SIRS),甚至发生多器官功能衰竭(multiple organ failure,MOF )[1-3]。采取有效措施避免或减少肠道损伤尤为重要。研究发现糖皮质激素受体激动药可以减轻肠缺血-再灌注损伤,但具体机制不明[4]。地塞米松具有广泛的抗炎效应,笔者在本实验中利用小鼠肠系膜上动脉(superior mesenteric artery,SMA)夹闭模型[5],研究腹腔注射地塞米松对缺血-再灌注损伤后肠道的保护作用,并探讨其可能的作用机制。
1 材料与方法
1.1 动物、试剂与仪器 C57BL/6小鼠购自武汉大学实验动物中心,无特定病原体(specefic pathogen free,SPF)级,常规饲养于华中科技大学同济医学院附属同济医院动物实验中心,动物合格证号:420005000,使用许可证号:SYXK(鄂)2010-0057。地塞米松(郑州卓峰制药有限公司,批准文号:国药准字H41020057,批号:12074376),水合氯醛(Google 生物科技有限公司,批号:SF0541)。TRIzol reagent (Invitrogen,USA,批号:15596-026),逆转录试剂盒(GeneCopoeia,USA,批号:A2301-1),SYBR green(Takara,Japan,批号:D01010A),qPCR引物(擎科生物技术有限公司,批号:A3804),苏木精-伊红(hematoxylin and eosin,HE)由华中科技大学同济医学院附属同济医院肾病实验室配制。紫外分光光度计(Thermo fisher)、逆转录仪、实时定量聚合酶链反应(quantitative polymerase chain reaction,qPCR)仪(BIO-RAD IQ5)、显微镜(Olympus BX51)及成像系统(HITMAS-30)均为华中科技大学同济医学院附属同济医院肝病研究所提供。
1.2 动物模型的建立与分组 健康雄性C57BL/6小鼠18只,2个月龄,平均体质量20~25 g。适应性喂养1周后,状态良好,随机分为假手术组、模型对照组和地塞米松组,每组6只。地塞米松组术前0.5 h给予地塞米松10 mg·kg-1腹腔注射,假手术组和模型对照组给予等体积0.9%氯化钠溶液;假手术组行假手术,模型对照组和地塞米松组行小肠缺血-再灌注手术。具体手术方式如下:麻醉状态下,腹部正中切口,钝性分离肠系膜上动脉根部,用微血管夹夹闭肠系膜上动脉根部,完全阻断血流30 min后松开血管夹,恢复肠道血流形成再灌注。缝合腹部,术毕放回动物房。 假手术组则开腹后不夹闭肠系膜上动脉。24 h后处死小鼠,收集小肠标本。实验中,动物状态较好,苏醒较快,无死亡动物。手术后给予正常饮食饮水。
1.3 肠道组织学检查 小肠组织切片经10%甲醛溶液固定、石蜡包埋,HE染色之后,在光镜下观察小肠组织病理组织学变化。小肠损伤程度采用积分法[2]评估,0分:正常绒毛和腺体;1分:部分绒毛顶部上皮轻度受损;2分:上皮下腺体轻度受损;3分:上皮下间隙扩大,毛细血管充血;4分:上皮与固有层中度分离,腺体受损;5分:部分绒毛顶部脱落;6分:绒毛脱落明显,毛细血管扩张;7分:固有层绒毛脱落,腺体受损明显;8分:固有层开始消化分解;9分:出血、溃疡。
1.4 Western blotting检测 取小肠组织于分析天平称质量,每50 mg组织中加入RIPA裂解液(以1:50加入50×cocktail)1 mL,冰上匀浆,裂解30 min后,4 ℃、12 000 r·min-1(r=8.6 cm)离心30 min后取上清液,二喹啉甲酸(bicinchoninic acid,BCA)法测定蛋白浓度。以含蛋白质50 μg的上样量,经十二烷基硫酸钠聚丙烯酰胺凝胶电泳(5%浓缩胶,10%分离胶,恒压80~100 V)后转膜(聚偏二氟乙烯膜,恒流300 mA),然后洗膜,以5%脱脂奶粉封闭1 h,AKT (1:2 000),p-AKT (1:1 000),β-actin(1:3 000)单抗孵育过夜,再次振洗后加入羊抗兔IgG-HRP(二抗)37 ℃孵育1 h。洗膜后加电化学发光(electrochemiluminescence,ECL)试剂,Kodak化学发光仪曝光显示目的蛋白,并摄像。以Quantity one对条带进行定量分析,计算目的条带和β-actin条带积分灰度值比值。
1.5 qPCR检测白细胞介素-6(interleukin-6,IL-6)、肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α) 和γ-干扰素(interferon-γ,IFN-γ) 称取适量小肠组织,于液氮中研磨成粉末状提取总RNA,紫外分光光度计测量浓度,逆转录以及扩增反应按试剂盒说明书进行。以管家基因β-actin作为内参对照基因,用得到的各样本的Ct值按公式2-ΔΔCt计算相对表达量。实时定量PCR检测的引物序列见表1。
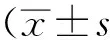

表1 IL-6、TNF-α和IFN-γ引物序列
2 结果
2.1 地塞米松对缺血-再灌注损伤小肠组织结构的影响 光镜下观察肠道组织病理学变化,可见假手术组肠道黏膜细胞排列基本整齐,结构完整,无组织坏死、缺失及水肿,其损伤评分为(4±2)分;模型对照组可见小肠黏膜上皮下间隙扩大,腺体受损及毛细血管充血、水肿,肠道组织有大量绒毛脱落、糜烂、炎性细胞浸润、肠道组织结构破坏,其损伤评分为(13±3)分;地塞米松组可见小肠缺血-再灌注损伤程度减轻,其损伤评分为(7±2)分。见图1。
2.2 地塞米松预处理对TNF-α、IL-6和IFN-γ mRNA表达的影响 qPCR检测显示,与假手术组比较,模型对照组炎症因子TNF-α、IL-6和IFN-γ mRNA水平明显上调(χ2值分别为15.732,14.260,11.780,均P<0.01);与模型对照组比较,地塞米松组炎症因子TNF-α、IL-6和IFN-γ mRNA表达水平明显下调(χ2=8.960,9.156,P<0.01和χ2=6.456,P<0.05),见表2。
2.3 地塞米松预处理对p-AKT表达水平的影响 实时Western blotting检测显示,假手术组、模型对照组和地塞米松组p-AKT/AKT分别为0.15±0.03,0.27±0.04,0.45±0.08。与假手术组比较,模型对照组p-AKT表达水平明显上调(χ2=8.960,P<0.01),AKT表达没有改变;地塞米松组p-AKT 表达水平进一步上调(χ2=5.712,P<0.05),AKT表达没有改变,见图2。
3 讨论
糖皮质激素因其广泛的抗炎和免疫抑制作用被广泛用于临床,地塞米松是一种经典合成类糖皮质激素,具有广泛的代表性[6]。糖皮质激素可通过激活糖皮质激素受体(glucocorticoid receptor,GR)或不通过激活GR两种方式发挥抗炎作用[7]。研究发现,糖皮质激素对心脏、肝脏、肾脏等缺血-再灌注损伤具有保护作用[7-9]。肠道缺血-再灌注损伤常伴发于失血性休克、严重创伤、烧伤等病理状态下,可导致肠道屏障功能降低,肠内细菌和毒素通过受损的肠黏膜进入体循环,激活网状内皮系统,引起大量炎症递质和细胞因子释放,造成SIRS,甚至MOF等[2,10]。减轻肠道缺血-再灌注损伤成为学者关注的热点。地塞米松因具有抗炎和免疫抑制作用,故笔者推测地塞米松对肠缺血-再灌注损伤也具有保护作用。
本实验研究结果显示,小肠缺血-再灌注损伤可导致肠道充血、水肿、出血、坏死,肠腔内可见糜烂、出血及溃疡。常规HE染色病理切片可见肠绒毛毛细血管扩张、瘀血,肠腺上皮细胞水肿、坏死脱落。地塞米松预处理后能明显降低肠缺血-再灌注后肠黏膜上皮细胞超微结构损伤,肠黏膜损伤评分明显降低,说明地塞米松预处理对肠黏膜上皮细胞和肠道机械屏障具有明显的保护作用。
肠缺血-再灌注过程中原发的低氧、氧自由基生成及通过受损肠壁的内毒素均可能参与了小肠炎症递质表达的介导,而炎症在肠缺血-再灌注的发病中起重要作用。肠缺血-再灌注可显著提高动物对内毒素攻击的敏感性,可使机体单核/巨噬细胞、中性粒细胞处于致敏状态。激发机体产生和释放各种细胞因子及炎症递质,使细胞因子网络失衡,从而引发SIRS,甚至MODS。TNF-α、IL-6和IFN-γ都是强有力的促炎症细胞因子[2]。地塞米松在肾缺血-再灌注损伤中可以抑制TNF-α、IL-6和IFN-γ 等促炎症细胞因子释放[11]。本研究显示,肠缺血-再灌注后TNF-α、IL-6和IFN-γ等促炎症细胞因子均明显升高;地塞米松预处理组TNF-α、IL-6和IFN-γ mRNA水平则明显降低,提示地塞米松可抑制促炎症因子的释放,控制持续扩大的炎症反应,防止肠黏膜局部及全身组织器官损伤,从而达到防治肠缺血-再灌注损伤的目的。但地塞米松抑制肠缺血-再灌注损伤释放促炎症因子的具体机制仍不清楚。
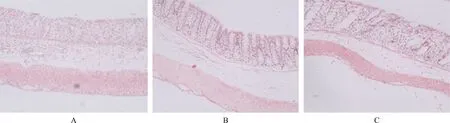
A.假手术组;B.模型对照组;C.地塞米松组
表2 3组小鼠TNF-α、IL-6和IFN-γ mRNA相对表达量比较
Tab.2 Comparison of the relative mRNA expression amount of TNF-α,IL-6 and IFN-γ among three groups of mice

组别TNF-αIL-6IFN-γ假手术组1.0±0.01.0±0.01.0±0.0模型对照组12.0±4.0*15.0±0.5*17.0±1.0*1地塞米松组5.0±0.8*23.0±0.5*23.0±0.8*3
与假手术组比较,*1P<0.01;与模型对照组比较,*2P<0.05,*3P<0.01
Compared with sham operation group,*1P<0.01; compared with model control group,*2P<0.05,*3P<0.01
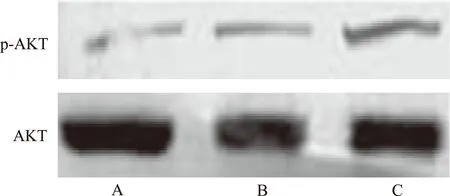
A.假手术组;B.模型对照组;C.地塞米松组
图2 3组小鼠小肠组织中p-AKT和AKT的表达比较
A.sham operation group;B.model control group;C.dexamethasone group
Fig.2 Comparison of intestinal expression of p-AKT and AKT among three groups of mice
丝氨酸/苏氨酸蛋白激酶AKT,也被称为蛋白激酶B,最初被认为是磷脂酰肌醇-3激酶(phosphatidy-linositol-3-kinase,PI3K)的一个下游靶点。活化的AKT在多种细胞信号的介导过程中发挥了重要作用,这些信号涉及细胞生长、细胞存活(抗凋亡)、细胞周期进程、分化、转录、翻译和糖代谢,AKT的调节在炎症过程中发挥了至关重要的作用[12]。研究发现,p-AKT信号通路参与了肾缺血-再灌注损伤和心脏缺血-再灌注损伤,而地塞米松可以调节p-AKT信号通路[11]。本实验研究证实了肠缺血-再灌注损伤能够激活p-AKT,给予地塞米松可以进一步激活p-AKT,推测地塞米松可以通过激活p-AKT信号通路抑制炎症反应从而拮抗肠缺血-再灌注损伤。但在肠缺血-再灌注损伤中,地塞米松激活AKT的具体信号通路目前依然不清楚,尚需进一步研究。
[1] GROOTIANS J,HUND SCHEID I H,BUURMAN W A.Goblet cell compound exocytosis in the defense against bacterial invasion in the colon exposed to ischemia-reperfusion[J].Gut Microbes,2013,4(1):232-235.
[2] LENAERTS K,CEULEMAN L J,HUNDSCHEID I H,et al.New insights in intestinal ischemia-reperfusion injury:implications for intestinal transplantation[J].Curr Opin Organ Transplant,2013,18(1):298-303.
[3] WONG D M,MOORE R M,BROCKUS C W.Intestinal isc-hemia-reperfusion injury in horses:pathogenesis and therapeutics[J].Compend Contin Educ Vet,2012,34(8):1-7.
[4] ZHAO W,GAN X,SU G,et al.The interaction between oxidative stress and mast cell activation plays a role in acute lung injuries induced by intestinal ischemia-reperfusion[J].J Surg Res,2014,187(2):542-555.
[5] ANGELOPOULOS T P,TENTOLOURIS N K,BERTSIAS G K,et al.Steroid-induced diabetes in rheumatologic patients[J].Clin Exp Rheumatol,2014,32(1):126-130.
[6] KUMAS S,ALLEN D A,KIESWICH J E,et al.Dexame-thasone ameliorates renal ischemia-reperfusion injury[J].J Ame Soc Nephrol,2009,20(7):2412-2425.
[7] LI D X,LI J D.Use of dexamethasone in liver ischemia-reperfusion injury[J].Chin J Hepatol,2010,18(3):875-877.
[8] MIHAILIDOU A S,LOAN L,MARDINI M,et al.Glucocor-ticoids activate cardiac mineralocorticoid receptors during experimental myocardial infarction[J].Hypertension,2009,54(5):1306-1312.
[9] WANG W,WU Z,DAI Z,et al.Glycine metabolism in ani-mals and humans:implications for nutrition and health[J].Amino Acids,2013,45(2):463-477.
[10] WANG J,JIANG A,JOSHI M,et al.Drug delivery implants in the treatment of vitreous inflammation[EB/OL].[2013-09-28].http://dx.doi.erg/10.1155/2013/780634.
[11] ZHANG J,YAO Y,XIAO F,et al.Administration of dexa-methasone protects mice against ischemia/reperfusion induced renal injury by suppressing PI3K/AKT signaling[J].Int J Clin Exp Pathol,2013,6(10):2366-2375.
[12] CORBI G,CONTI V,RUSSOMANNO G,et al.Adrenergic signaling and oxidative stress:a role for sirtuins[J].Front Physiol,2013,4(2):324-328.
DOI 10.3870/yydb.2015.05.003
Pretreatment with Dexamethasone Ameliorates Intestinal Ischemia Reperfusion Injury
YUAN Wei1, YANG Juan2, CHEN Meixue2, PAN Liping1
(1.ResearchInstituteofDigestiveDisease,ThreeGorgesUniversity,DepartmentofDigestive,YichangCentralPeople'sHospital,Yichang443000,China;2.DepartmentofNephropathy,TongjiHospital,TongjiMedicalCollege,HuazhongUniversityofScienceandTechnology,Wuhan430030 ,China)
Objective To investigate potential effect and mechanism of dexamethasone (DEX) on intestinal ischemia reperfusion injury. Methods A total of 18 male C57BL/6 mice were randomly divided into three groups(n=6 each): sham operation group, model control group , and DEX group.Mice in the model control and sham operation groups
intraperitoneal normal saline 0.5 hour before ischemia, and mice in DEX group received intraperitoneal injection of DEX 10 mg·kg-1, 0.5 hour before ischemia.Mice in the model control and DEX groups were placed in the 32 degree infant incubator for 30 minutes after clamping superior mesenteric artery, followed by clamps removal and reperfusion for 24 hours.Mice were then sacrificed to obtain the intestinal tissues.The pathology of intestinal tissues was observed after hematoxylin-eosin (HE) staining.The mRNA expression level of pro-inflammatory cytokines IL-6, TNF-α and IFN-γ were measured by PCR.The expression of AKT and p-AKT were measured by Western blotting. Results The level of mesenteric injuries in the sham operation group, model control group and DEX group was (4±2),(13±3),(7±2) points, respectively. The mRNA level of IL-6, TNF-α and IFN-γ and the expression of p-AKT were all higher in the model control group.Compared to the model control group, the level of mesenteric injuries, the mRNA level of IL-6, TNF-α and IFN-γ in DEX group were significantly attenuated, but the expression of p-AKT were further increased. Conclusion Pretreatment with DEX can reduce intestinal ischemia-reperfusion injury by activating AKT signaling pathway and suppressing inflammation.
Dexamethasone; Injury, ischemia reperfusion, intestine; Inflammation
2013-12-10
2014-06-13
*国家自然科学基金资助项目(81100264)
袁伟 (1979-),男,湖北宜昌人,主治医师,学士,研究方向:肠道疾病。电话:(0)13477133590,E-mail:26012678@qq.com。
潘莉萍 (1979-),女,湖北赤壁人,主治医师,学士,研究方向:肠道疾病。电话:(0)13872651937,E-mail:gunsuerlily2008@sohu.com。
R977.11;R965
A
1004-0781(2015)05-0574-04

