华丽牛肝菌子实体的化学成分
胡 琳,刘吉开,王芳芳
(1.云南民族大学 民族药资源化学国家民委-教育部重点实验室,云南 昆明 650500; 2.中国科学院昆明植物研究所 植物化学与西部植物资源持续利用国家重点实验室,云南 昆明 650204)
华丽牛肝菌子实体的化学成分
胡 琳1,刘吉开2,王芳芳1
(1.云南民族大学 民族药资源化学国家民委-教育部重点实验室,云南 昆明 650500; 2.中国科学院昆明植物研究所 植物化学与西部植物资源持续利用国家重点实验室,云南 昆明 650204)
利用硅胶柱层析、高效液相色谱从丽江产华丽牛肝菌子实体的甲醇提取物中分离得到7个化合物,通过波谱学方法分别鉴定为:麦角甾-ergosta-7,22-二烯-3β,5α,6β-triol (1),麦角甾-4,6,8(14),22-四烯-3-酮(2).麦角甾-5,7,22-三烯醇-3β-醇(3),麦角甾-7,22-二烯-3β-醇(4),D-阿洛醇(5),大黄素(6),大黄素甲醚(7).所有化合物均为首次从华丽牛肝菌中分离得到.
华丽牛肝菌;子实体;化学成分
华丽牛肝菌(BoletusmagnificusW.F.Chiu)属牛肝菌科(Boletaceae)牛肝菌属(Boletus)真菌[1].该属真菌多数可食用,牛肝菌属真菌的一些种子实体颜色鲜艳,被触摸或伤后伤处变成蓝色,俗称“见手青”.为此,牛肝菌的色素类物质引起了人们浓厚的兴趣,多年的化学成分研究从中分离得到了众多的色素类物质,主要有多异戊烯基取代的酚性化合物[2-4]、多烯和普尔文酸(pulvinic acids)类物质.牛肝菌伤后变蓝就是由于产生了普尔文酸类化合物xerocomus和variegatic acid所致[5].
华丽牛肝菌在我国主要分布在云南、西藏等地,属树木外生菌根菌[2],目前尚不能人工栽培.华丽牛肝菌一般可食用,在云南某些地区有中毒现象,出现“小人国幻视症”.该牛肝菌颜色红艳,伤后瞬间变蓝,为了研究其没有氧化的原始化学成分,我们对其新鲜未受损伤的子实体提取物进行研究,从中分离得到7个已知化合物,经波谱解析分别鉴定为:麦角甾-ergosta-7,22-二烯-3β,5α,6β-triol (1),麦角甾-4,6,8(14),22-四烯-3-酮( 2).麦角甾-5,7,22-三烯醇-3β-醇(3),麦角甾-7,22-二烯-3β-醇(4),D-阿洛醇(5),大黄素 (6),大黄素甲醚 (7).所有化合物均为首次从该种真菌中分离得到.
1 仪器与材料
1.1 样品来源
参考文献[14]的方法,在2 mL样液中加入2 mL 0.1 mmol/L DPPH·溶液,混匀室温下避光静置20 min后,在517 nm处测定吸光值,DPPH·清除率按下列公式计算。
胖警官垂下硕大的脑袋,思考片刻,转头命令手下:“录下其余几个的姓名。”右手指定刘雁衡,“你,跟我走。”
华丽牛肝(BoletusmagnifcusW.F.Chiu)新鲜子实体收集于云南丽江地区老君山,标本由昆明植物研究所分类室王向华女士鉴定,真菌标本收藏于昆明植物研究所隐花植物标本馆(HKAS 39209).
华丽牛肝菌新鲜子实体(2.7 kg)室温下用99%甲醇提取一次,残渣干后续用甲醇(5×2 500 mL)超声加热(50 ℃)提取,再用CHCl3∶MeOH(体积比1∶1, 5×2 500 mL)超声提取3次,将所有提取液减压浓缩合并,加水悬浮,用乙酸乙酯萃取、减压浓缩得膏状物Bm-EA(237 g)和水溶液部分Bm-W.Bm-EA用粗硅胶(100目)拌样,硅胶柱(200~300目,10 cm×120 cm),石油醚-丙酮梯度洗脱分成15个组分.组分1经反复硅胶柱层析得化合物6(15.8 mg),7(13.2 mg).组分2[V(石油醚)∶V(丙酮)=10∶1]经氯仿重结晶得化合物3(4.3 mg);组分3[V(石油醚)∶V(丙酮)=9∶1]经氯仿重结晶得化合物4;组分6[V(石油醚)∶V(丙酮)=8∶2]经反复硅胶柱层析纯化和甲醇重结晶得 2(13.5 mg);组分9~14[V(石油醚)∶V(丙酮)=7∶3,丙酮],经制备薄层层析[20 cm×20 cm;V(氯仿)∶V(甲醇)∶V(醋酸)=95∶5∶8.2;Rf=0.45]得化合物1(65.5 mg);组分15经HPLC色谱制备得化合物5(56.7 mg, 15%甲醇洗脱).
1.3 提取与分离
化合物1 白色针晶,m.p. 253~255 ℃,IR(KBr)(νmax,cm-1):3400(-OH),1650,1020;EI-MS(rel. int.)m/z:430([M]+,3),412([M-H2O]+,100),394([M-2H2O]+,60),379(67),287(15),269(43),251(50),95,81,69,55;1H NMR(400 MHz,CDCl3)δ:5.74(1H,s,H-7),5.24(2H,m,H-22,H-23),4.84(1H,m,H-2),4.32(1H,s,H-6),3.01(1H,dd,J=12.0,12.0 Hz,H-4),1.52(3H,s,H-19),1.07(3H,d,J=6.4 Hz,H-21),0.91(3H,d,J=6.4 Hz,H-26,H-27),0.67(3H,s,H-18);13C NMR(100MHz,CDCl3)δ:32.6(C-1),33.8(C-2),67.6(C-3),42.0(C-4),76.1(C-5),74.3(C-6),120.4(C-7),141.6(C-8),43.8(C-9),38.1(C-10),22.4(C-11),40.1(C-12),43.9(C-13),55.2(C-14),23.5(C-15),28.2(C-16),56.5(C-17),12.3(C-18),18.8(C-19),40.4(C-20),19.6(C-21),135.2(C-22),132.5(C-23),42.8(C-24),33.1(C-25),19.9(C-26),21.1(C-27),17.6(C-28).数据与文献[6]对照基本一致,故鉴定化合物1为麦角甾-7,22-二烯-3β,5α,6β-三醇.
熔点用四川大学科仪厂生产的XRC-1型显微熔点仪测定,未校正.UV由UV 210 A型分光光度计测定.IR由Bio-Rad FTS-135红外光谱仪测定.NMR由Bruker AM-400和Bruker DRX-500核磁共振仪测定,TMS为内标.MS由VG Auto Spec-3000质谱仪测定.薄层层析硅胶和柱层析硅胶均为青岛海洋化工厂产品.用10% H2SO4-乙醇 加热显色和用I2蒸汽显色. 安捷伦1100型高效液相色谱仪,色谱柱为安捷伦ZORBAX SC-C18(9.4 mm×250 mm,5 m)反相柱.
1.2 仪器与试剂
2 结构鉴定
土壤酸碱度(pH值)是反映土壤化学性质的重要指标之一,对土壤养分有效性、土壤微生物区系分布以及土壤重金属元素的活性均有显著影响。2011-2015年间,浦口区耕地土壤酸碱度呈下降趋势,从2011年的6.30下降到2015年的6.18,年平均下降0.02,总体上呈现酸化趋势,特别是在丘陵山区的监测点下降更加明显,这与长期施用酸性肥料、水土流失等有关。平原圩区大多呈微酸性至中性反应,沿江下圩地区脱钙过程尚末完成,pH值较高,大多在7.5以上,越向江边靠近,pH值越高,并有弱石灰反应至强烈反应不等,有些土壤剖面中已形成石灰结核。
化合物2黄色针晶(石油醚/丙酮);m.p.112.5~114 ℃;IR(KBr)(νmax,cm-1):1676(C=O),1638,1589(C=C),1 270,1 225,965 cm-1;EI-MS(70eV)m/z(rel. int.):392([M]+,70),377([M-CH3]+,7),349(10),268(100),253(45),214(48),173(30),109(35),81(52),69(70),55(73);1H NMR(400 MHz,CDCl3)δ:6.58(1H,d,J=9.4 Hz,H-7),6.00(1H,J=9.4 Hz,H-6 ),5.70(1H,s,H-4),5.24(1H,dd,J=15.2,7.2 Hz,H-23),5.18(1H,dd,J=15.2,7.2 Hz,H-22),2.53-1.21(18H,m,steroid necleus),1.03(3H,d,J=6.6 Hz,H-21),0.97(3H,s,H-19),0.93(3H,s,H-18),0.90(3H ,d,J=6.8 Hz,H-28),0.82(3H,d,J=6.8 Hz,H-27),0.81(3H,d,J=6.6 Hz,H-26);13C NMR(100 MHz,CDCl3).199.2(C-3),156.04)(C-14),134.9(C-22),133.9(C-7),132.5(C-23),124.4(C-8,6),122.9(C-4),55.7(C-17),44.3(C-9),43.95(C-13),42.8(C-24),39.3(C-20),36.7(C-10),35.6(C-15),34.1(C-1,12),33.1(C-25),25.3(C-11),27.7(C-16),21.2(C-21),19.6(C-26),19.96(C-27),18.95(C-2,18),17.61(C-28),16.62(C-19).13C NMR数据与文献[7]对照一致,鉴定化合物2为麦角甾-4,6,8( 14),22-四烯-3-酮.
日军见偷袭不成,恼羞成怒,一起朝最近的女兵石屋扫射。子弹已经在李晓英居住的石屋周围迸出了火花。陈山利飞奔的脚步,恨不得一下飞到李晓英面前,为她挡枪遮弹。
化合物5无色针晶;m.p. 154.5~156 ℃;[α]D21=0°(c0.003 60,H2O)为内消旋,已知无光学活性的糖醇只有D-阿洛醇和D-半乳醇(galactitol),其熔点的文献值分别为150~151 ℃和188.5 ℃[10],而实测值154.5~156 ℃与D-阿洛醇的基本一致; IR(KBr)(νmaxcm-1):3 271,2 959,2 936,1 461,1 377,1 351,1 332,1 304,1 092,1 025,932,890,874,712,624;1H NMR(400 MHz,C5D5N)δ:4.36(q,4H),4.54(m,7H),4.86(d,3H);13C NMR(100 MHz,DMSO-d6)δ:73.45(d,C-3,C-4),72.33(d,C-2,C-5),65.54(t,C-1,C-6); EI-MS (70 eV)m/z(rel. int.):183([M+H]+,36.4),146(15.2),133(70),115(25.8),103(73),93(53),85(49.5),74(84),73(100),61(89).根据上述波谱数据和理化性质,该化合物的结构被确定为D-阿洛醇.
化合物4无色针晶 (氯仿/甲醇),m.p.147~149 ℃;EI-MS(rel. int.):398([M]+,17),380([M-H2O]+,6),363(35),303(8),251(20),152(30),107(24),95(35),81(43),69(65);13C NMR(100Hz,CDCl3)δ:139.6(C-8),135.1(C-22),131.9(C-23),117.4(C-7),71.0(C-3),55.9(C-17),55.1(C-14),49.4(C-9),43.3(C-13),42.8(C-24),40.5(C-20),40.2(C-5),39.4(C-12),38.0(C-4),34.2(C-10),33.1(C-25),31.5(C-6),30.5(C-1),29.6(C-2),28.1(C-16),22.9(C-15),21.5(C-11),21.1(C-21),19.9(C-28),19.6(C-27),17.6(C-26),13.0(C-19),12.1(C-18).13C NMR数据与文献[9]对照基本一致,故鉴定化合物4为麦角甾-7,22-二烯-3β-醇.
化合物3C28H44O;无色针晶(石油醚/氯仿);m.p.154~156 ℃;EI-MS(rel. int.)m/z:396([M]+,100),378([M-H2O]+,7),363(79),337(43),253(38),157(37),143(46),109(29),95(32),81(56),69(84),55(87).1H NMR(400 MHz,CDCl3)δ:5.56(1H,m),5.37(1H,m),5.18(2H,m,H-22,23),3.62(1H,m,H-3),1.02(3H,d,J=6.8 Hz,H-4),0.91(3H,s,H-19),0.90(3H,d,J=6.4 Hz,H-21),0.78(3H,d,J=6.4 Hz,H-26,H-27),0.67(3H,s,H-18);13C NMR(100 MHz,CDCl3)δ:141.41(C-8),139.9(C-5),135.7(C-22),132.1(C-23),119.7(C-6),116.4(C-8),70.54(C-3),55.8(C-17),54.7(C-14),46.4(C-9),43.0(C-24),42.9(C-13),40.9(C-12),40.5(C-12),39.2(C-1),38.5(C-10),37.1(C-4),33.2(C-25),32.1(C-2),28.4(C-16),23.1(C-15),21.2(C-11,C-12),20.0(C-27),19.7(C-26),17.7(C-28),16.4(C-19),12.3(C-18).13C NMR数据与文献[8]对照一致.故鉴定化合物3为麦角甾-5,7,22-三烯醇-3β-醇.
化合物6橙红色针晶(甲醇),m.p.255~257 ℃;IR(KBr)(νmaxcm-1):3 429(OH),1 684(free C=O),1 632(chelated C=O),1 558,1 541,1 485;UVλmaxEtOH:221(4.4),253(1.9),266(2.1),290(2.5);EI-Msm/z:270[M+H]+;1H NMR(600 MHz,DMSO-d6)δ:12.07(1H,s,8-OH),12.00(1H,s,1-OH),11.43(1H,s,6-OH),7.47(1H,s,H-4),7.15(1H,d,J=2.4 Hz,H-5),7.10(1H,d,J=1.2 Hz,H-2),6.58(1H,d,J=2.4 Hz,H-7),2.48(3H,s,CH3);13C NMR(125 MHz,DMSO-d6)δ189.7(C-9),181.4(C-10),165.6(C-8),164.9(C-1),161.4(C-6),148.3(C-3),135. 1(C-14),132.8(C-11),124.2(C-7),120.5(C-5),113.4(C-12),109.0(C-13),108.8(C-4),108.0(C-2),21.5(6-CH3).数据与文献[11]对照基本一致,鉴定化合物6为大黄素.
化合物7黄色针晶(丙酮),m.p.235~236 ℃,EI-MSm/z:270[M+H]+;1H NMR(500 MHz,DMSO-d6)δ:11.92(1H,s,1-OH),11.85(1H,s,8-OH),7.76(1H,dd,J= 2.0/8.0 Hz,H-5),7.64(1H,J=8.0/8.0 Hz,H-6),7.63(1H,d,J=1.2 Hz,H-4),7.34(1H,dd,J=2.0/8.0 Hz,H-7),7.23(1H,d,J=1.2 Hz,H-2),4.60(2H,s,CH2OH);13C NMR(125 MHz,DMSO-d6)δ;191.6(C-9),181.3(C-10),161.5(C-1),161.3(C-8),153.7(C-3),137.3(C-6),133.2(10α),133.0(4α),124.4(C-7),120.6(C-5),119.3(C-2),117.1(C-4),115.8(9α),114.3(8α),62.0(CH2OH). 数据与文献[12]对照基本一致,鉴定化合物7为大黄素甲醚.
3 结语
对采自云南丽江的华丽牛肝菌新鲜子实体进行了化学成分研究,从中分离得到7个化合物,其中4个麦角甾类衍生物 (化合物1~4),1个糖醇类化合物(化合物5)和2个蒽醌类色素(化合物6、7).所有化合物均为首次从华丽牛肝菌新鲜子实体中分离得到,为了解该菌的化学成分提供参考.
对在线监控来说,主要在机电一体化技术支持下,能够让煤矿作业得到有效监控与管理,构成部分有电动机、供油设备和传动系统等。监控系统可以从设备状态出发,在发现有异常现象以后可以自动报警,并将设备具体位置发送给管理人员,以达到警示的作用。这样就极大减轻了工作人员工作量,煤矿设备日常维护效率也变得更高,管理人员通过及时采取解决措施,可以最大限度减少经济损失。此外,还可以对煤矿设备进行有效的故障诊断,将故障原因查找出来以后,通过采取一定解决方法,确保不影响正常的煤矿生产。
牛肝菌等颜色鲜艳真菌新鲜子实体中的色素类物质类型丰富,引人兴趣.已有研究表明一些血红色真菌如朱红丝膜菌(Dermocybesanguinea)含有大量的酸性蒽醌类色素物质,而大黄素正是这些色素物质的生源前体[13].本文研究结果显示,华丽牛肝菌未受伤子实体中主要的色素类物质是蒽醌类成分,这为了解牛肝菌的原生色素提供了参考.
[1] 卯晓岚.中国经济真菌[M].北京:科学出版社,1998:330.
[2] WADA T,HAYASHI Y,SHIBATA H.Asiaticusin A and B,novel prenylated phenolics fromBoletinusasiaticusandB.paluster(Boletaceae)Fungi[J].Bioscience,biotechnology and biochemistry,1996,60(1):120-121.
[3] STEFFAN B,STEGLICH W.Pigments from the cap Cuticle of the bayBoletuspigments[J].Angew Chem,1984,23(6):45-447.
[4] KAHNER L,DASENBROCK J,SPITELLER M.Polyene pigments from fruiting bodies ofBoletuslaetissimusandB.rufo-aureus(Basidiomycetes)[J].Phytochemistry,1998,49(6):1693-1697.
[5] REAUMONT P C,EDWARDS R.Constituents of the higher fungi.Part XI.Boviquinone-3,(2,5-dihydroxy-3-farnesyl-1,4-benzoquinone),Diboviquinone-3,4-methyl-enediboviquinone-3,3 and xerocomic acid fromGomphidiusrutilansFr.And diboviquinone-4,4 fromBoletusbovinus(Linn.ex Fr.)Kuntze[J].J Chem Soc,1971,C(14):2582-2585.
[6] VALISOLALAO J,LUU B,OURISSON G.Steroides cytotoxiques dePolyporusversicolo[J].Tetrahedron,1983,39(7):2779-2785.
[7] MISHRA P D,WAHIDULLA S,SOUZA L D,et al.Lipid constituents of marine spongeSuberitesCarnosus[J].Indian Journal of Chemistry,1996,35B:806-809.
[9] ISHIDA K,KANAT S Y.Ergosta-7,22-dien-3β-ol glycoside fromTylopilusneofellens[J].Phytochemistry,1989,28(3):945.
[10] 高锦明,董泽军,刘吉开.蓝黄红姑的化学成分[J].云南植物研究,2000,22(1):85-87.
[11] 刘兵,杨静,王曙.藏边大黄的化学成分研究[J].华西药学杂志,2007,72(1):33-35.
[12] 王爱芹,李军林,吴祖泽.华北大黄中非茋类成分的研究[J].中草药,2003,34(8):685-687.
[13] GILL M.Review:The Biosynthesis of Pigments in Basidiomycetes[J].Australian Journal of Chemistry,2002,54(12):721-734.
(责任编辑 王 琳)
Chemical constituents in the fruiting bodies ofBoletusmagnificusW.F.Chiu
HU Lin1,LIU Ji-kai2,WANG Fang-fang1
(1.Key Laboratory of Chemistry in Ethnic Medicinal Resources,State Ethnic Affairs commission and Ministry of Education,Yunnan Minzu University,Kunming,Yunnan 650500,China;2.State Key Laboratory of Phytochemistry and plant resources in West China Kunming Institute of Botany,China Academy of Science,Kunming 650204,China)
Seven compounds were isolated and purified from the fruiting bodies ofBoletusmagnificuscollected from Lijiang Prefecture of Yunnan province,with the help of the silica gel column chromatography (CC) and HPLC methods. The structures of these compounds were elucidated by the spectral analysis as follows: ergosta-7,22-dien-3β,5α,6β-triol(1),ergosta-4,6,8,(14),22-tetraen-3-one(2),ergosta-5,7,22-trien-3β-ol(3),ergosta-7,22-dien-3β-ol(4),D-allitol(5),emodin(6) and physcion(7). All the compounds were isolated from the fruiting bodies of B.magnificus for the first time.
BoletusmagnificusW. F. Chiu; fruiting bodies; chemical constituents
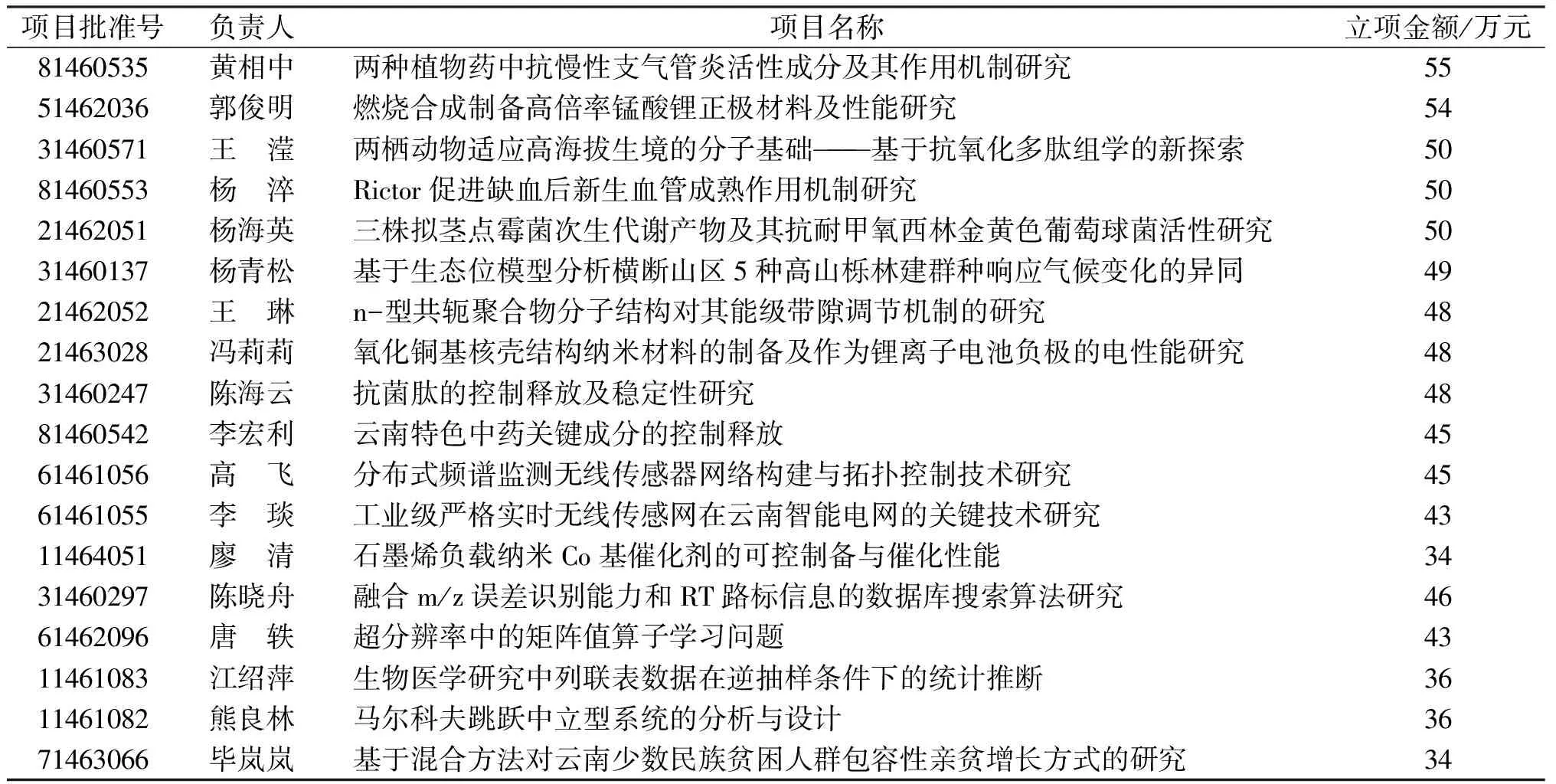
2014年云南民族大学获得国家自然科学基金资助项目
2014-11-24.
云南省技术创新暨产业发展基金(2011XB011).
胡琳(1976-),女,博士,副教授,硕士生导师.主要研究方向:民族药用植物的开发利用.
S685.12;R284.1
A
1672-8513(2015)02-0094-04

