细菌生物膜检测方法改进与应用
尤理想,赵 青,周 敏,汪意涛,吴淑燕,李嫄渊,黄 瑞
(苏州大学病原生物学系,江苏苏州 215000)
细菌生物膜检测方法改进与应用
尤理想,赵 青,周 敏,汪意涛,吴淑燕,李嫄渊,黄 瑞
(苏州大学病原生物学系,江苏苏州 215000)
针对结晶紫染色法为细菌生物膜(biofilm,BF)检测的经典方法存在的不足,通过增加乙酸用量和减少洗菌次数等进行改进后,BF测定更为准确。另尝试采用多模式小动物活体成像系统检测发光菌的BF形成,并利用培养板和小圆玻片探究BF在不同载体上的形成情况,以优化小动物活体成像系统检测方法。用改进后的2种方法摸索鼠伤寒沙门菌BF形成的最适浓度和时间,结果发现,接种浓度为107CFU/mL、培养72h时检测效果最佳。在BF检测方法优化的基础上。探究鼠伤寒沙门菌质粒对BF形成的影响,结果发现质粒可促进BF的形成。不同亚抑菌浓度双黄连对鼠伤寒沙门菌BF作用的实验结果显示,1/4MIC(MIC为最小抑菌浓度)双黄连对BF形成的抑制作用显著低于1/2MIC和1/8MIC,表明双黄连的抑菌作用与浓度不成正比关系,需严格控制临床用药剂量。
细菌生物膜;结晶紫染色;多模式小动物活体成像系统;鼠伤寒沙门菌质粒;双黄连
沙门菌(salmonella)主要经水和食物传播,可引起食物中毒、胃肠炎、伤寒和副伤寒等肠道疾病。鼠伤寒沙门菌(salmonella typhimurium)是最早被发现能引起大规模食物中毒的沙门菌之一,每年造成上亿人发病[1-2]。细菌生物膜(biofilm,BF)是细菌在生长过程中为适应生存环境而吸附于惰性或活性材料表面而形成的一种与浮游细菌相对应的生长方式[3],是由细菌及其产生的胞外多糖形成的特殊细菌群落。与浮游细菌相比,处于BF状态下的细菌对不利条件如干燥、极端温度、抗菌药物以及消毒剂的抵抗力均明显增强[4],目前认为99%的细菌以BF形式存在,65%~80%的人类感染性疾病与BF有关[5],成为临床上难治性感染的重要原因之一[6]。鼠伤寒沙门菌作为临床上常见的致病菌之一,其致病性和耐药性与BF密切相关。由此可见,BF的研究对临床疾病的诊疗具有十分重要的意义。结晶紫染色法是检测BF的常用方法之一[7],但在应用过程中常出现生物膜脱落、丢失、不能完好保存等弊端,因此本研究对结晶紫染色方法进行了优化。此外,首次利用小动物活体成像系统对发光菌的生物膜检测进行了初步探索。在BF检测方法和培养条件优化的基础上,探究了鼠伤寒沙门菌质粒与BF形成的关系,并检测不同亚抑菌浓度双黄连对鼠伤寒沙门菌BF形成的影响。
1 仪器
超净工作台(苏州苏净集团),生物安全柜(美国Baker公司),Allegra X-15R低温高速离心机(美国Beckman-Coulter公司),超低温冰箱(日本Sanyo公司),多模式小动物活体成像系统DXS4000pro(美国柯达公司),96孔板和24孔板(美国Corning公司),酶标仪MR450(美国Bio-Rad公司),721分光光度计(上海第三分析仪器厂)。
2 材料
(1)培养基:营养琼脂、LB肉汤培养基、MH肉汤培养基,均为杭州天和微生物试剂有限公司产。
(2)试剂:无水乙醇、33%乙酸溶液、2%结晶紫溶液(上海国药集团),99%甲醇溶液(上海凌峰化学试剂公司),注射用双黄连粉针剂(哈药集团)。
(3)受试菌:携带毒力质粒的鼠伤寒沙门菌野生株χ3306和质粒消除株χ3337由美国亚利桑那州立大学生物科学学院Roy Curtiss III教授惠赠;含有细菌荧光素酶操纵子lux的质粒pBEN276由法国自然资源研究所动物传染病和公共健康病原菌研究实验室Pierre Germon教授惠赠。本文使用的菌株为实验室已构建的含pBEN276的发光菌χ3306lux和χ3337lux。
3 方法
3.1 细菌培养和定量
将保存于-80℃的受试菌接种至LB肉汤,37℃培养过夜后转移至血平板活化,分区划线接种于营养琼脂平板,37℃培养过夜,分离纯化单菌落后做生化和血清学鉴定。用接种环挑取单菌落3~5个,接种于LB肉汤,37℃振荡培养16~18h。2 500r/min离心10min,弃上清;生理盐水(normal saline,NS)洗2次,弃上清;肉汤重悬。细菌定量方法参照文献[8]进行,分光光度计测受试菌液的吸光度OD600值,每次稀释采用10-1级(即取0.5mL菌液加入4.5mL无菌NS)连续稀释,调整菌液浓度,同时选取合适稀释度做平板菌落计数。
3.2 检测方法的改进
3.2.1 结晶紫染色法改进
结晶紫染色法参照文献[9]进行改进。具体过程如下:将χ3306lux按200μL/孔加入96孔板,调整菌液终浓度为107CFU/mL,用封口膜密封后于30℃培养24h或72h;将板内菌液吸弃,250μL NS洗2遍(原方法为3遍),每次洗菌后吸弃NS;加入200μL、99%甲醇固定15min,吸弃甲醇,室温干燥;加入200 μL 2%结晶紫溶液染色5min,吸弃结晶紫染液,NS洗2遍,室温干燥;加入220μL(原方法为200μL)33%乙酸溶解,混匀;酶标仪检测OD570值。每个样本做3个复孔,每次实验重复3遍。
3.2.2 小动物活体成像系统方法
将χ3306lux按1mL/孔加入24孔板,调整菌液终浓度为107CFU/mL,用封口膜密封后于30℃培养72h;将2板内菌液吸弃,1.2mL NS洗2遍,每次洗菌后吸弃NS,将24孔板放入成像暗箱平台,控制平台升降至一个合适的视野,自动关闭照明灯,在没有外界光源的条件下(暗场)拍摄由发光菌发出的特异光子,记录每孔光强度值。另一组在24孔板内加入小圆玻片后再加入菌液培养,其余方法同上。每个样本做3个复孔,每次实验重复3遍。
3.3 BF形成适宜条件的测定
将χ3306lux按200μL/孔加入96孔板,或按1mL/孔加入24孔板,调整菌液终浓度为108、107、106、105、104CFU/mL,30℃培养24h或72h,用改进后的结晶紫染色法和小动物活体成像系统测定BF。每个样本做3个复孔,每次实验重复3遍。
3.4 鼠伤寒沙门菌质粒对BF形成的影响
将χ3306lux和χ3337lux分别按200μL/孔加入96孔板,或1mL/孔加入24孔板,调整菌液终浓度为107CFU/mL,用封口膜密封后于30℃培养72h。用改良后的结晶紫染色法和小动物活体成像系统检测BF的形成。每个样本做3个复孔,每次实验重复3遍。
3.5 不同亚抑菌浓度双黄连对鼠伤寒沙门菌BF形成的影响
3.5.1 鼠伤寒沙门菌最小抑菌浓度(MIC)的测定
取无菌试管12支,第1管加入MH肉汤1.6 mL,其余每管加入1mL,在第1管加入双黄连原液(1 280g/L)0.4mL,混匀后吸取1mL至第2管,混匀后再吸取1mL至第3管,如此连续倍比稀释至第11管,并从第11管中吸弃1mL;然后每管加入χ3306lux1mL,使菌液终浓度为5×105CFU/mL,此时第1管至第12管药物浓度分别为128、64、32、16、8、4、2、1、0.5、0.25、0.125、0g/L;35℃培养20h后,以肉眼观察无细菌生长的药物浓度即为最小抑菌浓度MIC。选取1/2MIC、1/4MIC和1/8MIC作为不同亚抑菌浓度,用于以下实验。
3.5.2 不同亚抑菌浓度双黄连对鼠伤寒沙门菌BF形成的影响
将χ3306lux按100μL/孔加入96孔板,将双黄连按100μL/孔加入已有菌液的孔中,使菌液终浓度为107CFU/mL,双黄连的终浓度分别调整为每孔1/2MIC、1/4MIC和1/8MIC,用封口膜密封后于30℃培养72h,通过结晶紫染色法与小动物活体成像系统检测各孔BF。每个样本做3个复孔,每次实验重复3遍。
4 结果
4.1 改进后的结晶紫染色法测定结果
通过增加乙酸用量至220μL与减少洗菌次数至2次的优化后,用结晶紫染色法检测BF。结果发现优化后测得的BF量较优化前明显增加,见表1,差异具有统计学意义(p<0.05),表明改良后的结晶紫染色法对BF量用吸光度OD570表征测定更为准确。
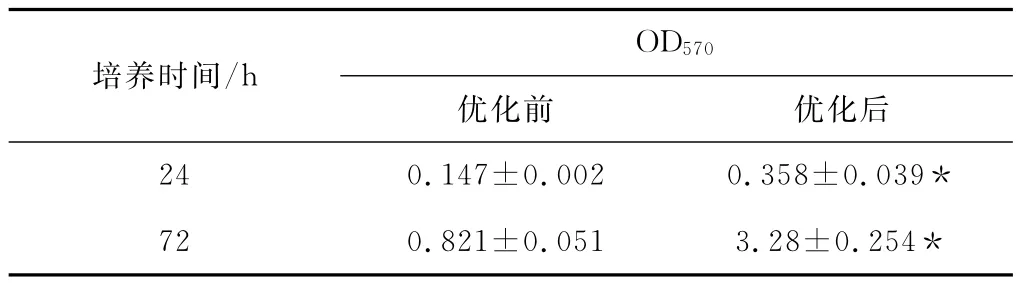
表1 结晶紫染色法检测24h与72hBF形成情况
4.2 小动物活体成像系统检测法改进后测定结果
经肉眼观察,加小圆玻片组BF虽然浮起,仍完整性较好。经小动物活体成像系统测得加小圆玻片组的光强度显著高于不加小圆玻片组,见图1和图2,差异具有统计学意义(p<0.05),表明小动物活体成像系统可用于发光菌BF的检测,加小圆玻片改良后检测效果更佳。
4.2 BF形成条件的优化
4.2.1 结晶紫染色法检测BF形成的最适浓度和时间
酶标仪检测不同时间和浓度下BF形成的OD570值见表2,结果显示培养24h和72h2个时间点,OD570值均在菌液浓度为107CFU/mL时最高(p<0.05);72h时各浓度菌液测得的OD570值均高于24h的相应浓度(p<0.05)。由此可见,接种细菌浓度为107CFU/mL、培养72h最有利于96孔板BF的形成。
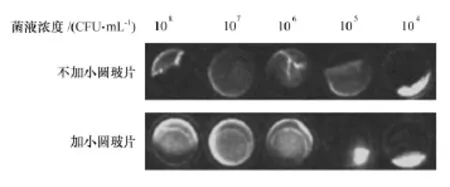
图1 小动物活体成像系统检测加与不加小圆玻片BF形成情况
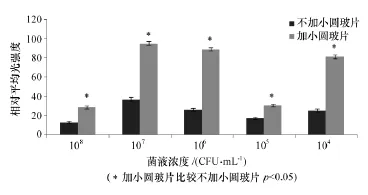
图2 小动物活体成像系统检测加与不加小圆玻片BF形成情况直方图
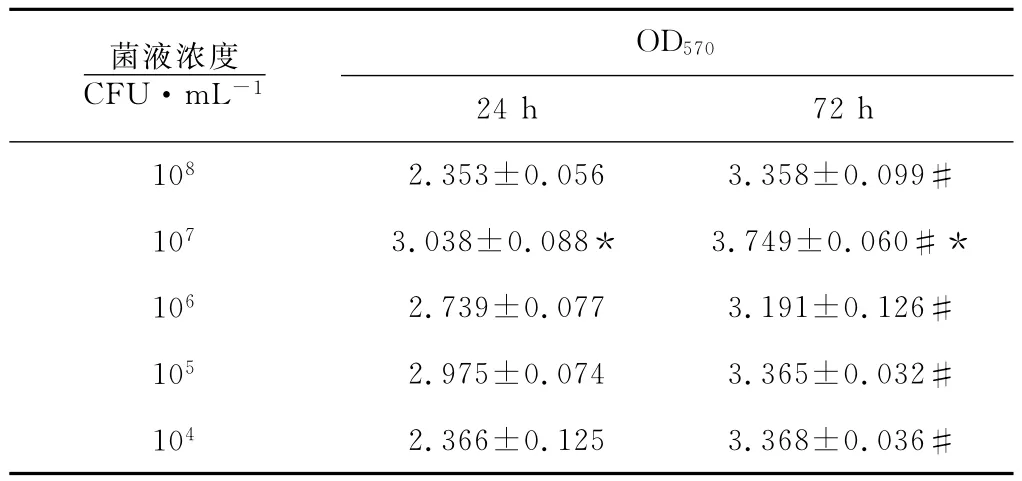
表2 结晶紫染色检测不同时间及细菌浓度下BF形成的OD570
4.2.2 小动物活体成像系统检测24孔板BF形成的最适浓度
不同浓度下各24孔板光强度如表3和图3所示。结果表明,接种细菌浓度107CFU/mL时,24孔板内BF的平均光强度较其他接种浓度均高,差异具有统计学意义(p<0.05),故接种细菌浓度107CFU/mL为24孔板BF形成的最适浓度。
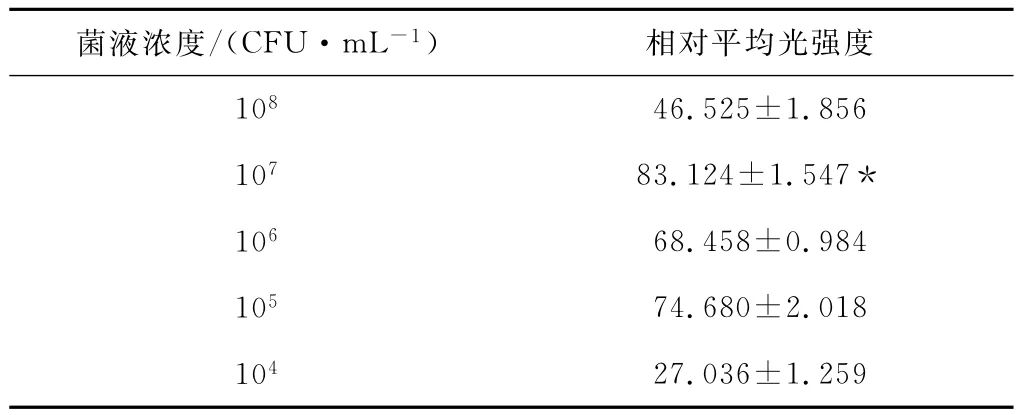
表3 小动物活体成像系统检测24孔板BF形成的最适浓度
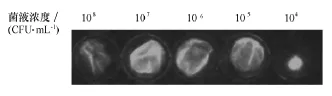
图3 小动物活体成像系统检测24孔板BF形成的最适浓度
4.2.3 小动物成像系统检测24孔板BF形成的最适时间
按细菌接种最适浓度107CFU/mL铺板,于30℃培养24、48、72h后,小动物活体成像系统检测不同时间点各24孔板平均光强度见表4。结果表明BF形成量在72h时最高,且与其余2个时间点的差异具有统计学意义(p<0.05)。因此24孔板BF形成的最适时间为培养72h。

表4 小动物活体成像系统检测24孔板在不同时间BF的形成情况
4.3 鼠伤寒沙门菌质粒对BF形成的影响
通过结晶紫染色法检测鼠伤寒沙门菌χ3306lux和χ3337lux在96孔板上形成的BF,结果见表5。结果发现χ3306lux的OD570值显著高于χ3337lux,差异具有统计学意义(p<0.05)。经小动物成像系统检测24孔板BF结果(见图4)显示,χ3306lux组的光强度显著高于χ3337lux组,与结晶紫染色法结果一致,即含毒力质粒的鼠伤寒沙门菌形成BF的能力比无质粒菌强。

表5 结晶紫染色法测沙门菌质粒对BF形成的影响
4.4 不同亚抑菌浓度双黄连对鼠伤寒沙门菌BF形成的影响
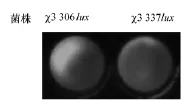
图4 小动物成像系统测沙门菌质粒对BF形成的影响
通过MIC测定实验,得出双黄连对χ3306lux的MIC为32g/L。用结晶紫染色法研究不同亚抑菌浓度双黄连对鼠伤寒沙门菌BF形成的作用的结果见表6。结果表明,加入双黄连组的BF形成量显著低于不加药组,1/4MIC组的OD570值明显高于1/2MIC和1/8MIC组,差异具有统计学意义(p<0.05),表明1/4MIC双黄连对鼠伤寒沙门菌BF形成的抑制作用最小。小动物成像系统检测24孔板BF形成结果(见图5)显示,1/4MIC组测得平均相对光强度最高,为22.403±1.374,1/2MIC组和1/8MIC组测得平均相对光强度分别为19.386±0.965和20.420±1.132,与结晶紫染色法一致,可见1/4MIC双黄连浓度下BF形成量较其他组多,差异具有统计学意义(p<0.05)。

表6 结晶紫染色法测亚抑菌浓度双黄连对BF形成的影响
5 讨论
结晶紫染色法是一种简单、方便、准确性相对较高、且应用广泛的方法。此方法的优化对有关BF的研究具有重要意义。实验结果表明,洗菌次数从3次改为2次后,BF损失降低;增加乙酸量至220μL可保证原气液面位置的BF完全溶解,改良后有助于更好地保留BF,检测结果更为准确。
小动物活体成像系统主要由CCD相机、成像暗箱、激光器、激发和发射滤光片、恒温台、气体麻醉系统、数据采集的计算机及数据处理软件等组成。生物发光成像是表达荧光素酶的活细胞与外源的荧光素反应,在一定时间内产生荧光现象,光强度与标记细胞数目成正比,具有特异性高、背景噪声低等优点。本实验使用的菌株带有的质粒pBEN276含荧光素酶基因操纵子luxCDABE,该基因是一种新型的报告基因,表达后产生荧光素酶及其底物,可发生特异作用而使其标记的细菌持续发光。以该基因作为报告源的生物发光特异性极强,不需外加底物,具有极低的背景和极高的信噪比,将其插入细菌染色体中稳定表达,可根据测得光信号水平直接得出发光细菌的相对数量,故导入质粒pBEN276的鼠伤寒沙门菌χ3306lux和χ3337lux可采用小动物活体成像系统进行检测。BF是由细菌及其产生的胞外多糖所形成的一种特殊细菌群落,可根据测得光信号水平直接观测BF形成情况,本实验首次探索了利用小动物成像系统检测发光菌BF的形成情况,结果证实该方法切实可行,可对BF形成情况进行直接的定性和定量分析,具有简便、直观的优点,为BF相关研究方法提供了借鉴。另外,通过该法检测在不同介质上BF的形成情况,证明小圆玻片的加入可有效防止BF被冲洗脱落,并可保存BF完整性。
本研究通过优化的结晶紫染色法和小动物活体成像检测法,测得BF在24孔板和96孔板形成的最适接种细菌浓度为107CFU/mL、最适培养时间为72h。结果表明,若接种浓度过高或培养时间过长,细菌可能由于营养缺乏不利于BF形成;而接种浓度过低或培养时间过短,则可能由于无法达到BF形成的最佳菌量而影响BF形成。
BF与质粒的影响是相互的[10],一方面,BF可保护细菌中质粒并影响其基因的表达,BF内细菌对不利条件如干燥、极端温度、抗菌药物和消毒剂等抵抗力均明显增强,且BF内细菌代谢状态不同,使细菌在任何状态下都能存活一部分,能够有效保存质粒,BF中存在调控机制,能促进质粒基因的表达;另一方面,质粒基因的表达也可影响BF的形成,包括促进和抑制两种作用。本文利用改进后的结晶紫染色法与小动物成像系统,探究了鼠伤寒沙门菌毒力质粒对BF形成的影响,结果发现含毒力质粒的鼠伤寒沙门菌形成BF的能力较强,推测鼠伤寒沙门菌质粒可促进BF的形成。
BF与临床感染相关疾病密切相关,BF形态下细菌的形态结构、生理生化特性等与普通浮游生长细菌显著不同,且细菌在BF保护屏蔽下可逃避抗菌药物杀伤作用和免疫细胞吞噬作用[11]。体外实验中,亚抑菌浓度抗菌药物对BF形成的调控作用可随抗菌药物种类、浓度、作用时间和菌种的不同而改变;同种抗菌药物对同一种属BF形成的影响,可因条件或菌株的差异呈现抑制或诱导等不同结果,且条件的改变会显著影响BF的形成[12],故亚抑菌浓度抗菌药物的使用需十分谨慎。本实验采用经优化改良的结晶紫染色法与小动物成像系统探究不同亚抑菌浓度双黄连对鼠伤寒沙门菌BF形成的影响,结果均发现1/4MIC双黄连比1/2MIC和1/8MIC双黄连对鼠伤寒沙门菌BF形成的抑制作用小,故可推测双黄连对鼠伤寒沙门菌BF形成的抑制作用并非随浓度增大而增强,提示双黄连的抑菌作用与浓度不成正比,因此在临床应用过程中,应严格控制双黄连的药物浓度。
(References)
[1]Van Damme P,Kafeja F,Anemona A,et al.Safety,immunogenicity and dose ranging of a new VI-CRM197conjugate vaccine against typhoid fever:rangomized clinical testing in healthy adults[J].PLoS One,2011(6):25398.
[2]Kouadio I K,Aljunid S,Kamigaki T,et al.Infectious diseases following natural disasters:prevention and control measures[J].Expert Rev Anti Infect Ther,2012(10):95-104.
[3]Watniek P,Kuher R.Biofihn city of microbes[J].J/3aLte-riol,2000(182):2675.
[4]He X,Ahn J.Differential gene expression in planktonic and biofilm cells of multiple antibiotic-resistant Salmonella typhimurium and Staphylococcus aureus[J].FEMS Microbial Lett,2011(325):180-188.
[5]Mellata M,Maddux J T,Nam T,et al.New insights into the bacterial fitness-associated mechanisms revealed by the characterization of large plasmids of an avian pathogenic E Coli[J].PLoS One,2012(7):29481.
[6]Stickler D J,Evans A,Morris N,et al.Strtegies for the control of catheter encrustation[J].Int J Antimicrob Agents,2002(19):499-506.
[7]Srdjan Stepanovic′.A modified microtiter-plate test for quantification of staphylococcal biofilm formation[J].Journal of Microbiological Methods,2000(40):175-179.
[8]周德庆.微生物学教程[M].北京:高等教育出版社,1996.
[9]Stepanovic S,Vukovic D,Dakic I,et al.A modified microtiterplate test for quantification of staphylococcal biofilm formation[J].Microbiol Methods,2000(40):175-179.
[10]周敏,尤理想,赵青,等.细菌生物膜的形成及耐药机制研究进展[J].微生物前沿,2013(2):98-101.
[11]王睿.细菌生物被膜耐药屏蔽及其防治 [J].中华老年多器官疾病杂志,2004(3):61-66.
[12]枉前,孙凤军,夏培元.亚抑菌浓度抗生素对细菌生物膜形成的影响[J].中国抗生素杂志,2009(34):200-204.
·字义辨析·
象 与 像
象指自然界、人或物的形态、样子,如:印象、表象、形象、现象、景象、函数图象等。
像指用模仿、比较等方法制成的人或物的形象,包括由光线形成的与原物相同或相似的图景,如:人像、摄像、画像、肖像、影像、图像、透镜成像等。
《实验技术与管理》编辑部 编录
Improved method of bacterial biofilm detection and its application
You Lixiang,Zhao Qing,Zhou Min,Wang Yitao,Wu Shuyan,Li Yuanyuan,Huang Rui
(Department of Microbiology,Soochow University,Suzhou 215000,China)
Crystal violet staining is a classical method for the detection of bacterial biofilm(BF),but remains deficiencies in mechanical process.In this study,the method is improved by increasing the amount of acetic acid and reducing washing times.The multi-mode small animal imaging system is used to detect the formation of luminous bacteria,using small circular glass and plastic plates to explore the formation of BF on different carriers to optimize the detection methods.By exploring the optimal concentration and culture time of Salmonella BF formation using the inmentioned improved detection methods,it is found that BF detected effect is the best when inoculating 107CFU/ml of bacteria and cultured for 72h.On the basis of the BF detection method optimization,this article explores the effects of Salmonella plasmid on biofilm formation,and the results show that the plasmid has a role in promoting BF formation.The experimental results of different sub-MIC of Shuanghuanglian on Salmonella BF formation show that 1/4MIC of Shuanghuanglian has the minimum inhibition effect to Salmonella BF formation compared with 1/2MIC and 1/8MIC of Shuanghuanglian,which hints at that the inhibition effect of Shuanghuanglian is not in direct proportion to its concentration and the dosage of clinical medicine needs to be strictly controlled.
bacterial biofilm;crystal violet staining;multi-mode small animal imaging system;salmonella typhimurium plasmid;shuanghuanglian
Q939.93
B
1002-4956(2015)3-0072-05
2014-07-29 修改日期:2014-09-11
江苏省自然科学基金项目(No.2011286);江苏省高等学校创新性实验计划项目(No.2012yb017)
尤理想(1991—),男,江苏连云港,临床医学七年制学生
吴淑燕(1972—),女,山东潍坊,博士,副教授,研究方向为分子微生物学
通信作者:李嫄渊(1980—),女,江苏苏州,博士,实验师,研究方向为分子微生物学.
E-mail:shuyanzw@aliyun.com

