东海内陆架沉积物中有机硫形态的K边XANES谱分析
陈良进, 朱茂旭*, 黄香利, 马陈燕, 赵屹东
东海内陆架沉积物中有机硫形态的K边XANES谱分析
陈良进1, 朱茂旭1*, 黄香利1, 马陈燕2, 赵屹东2
(1. 中国海洋大学 化学化工学院 海洋化学理论与技术教育部重点实验室, 山东 青岛266100; 2. 中国科学院 高能物理研究所北京同步辐射装置, 北京 100049)
有机硫是海洋沉积物重要的硫形态, 与有机质保存及多种元素的地球化学循环密切相关。利用硫的K边XANES谱从分子水平研究了东海内陆架沉积物中腐殖酸硫(HA-S)、富里酸硫(FA-S)以及铬不可还原有机硫(non-CROS)的形态及相对含量。结果表明, HA-S和FA-S总体上均以氧化态有机硫为主, 其相对平均含量分别为56%和69%, 而non-CROS则以还原态有机硫为主(>86%)。HA-S和FA-S的强还原态硫为还原态有机硫的主要组成, 磺酸盐和硫酸酯为HA-S中氧化态有机硫的主要组分, 硫酸酯为FA-S中氧化态有机硫的主要组分。FA-S的强还原态有机硫为硫化成因, HA-S的强还原态硫可能与硫化和生物成因有关, 而non-CROS的强还原态有机硫则主要为生物成因。如non-CROS能近似代表海洋沉积物中的有机硫总量, 则表明该沉积物中总有机硫以还原态硫为主; 而腐殖质硫(HA-S+FA-S)较高比例的氧化态硫则表明腐殖质硫不能全面反映沉积物中有机硫的组成和来源。
海洋沉积物; 有机硫; X射线吸收近边结构; 硫化; 东海
0 引 言
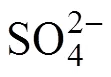
由于海洋沉积物中一般存在高含量的无机硫化物(特别是黄铁矿), 无法对所含有机硫含量及其组成进行直接测定和分析, 常需采用化学提取分离。目前有两种分离方法, 一种是酸性Cr(Ⅱ)提取无机还原硫后的有机硫, 即酸性Cr(Ⅱ)不可还原有机硫(non-CROS)[7]。研究表明[7–8], 无机还原硫(包括黄铁矿)提取过程中同时提取的有机硫很少, 因此, non-CROS被认为可近似代表沉积物中总有机硫的含量[9]。另一种是碱(0.5 mol/L NaOH)提取腐殖质硫, 提取的腐殖质硫可进一步分为腐殖酸硫(HA-S)和富里酸硫(FA-S)。在现代海洋沉积物中, 碱可提取的腐殖质硫占总有机硫的70%~94%[10], 是现代海洋沉积物中有机硫的主要组分。化学提取法操作简单, 可提供有机硫形态的定量信息[11–12], 但由于有机硫的多样性以及生物/非生物循环的复杂性, 该方法不能确定有机硫的成因及来源, 更不能提供化学组成和氧化态的信息。尽管腐殖质硫和non-CROS都常作为沉积物中有机硫的重要对象, 但目前并不清楚两者之间在组成上的差异。
硫的X射线吸收近边结构(XANES)谱是探测硫的不同氧化态及其功能团吸收X光后电子跃迁(1s®3p)的能量变化的技术, XANES谱对硫的电子结构、氧化态以及相邻配位原子的空间构型非常敏感, 因此, 可作为硫的不同形态(包括氧化态及功能团)的指纹谱[13], 且该技术能做到对样品的无损分析[14]。从理论上讲, 硫的XANES谱能揭示出样品中存在的所有硫的形态及其相对含量, 是从分子水平上研究有机硫功能团组成及硫的氧化态的重要技术, 近些年得到了广泛应用[15–16]。
中国东海是世界上的大型边缘海之一, 其沉积物是陆源和海源有机质积累的重要场所, 也是有机质矿化的重要场所[17]。硫酸盐还原是该沉积物中有机质矿化的重要路径, 硫的成岩循环活跃[18–19]。目前, 对该海域沉积物中有机硫的研究还很有限。本研究拟结合化学提取和K边XANES谱技术从分子水平上研究东海内陆架泥质沉积物中HA-S、FA-S和non-CROS三种操作定义的有机硫中的含硫功能团的相对含量及氧化态, 并比较腐殖质硫(HA-S+ FA-S)与non-CROS之间在组成上和不同深度上的差异。由于东海内陆架泥质沉积物相对富含有机质和活性铁, 硫和铁的早期成岩过程更活跃, 因此, 这一研究有助于深入揭示整个东海沉积物中主要的硫成岩循环路径和硫的形态变化。
1 材料与方法
1.1 样品采集和保存
2011年10月22日在东海内陆架泥质区DH7-1站点(27°23.091′N, 121°10.204′E)采集重力柱样(如图1)。柱样采集后立即在船上切割分样, 上部45 cm以4~5 cm间隔分割, 45 cm以下以10 cm间隔分割。分割后的样品在N2条件下装入塑料袋中密封, 置于冷冻柜内冷冻(-18℃)直至样品预处理。
1.2 样品处理
1.2.1 酸性Cr(Ⅱ)不可还原有机硫(non-CROS)样品制备
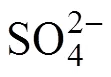

图1 东海环流体系及东海沉积物DH7-1站位图
KC–黑潮; TWC–台湾暖流; JCC–江苏沿岸流; YDW–长江冲淡水; ZFCC–浙闽沿岸流
KC–kuroshio current; TWC–Taiwan warm current; JCC–Jiangsu coastal current; YDW–Yangtze diluted water; ZFCC–Zhejiang-Fujian coastal current
1.2.2 沉积物腐殖酸硫(HA-S)和富里酸硫(FA-S)样品制备
HA-S和FA-S的提取沿用Zhu.[22]描述的方法。在N2条件下称取约5 g沉积物湿样, 加入20 mL 0.5 mol/L NaCl去除可溶性硫酸盐, 振荡2 h后离心、洗涤3次。在通入N2条件下向剩余固体中加入20 mL 1 mol/L HCl和20 mL丙酮, 分别去除AVS和元素硫, 振荡12 h后离心、洗涤3次。向剩余固体中加入15 mL 0.5 mol/L NaOH, 振荡12 h后收集上清液, 此过程重复5~8次, 直至提取液呈微黄色为止。所收集上清液即为腐殖质, 将其酸化到pH=2, 沉淀为腐殖酸, 清液为富里酸, 静置48 h后离心、过滤将两者分离。腐殖酸用6 mol/L HCl洗涤、离心3次, 置于0.2 mL离心管中密封并于-18 ℃下冷冻直至XANES谱测定, 富里酸经冷冻干燥后用于XANES测定。
1.3 XANES谱测定
硫的K边XANES测定在北京同步辐射装置4B7A中能站进行, 在荧光模式下收集XANES谱。小心将样品涂在不含硫的导电胶带上, 涂层厚度5~6 μm, 然后将其垂直于入射光固定于样品室中, 用于测定XANES谱。通过Si(111)双晶单色器获得X光, 能量分辨率(D/)为1.4´10–4, X光能量用单质硫进行定标。调节能量范围从硫吸收边边前50 eV至边后200 eV, 最终确定实验所用入射X射线能量为2460~2540 eV, 步长为0.2 eV。光束室为超高真空环境, 光束聚焦到样品中形成直径1 mm的光斑, 使用Si(Li)固体检测器获取光谱数据。
2 XANES谱分析
XANES谱分析通常采用基于标准物质的线性叠加拟合(LCF)和高斯曲线拟合(GCF)两种方法。近年, Prietzel.[23]和Manceau.[24]对这两种方法进行了系统的比较。总体而言, LCF优于GCF, 但前者的精度很大程度上受制于标准物质是否能真正代表被测样品中的组成; 当无法获得特定的标准物质时, GCF是首选的方法, 且对复杂体系中多组分形态的预测不受标准物质数量的限制。Manceau.[24]的研究表明, 对于GCF, 只要严格按照他们细化的拟合流程进行, 与LCF拟合结果之间的差异小于(4.5±3.0)%。我们未能较全面收集到有机硫化合物标准物质, 因此, 本研究中采用GCF方法并按照Manceau.[24]的拟合流程进行XANES谱分析。用ATHENA软件包解析硫的K边XANES谱。经背景扣除和归一化后, 通过高斯曲线拟合确定硫的形态、相对含量, 即用一系列高斯函数(即白线)G和两个反正切函数(1和2)的叠加来拟合实测的XANES谱。高斯函数代表硫元素1s®3p的跃迁, 两个反正切函数代表入射光电子到连续态的跃迁, 低能量反正切函数(step1, 2475.75 eV)代表所有还原态硫元素的跃迁, 高能量反正切函数(step2, 2482.30 eV)代表所有氧化态硫元素的跃迁[24]。研究表明, 硫的1s®3p跃迁峰的峰能量及强度与该硫原子的电子氧化态(EOS)密切相关, EOS越大, 吸收峰能量越高[13,25,26]。EOS代表实际键合环境中硫元素在价电子层中的相对电荷密度。在含有还原态硫的复杂有机物中, EOS与表观氧化态(化合价)差别较大, 且硫的EOS与相连的其他原子(如S、H、C、金属)的种类有关; 但高价态(> +4)硫以及硫与多个氧结合时, 由于氧原子具有较高的电负性, EOS与表观氧化态的差别佷小[25]。尽管在不同装置的X光束下相同硫形态的吸收峰能量略有差别, 同一形态的不同相态(如固相、液相)间的吸收峰能量也略有不同, 但EOS和吸收峰能量之间都呈现良好的线性关系[27]。Zeng.[26]编辑大量不同标准含硫物质的EOS及所对应的吸收峰能量, 得到如下线形关系:
= 0.6179-1528 (2= 0.99) (1)
为EOS,为吸收峰能量。根据该关系式可计算出拟合曲线中各高斯函数所代表的硫形态的EOS。本研究按惯用方法, 低价态(≤+4)硫的EOS为式(1)直接计算的结果(非整数), 高价态(> +4)硫的EOS按式(1)计算后取整数[28]。各高斯函数所代表的硫形态的相对含量可通过对应面积占所有高斯函数总面积的份数得到, 但需指出的是, 由于EOS对X光吸收截面的依赖关系, 需对高斯峰面积进行校正[24,29]。Manceau.[24]得到了一个通用的校正关系式:
= 0.36841-909.97 (2)
为最大吸收能量,为元素硫(= 2472.70 eV)归一化校正因子。校正后的峰面积为:
=/(3)
为校正后的峰面积,为表观峰面积,为吸收峰能量所对应的校正因子。通过高斯拟合得到每个高斯峰的面积, 经归一化校正后各高斯峰的校正面积占高斯峰总校正面积的百分比即为各形态硫对应的相对含量(%)。高斯曲线拟合的还原态硫相对含量的相对误差为4%~8%, 氧化态硫相对含量的相对误差小于5%。
3 结 果
代表性XANES谱图及高斯拟合曲线如图2, HA-S、FA-S和non-CROS可分别用6、8和5个高斯函数来拟合, 表明都存在多种硫形态。将拟合得到的高斯函数按EOS依次增大的顺序进行编号, HA-S的6个高斯峰为G1~G6, FA-S的8个高斯峰为G1~G8, non-CROS的5个高斯峰为G1~G5。需指出的是, HA-S、FA-S和non-CROS之间相同编号的高斯峰不具有对应关系。各形态的相对含量及EOS如表1。
HA-S中低价(EOS<4)有机硫份数为26.1%~ 61.9%(平均44%), 上部18 cm范围内低价有机硫份数低于深部, 且低价有机硫主要以强还原态(G1)为主(17.4%~57.8%)。高价(EOS≥4)有机硫份数为38.4%~73.9%(平均56%), 上部18 cm范围内高价有机硫份数高于深部, 总体上G6的份数高于G5。FA-S中高价有机硫份数为52.3%~82.8%(平均68.9%), 高于低价有机硫(17.2~47.7%)。其中高价有机硫以强氧化态(G8)为主, 而低价有机硫以强还原态(G1)为主, 其次为G2, 其他低价有机硫的份数很小。non-CROS中的硫主要由低价有机硫组成(85.6%~96%, 平均90.8%), 且以强还原态(G1和G2)占主导地位。高价有机硫(G4+G5)的份数仅占4%~14.5%, 且随深度增加呈现减小的趋势。
4 讨 论
4.1 腐殖质硫的形态及其可能成因
4.1.1 HA-S
根据EOS大小, 有机硫可分为四类: (1)强还原态有机硫(EOS≤1); (2)弱还原态有机硫(1< EOS <4); (3)弱氧化态有机硫(4≤EOS≤5); (4)强氧化态有机硫(EOS=6)。前两者合称为还原态有机硫, 后两者合称为氧化态有机硫[24,27]。强还原态有机硫包括硫醇、有机单硫化物、有机二硫化物、有机多硫化物及噻吩等; 弱还原态有机硫包括亚砜类有机硫; 强氧化态有机硫包括砜类及磺酸盐类有机硫。其中, EOS=5、6的有机硫可分别明确归为磺酸盐和硫酸酯[28,30,31]。
在DH7-1站点沉积物中, HA-S中的还原态有机硫以强还原态有机硫(G1+G2, 24.4%~59.6%)为主, 弱还原态硫(G3+G4)所占比例很少(1.2%~9.8%, 平均3.41%)。磺酸盐(G5)和硫酸酯(G6)为主要的氧化态有机硫, 分别占15.5%~30%和17.9%~44.8%。还原态有机硫相对含量总体上低于氧化态有机硫(38.4%~73.9%, 平均56%), 这与富含有机质的秘鲁边缘海沉积物及富含有机质、贫铁的佛罗里达湾沉积物中的情况一致[32]。需指出的是, 秘鲁边缘海以及佛罗里达湾表层沉积物均为还原性沉积物, 而东海沉积物10~30 cm深度范围内氧化还原电位为30~100 mV, 为相对氧化的环境, 这主要由表层流动泥所致[33]。此外有研究证实[24–25], 还原性淡水沉积物中还原性有机硫明显高于氧化性有机硫, 但氧化性淡水沉积物中则正好相反, 这与海洋沉积物中HA-S的情况不同。以上结论似乎表明, 海洋沉积物中, 氧化还原条件并不是决定HA-S中氧化态和还原态有机硫相对含量的关键因素。造成上述差别的原因尚不清楚, 但有研究表明, 海洋沉积物中的腐殖酸具有较低的成岩活性[10,22], 这可能是导致HA-S中氧化态和还原态有机硫相对含量对氧化还原环境不敏感的原因之一。


表1 HA-S、FA-S、non-CROS中硫的形态及相对含量(%)
注:表格中上角“#”表示整个深度范围内EOS的变化范围

磺酸盐和硫酯(38.4%~73.9%)是海洋沉积物HA-S的重要组成部分, 这与前人研究结果一致[32]。目前, 对这两种重要有机硫的形成机制及归宿还不十分清楚。一般认为, 硫酯的形成机制与生物合成有关[29], 而磺酸盐既可能是生物成因的, 也可能是非生物成因的[31,32,34], XANES谱研究无法对此做出判断。
4.1.2 FA-S
淡水沉积物中FA-S的XANES谱已有广泛研究[13,16,24,25], 但海洋沉积物中FA-S的研究还未见报道。在DH7-1站点, FA-S中氧化态有机硫相对含量(52.3%~82.8%, 平均69%)大于还原态, 这与HA-S的特征相似。氧化态有机硫中最主要的组分为硫酯(G8); 还原态有机硫以强还原态有机硫(G1+G2)为主(10.3%~36.7%), 弱还原态有机硫所占比例较小, 甚至可忽略不计。相对较高的强还原态有机硫可能是硫化作用的结果, 我们的研究表明[22], 富里酸易于发生硫化, 东海内陆架沉积物中FA-S的34SFA-S明显亏损也证实硫化作用的发生。Einsiedl.[16]的XANES谱研究表明, 德国南部Franconian深层地下水FA-S的强还原态有机硫相对含量较浅层地下水中的高是富里酸硫化的结果, 且得到了硫同位素组成的证实。在28~48 cm深度范围内G1份数的高值(表1)可能反映了该深度范围硫化物生成以及有机质硫化最活跃, 这与东海内陆架沉积物中该深度范围内酸可挥发性硫化物及黄铁矿含量也处于高值基本吻合[20]。尽管海洋沉积物中的富里酸易于发生硫化, 但东海内陆架沉积物中强还原态有机硫相对含量明显低于强氧化态有机硫的相对份数, 这表明, 即使这些强还原有机硫都是硫化作用的结果, 硫化作用对FA-S的贡献也有限。由此可见, 硫化作用不是导致FA-S在该沉积物中埋藏的重要地球化学过程。
根据XANES谱分析结果, 东海沉积物中FA-S的组成与淡水沉积物中的差异较大, 在氧化态硫中, 硫酯相对含量明显高于淡水沉积物的对应值; 在还原态硫中, 强还原态有机硫的相对含量明显低于淡水沉积物中的对应值[24–25]。这些差异可能是不同有机质来源或不同生物地球化学过程所致, 还有待进一步研究。
4.2 non-CROS形态及其与腐殖质硫(HA-S+FA-S)的比较
non-CROS被认为可近似代表沉积物中总有机硫含量[9], 但这一结论并未得到广泛的验证。到目前为止, non-CROS的XANES谱研究还未见报道, 本研究首次利用XANES谱从分子水平揭示该有机硫的组成。从图2和表1可看出, 在DH7-1站点, non-CROS的还原态有机硫由三种有机硫形态(G1、G2、G3)组成, 且以G1和G2为主, G1+G2+G3三者占non-CROS的86%以上; 氧化态有机硫为磺酸盐(G4)和硫酸酯(G5), 两者所占比例较小, 表明non-CROS主要以还原态形式存在。尽管该沉积物中的non-CROS以还原态硫为主, 还原态硫的成因可能并非以硫化作用为主, 而是以生物成因为主, 因为我们对东海内陆架其他站位沉积物中non-CROS的同位素组成(34Snon-CROS)的分析表明[20], non- CROS中硫化作用的贡献小于40%。
从前面的分析可知, HA-S和FA-S总体上都以氧化态为主, 因此, 腐殖质硫(HA-S + FA-S)也以氧化态形式为主, 而non-CROS则相反。可见, non-CROS与腐殖质硫的组成差异很大。如果non-CROS真能近似代表沉积物中有机硫总量, 则表明该沉积物中总有机硫以还原态硫为主。以此为参照, 腐殖质硫中较高的氧化态硫则表明, 传统的碱提取不能有效提取还原态有机硫, 因此, 腐殖质硫不能全面反映沉积物中有机硫的组成和来源。
5 结 论
(1) 总体而言, 东海内陆架沉积物中HA-S以氧化态有机硫为主(平均56%)。其中, 强还原态有机硫为还原态有机硫的主要组分, 磺酸盐和硫酸酯为氧化态有机硫的主要组分。HA-S中还原态有机硫份数对沉积物的氧化还原条件不敏感, 这与淡水沉积物中HA-S的情况不同。在沉积物深部, HA-S中强还原态有机硫份数的增加与硫化作用有关, 但不排除生物成因。
(2) 与HA-S相似, FA-S也以氧化态有机硫为主(平均69%)。硫酸酯为氧化态有机硫的主要组分; 强还原态有机硫为还原态有机硫的主要组分, 且以硫化成因为主。
(3) 还原态有机硫为non-CROS主要组分(>86%), 且以生物成因为主。如果non-CROS能近似代表沉积物中有机硫总量, 则表明该沉积物中的总有机硫以高还原性硫为主; 而腐殖质硫以氧化态硫为主, 这表明碱不能有效提取还原态有机硫。因此, 腐殖质硫不能全面反映沉积物中有机硫的组成和来源。
[1] Anderson T F, Pratt L M. Isotopic evidence for the origin of organic sulfur and elemental sulfur in marine sediments[M]// Vairavamurthy M A, Schoonen M A A. Geochemical Transformations of Sedimentary Sulfur. Washington DC: ACS Symposium Series 612, 1995: 378–396.
[2] Werne J P, Lyons T W, Hollander D J, Schouten S, Hopmans E C, Sinninghe Damsté J S. Investigating pathways of diagenetic organic matter sulfurization using compound-specific sulfur isotope analysis[J]. Geochim Cosmochim Acta, 2008, 72(14): 3489–3502.
[3] Werne J P, Lyons T W, Hollander D J, Formolo M J, Sinninghe Damsté J S. Reduced sulfur in euxinic sediments of the Cariaco Basin: Sulfur isotope constraints on organic sulfur formation[J]. Chem Geol, 2003, 195(1): 159–179.
[4] Sinninghe Damsté J S, Eglinton T I, De Leeuw J W, Schenck P A. Organic sulphur in macromolecular sedimentary organic matter: I. Structure and origin of sulphur-containing moieties in kerogen, asphaltenes and coal as revealed by flash pyrolysis[J]. Geochim Cosmochim Acta, 1989, 53(4): 873–889.
[5] Xia K, Skyllberg U L, Bleam W F, Bloom P R, Nater E A, Helmke P A. X-ray absorption spectroscopic evidence for the complexation of Hg (II) by reduced sulfur in soil humic substances[J]. Environ Sci Technol, 1999, 33(2): 257–261.
[6] 吕仁燕, 朱茂旭, 李铁, 杨桂朋, 邓霏霏. 东海陆架泥质沉积物中固相Fe形态及其对有机质、Fe、S成岩路径的制约意义[J]. 地球化学, 2011, 40(7): 363–371. Lü Ren-yan, Zhu Mao-xu, Li Tie, Yang Gui-peng, Deng Fei-fei. Speciation of solid-phase iron in mud sediments collected from the shelf of the East China Sea: Constraints on diagenetic pathways of organic matter, iron, and sulfur [J]. Geochimica, 2011, 40(7): 363–371 (in Chinese with English abstract).
[7] Canfield D E, Boudreau B P, Mucci A, Gundersen J K. The early diagenetic formation of organic sulfur in the sediments of Mangrove Lake, Bermuda[J]. Geochim Cosmochim Acta, 1998, 62(5): 767–781.
[8] Canfield D E, Raiswell R, Westrich J T, Reavse C M, Berner R A. The use of chromium reduction in the analysis of reduced inorganic sulfur in sediments and shales[J]. Chem Geol, 1986, 54(1): 149–155.
[9] Passier H F, Böttcher M E, De Lange G J. Sulphur enrichment in organic matter of eastern Mediterranean sapropels: A study of sulphur isotope partitioning[J]. Aquat Geochem, 1999, 5(1): 99–118.
[10] Brüchert V. Early diagenesis of sulfur in estuarine sediments: the role of sedimentary humic and fulvic acids[J]. Geochim Cosmochim Acta, 1998, 62(9): 1567–1586.
[11] Francois R. A study of sulphur enrichment in the humic fraction of marine sediments during early diagenesis[J]. Geochim Cosmochim Acta, 1987, 51(1): 17–27.
[12] 张伟, 刘丛强, 刘涛泽, 李晓东, 张丽丽. 喀斯特坡地石灰土硫形态分布及其同位素组成特征[J]. 地球化学, 2010, 39(3): 251–257. Zhang Wei, Liu Cong-qiang, Liu Tao-ze, Li Xiao-dong, Zhang Li-li.Sulfur species and isotopic compositions in limestone soils on slopes of karst regions[J]. Geochimica, 2010, 39(3): 251–257 (in Chinese with English abstract).
[13] Morra M J, Fendorf S E, Brown P D. Speciation of sulfur in humic and fulvic acids using X-ray absorption near-edge structure (XANES) spectroscopy[J]. Geochim Cosmochim Acta, 1997, 61(3): 683–688.
[14] Jalilehvand F. Sulfur: Not a “silent” element any more[J]. Chem Soc Rev, 2006, 35(12): 1256–1268.
[15] Einsiedl F, Schäfer T, Northrup P. Combined sulfur K-edge XANES spectroscopy and stable isotope analyses of fulvic acids and groundwater sulfate identify sulfur cycling in a karstic catchment area[J]. Chem Geol, 2007, 238(3): 268–276.
[16] Einsiedl F, Mayer B, Schäfer T. Evidence for incorporation of H2S in groundwater fulvic acids from stable isotope ratios and sulfur K-edge X-ray absorption near edge structure spectroscopy[J]. Environ Sci Technol, 2008, 42(7): 2439–2444.
[17] Kao S J, Lin F J, Liu K K. Organic carbon and nitrogen contents and their isotopic compositions in surficial sediments from the East China Sea shelf and the southern Okinawa Trough[J]. Deep Sea Res II, 2003, 50(6): 1203–1217.
[18] Huang K M, Lin S. The carbon-sulfur-iron relationship and sulfate reduction rate in the East China Sea continental shelf sediments[J]. Geochem J, 1995, 29(5): 301–315.
[19] Lin S, Huang K M, Chen S K. Organic carbon deposition and its control on iron sulfide formation of the southern East China Sea continental shelf sediments[J]. Cont Shelf Res, 2000, 20(4): 619–635.
[20] Zhu M-X, Shi X-N, Yang G-P, Hao X-C. Formation and burial of pyrite and organic sulfur in mud sediments of the East China Sea inner shelf: constraints from solid-phase sulfur speciation and stable sulfur isotope[J]. Cont Shelf Res, 2013, 54(2): 24–36.
[21] Hsieh Y P, Yang C H. Diffusion methods for the determination of reduced inorganic sulfur species in sediments[J]. Limnol Oceanogr, 1989, 34(6): 1126–1130.
[22] Zhu M X, Huang X L, Yang G P, Hao X C. Speciation and stable isotopic compositions of humic sulfur in mud sediment of the East China Sea: Constraints on origins and pathways of organic sulfur formation[J]. Org Geochem, 2013, 63(1): 64–73.
[23] Prietzel J, Botzaki A, Tyufekchieva N. Sulfur speciation in soil by S-edge XANES spectroscopy: Comparison of spectral deconvolution and linear combination fitting[J]. Environ Sci Technol, 2011, 45(7): 2878–2886.
[24] Manceau A, Nagy K L. Quantitative analysis of sulfur functional groups in natural organic matter by XANES spectroscopy[J]. Geochim Cosmochim Acta, 2012, 99(1): 206–223.
[25] Xia K, Weesner F, Bleam W F, Skyllberg U L, Helmke P A. XANES studies of oxidation states of sulfur in aquatic and soil humic substances[J]. Soil Sci Soc Am J, 1998, 62(5): 1240–1246.
[26] Zeng T, Arnold W A, Toner B M. Microscale characterization of sulfur speciation in lake sediments[J]. Environ Sci Technol, 2013, 47(3): 1287–1296.
[27] Huffman G P, Mitra S, Huggins F E, Shah N, Vaidya S, Lu F L. Quantitative analysis of all major forms of sulfur in coal by X-ray absorption fine structure spectroscopy[J]. Energy Fuels, 1991, 5(4): 574–581.
[28] Zhao F J, Lehmann J, Solomon D, Fox M A, McGrath S P. Sulphur speciation and turnover in soils: Evidence from sulphur K-edge XANES spectroscopy and isotope dilution studies[J]. Soil Biol Biochem, 2006, 38(5): 1000–1007.
[29] Waldo G S, Carlson R M K, Moldowan J M, Peters K E, Pennerhahn J E. Sulfur speciation in heavy petroleums: Information from X-ray absorption near-edge structure[J]. Geochim Cosmochim Acta, 1991, 55(3): 801–814.
[30] Solomon D, Lehmann J, de Zarruk K K, Dathe J, Kinyangi J, Liang B Q, Machado S. Speciation and long-and short-term molecular-level dynamics of soil organic sulfur studied by X-ray absorption near-edge structure spectroscopy[J]. J Environ Qual, 2011, 40(3): 704–718.
[31] Vairavamurthy A, Zhou W, Eglinton T, Manowitz B. Sulfonates: A novel class of organic sulfur compounds in marine sediments[J]. Geochim Cosmochim Acta, 1994, 58(21): 4681–4687.
[32] Vairavamurthy M A, Maletic D, Wang S, Manowitz B, Eglinton T, Lyons T. Characterization of sulfur-containing functional groups in sedimentary humic substances by X-ray absorption near-edge structure spectroscopy[J]. Energy Fuels, 1997, 11(3): 546–553.
[33] Aller R C, Mackin J E, Ullman W J, Wang C H, Tsai S M, Jin J C, Sui Y N, Hong J Z. Early chemical diagenesis, sediment- water solute exchange, and storage of reactive organic matter near the mouth of the Changjiang, East China Sea[J]. Cont Shelf Res, 1985, 4(1): 227–251.
[34] Kiene R P, Visscher P T. Production and fate of methylated sulfur compounds from methionine and dimethylsulfoniopropionate in anoxic salt marsh sediments[J]. Appl Environ Microbiol, 1987, 53(10): 2426–2434.
[35] Bottrell S H, Mortimer R J G, Davies I M, Harvey M S, Krom M D. Sulphur cycling in organic-rich marine sediments from a Scottish fjord[J]. Sedimentology, 2009, 56(4): 1159–1173.
Speciation of organic sulfur in inner shelf sediments of the East China Sea: Evidence from K-edge XANES spectroscopy
CHEN Liang-jin1, ZHU Mao-xu1*, HUANG Xiang-li1, MA Chen-yan2and ZHAO Yi-dong2
1. Key Laboratory of Marine Chemistry Theory and Technology, Ministry of Education, College of Chemistry and Chemical Engineering, Ocean University of China, Qingdao 266100, China; 2.Beijing Synchrotron Radiation Facility, Institute of High Energy Physics, Chinese Academy of Sciences, Beijing 100049, China
Organic sulfur (OS) is an important sulfur pool in marine sediments and has important influence on the preservation of organic matter and geochemical cycle of various elements. Sulfur K-edge XANES spectroscopy has been used to investigate, on the molecular level, the speciation and relative fractions of humic acid sulfur (HA-S), fulvic acid sulfur (FA-S) and non chromium reducible organic sulfur (non-CROS) in sediments of the East China Sea inner continental shelf. Results show that oxidized OS is generally the predominant species in both the HA-S and FA-S, on average accounting for 56% and 69% of HA-S and FA-S, respectively. However, reduced OS is the predominant components of the non-CROS. For both the HA-S and FA-S, strongly reduced OS accounts for the majority of the reduced OS. Sulfonates and ester-sulfates are the major components of the oxidized OS in the HA-S, and ester-sulfates are the major components of the oxidized ones in the FA-S. The formation of the strongly reduced OS in the HA-S, FA-S, and non-CROS can be ascribable to sulfurization/biogenesis, sulfurization, and biogenesis, respectively. If non-CROS is really an approximate representation of total OS in marine sediments, it follows that total OS is characterized by high fraction of highly reduced components in the sediments. Thus high fraction of oxidized components in humic sulfur (HA-S + FA-S) indicates that base-extractable humic sulfur cannot comprehensively reflect the compositions and the sources of OS in the bulk sediments.
marine sediment; organosulfur; X-ray absorption near edge structure (XANES); sulfurization; the East China Sea
P595, P593
A
0379-1726(2015)01-0061-10
2013-08-03;
2013-12-08;
2014-01-23
国家自然科学基金(41076045); 山东省自然科学基金(ZR2011DM003)
陈良进(1989–), 男, 硕士研究生, 应用化学专业。E-mail: cljchaiwolf@126.com
ZHU Mao-xu,E-mail: zhumaoxu@ouc.edu.cn; Tel: +86-532-66782513

