可见光下高催化活性不同结构Sr/TiO2催化剂的制备和表征
蒋孝佳 贾建明 卢晗锋 朱秋莲 黄海凤,*
(1浙江工业大学生物与环境工程学院,杭州310014;2浙江工业大学化学工程学院,催化反应工程研究所,杭州310014)
1 引言
随着人们对环境问题的广泛关注,半导体光催化技术成为了近几年的研究热点.1-5目前,光催化技术主要应用于气相污染物、6染料废水7及其他特殊污染物8的净化.钙钛矿型SrTiO3复合氧化物因其具有良好的光催化活性、高稳定性以及无毒等特点受到了国内外学者的广泛研究.9-12可见光响应的光催化活性是导带与价带之间新带隙的生成所导致的.13-15但由于SrTiO3钙钛矿禁带宽度为3.2 eV左右,16,17在紫外光下才能激发光生电子,且量子效率低,其应用受到了限制.而有研究18,19发现构造不同的异质结构可以拓宽钙钛矿型SrTiO3的光响应范围.Yang及其合作者20成功合成了纳米管状的一维SrTiO3,认为催化剂的性能提高与其微观结构有关.Bi及其合作者21合成了异质结构的SrTiO3/TiO2纳米管阵列,并发现过量的NaOH能够防止TiO2的管状结构遭到破坏从而改善了催化剂的性能.
本文主要介绍了不同Sr/Ti摩尔比例且具有不同结构的Sr/TiO2催化剂的制备,并考察了其随着Sr/Ti摩尔比例的变化对亚甲基蓝去除效率的影响.通过XRD、SEM、TEM、FT-IR、UV-Vis等表征手段探究了Sr/TiO2催化剂结构的变化.
2 实验部分
2.1 Sr/TiO2光催化剂制备
取一定量钛酸四丁酯分散于乙醇中,并缓慢滴加氨水使pH值约为8,得到白色悬浮液,将悬浮液抽滤后得到凝胶状Ti(OH)4白色沉淀;称取一定量的硝酸锶配成溶液,再与抽滤后的凝胶状Ti(OH)4沉淀混合搅拌,旋转蒸干,后在110°C下干燥12 h,研磨后放置马弗炉程序升温焙烧,400°C焙烧4 h,700°C焙烧4 h,高温焙烧后得到核壳结构样品.实验中在钛酸四丁酯定量条件下,调节硝酸锶的投入量,根据二者投入量的不同摩尔比,分别得到Sr/Ti摩尔比为1/4、2/3、1/1、3/2、3/1、4/1和9/1的样品,标记为ST-1/4、ST-2/3、ST-1/1、ST-3/2、ST-3/1、ST-4/1、ST-9/1.
2.2 催化剂表征
XRD表征采用荷兰PNAlytical公司的X'Pert PRO X射线衍射仪分析样品的物相,Ni滤波,使用Cu靶Kα辐射,工作电压为45 kV,工作电流为40 mA,扫描范围 2θ为10°-80°.
SEM表征采用Hitachi S-4700(II)型场发射扫描电镜观察样品形貌,加速电压为15 kV.测试前,为增加样品的导电性,将样品放在特制的试样架上,喷金1 min左右.
TEM表征采用荷兰FEI公司生产TecnaiG2 F30高分辨透射电子显微镜及能谱分析仪测定,测定前进行超声分散样品处理.
傅里叶红外光谱仪采用BRUCK公司的VERTEX 70进行测试,扫描波数范围为400-4000 cm-1,扫描32次.
UV-Vis表征采用日本SHIMADZU公司生产的Spec TM-BWS003光谱仪测试,以BaSO4为参比.
3 结果与讨论
3.1 样品XRD表征分析
图1(a)为不同Sr/Ti摩尔比Sr/TiO2催化剂的XRD表征分析(2θ范围为15°-55°).结果显示,ST-1/4催化剂未出现SrTiO3晶相(JCPDS No.73-0661),其TiO2晶相(JCPDS No.21-1272)表现为所有样品中结晶度最高,此时SrTiO3高度分散在TiO2表面;ST-2/3与ST-1/1催化剂则以TiO2晶相与SrTiO3晶相为主;而高Sr含量的催化剂(ST-3/2、ST-3/1、ST-4/1)出现了较为明显的Sr2TiO4晶相(JCPDS No.72-2040)与Sr(OH)2·H2O晶相(JCPDS No.28-1222),当Sr含量继续增加时,在ST-9/1催化剂中出现了大量Sr(OH)2·H2O晶相,且伴随着微弱的Sr2TiO4晶相.Sr(OH)2·H2O是由于焙烧后的SrO吸附水后重新生成的.
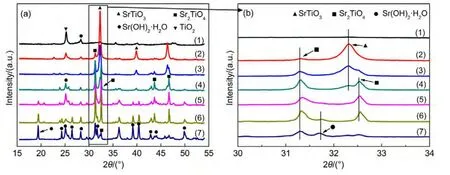
图1 不同Sr/Ti摩尔比例Sr/TiO2催化剂的XRD谱图Fig.1 XRD patterns of the Sr/TiO2catalysts with different Sr/Ti molar ratios
图1(b)为不同Sr/Ti摩尔比Sr/TiO2催化剂的XRD特征峰谱图(2θ范围为30°-34°).分析特征峰变化,Sr/TiO2催化剂晶相的变化可分为三个阶段:第一阶段为当n(Sr)/n(Ti)≤3/2时,随着Sr含量增多,SrTiO3晶相逐渐增强.结合图1(a),样品的TiO2晶相逐渐减弱,说明随着Sr含量增加,更多的Sr与Ti结合生成了SrTiO3.其中ST-2/3催化剂的SrTiO3晶相为不同Sr含量摩尔比样品中结晶度最高的.第二阶段当n(Sr)/n(Ti)处于3/2与4/1之间时,XRD图谱显示催化剂出现层状钙钛矿Sr2TiO4晶相,且结晶度随着Sr含量的增多而增大,而SrTiO3晶相逐渐减弱直至消失.其中,ST-3/1催化剂的SrTiO3晶相完全消失.ST-4/1催化剂在2θ=31.75°处出现了不明显的Sr(OH)2·H2O晶相.说明随着Sr含量的增加,SrTiO3与Sr又逐渐结合生成了Sr2TiO4,Sr含量继续增加后产生了只含有Sr的Sr(OH)2·H2O相.第三阶段即为当n(Sr)/n(Ti)=9/1时,ST-9/1催化剂上产生了更多Sr(OH)2·H2O,且Sr2TiO4含量减少.
此外,ST-3/2、ST-3/1与ST-4/1催化剂的Sr2TiO4晶相与层状钙钛矿Sr2TiO4晶相的标准PDF卡片对比,出峰位置均存在着不同程度的高位偏移现象,且ST-4/1催化剂偏移程度最大.根据现代晶体学理论,22,23晶相图谱的微弱偏移意味着晶体产生了不同程度的晶格缺陷,半导体晶格缺陷的产生将导致周围O2-的产生,即样品会产生不同程度的氧空位的缺失.14
图2为ST-4/1催化剂高温焙烧后分别置于空气环境与真空环境12 h前后形貌的变化图.结果证实,过量的Sr含量下的样品在高温焙烧下形成SrO,所以外观表现为坚硬的块状结构,且与低Sr含量情况时样品呈白色不同而呈红褐色.初始结块的催化剂样品在空气环境中放置一定时间后逐渐裂开,并最终形成粉末,样品增重明显.隔绝空气后样品则在12 h内无变化,重量几乎不变.表明SrO确实在空气中能与水分子迅速结合生成Sr(OH)2·H2O.
3.2 样品 SEM与TEM表征分析
图3为不同Sr/Ti摩尔比Sr/TiO2催化剂的扫描电镜(SEM)表征分析.结果显示,基于Sr/Ti摩尔比例调节下,分步沉积法制备的Sr/TiO2催化剂的形貌具有三个阶段的变化:n(Sr)/n(Ti)≤3/2时,即主要存在TiO2和SrTiO3时,样品呈现小颗粒形貌,且具有一定的聚集现象;当n(Sr)/n(Ti)处于3/2与4/1之间时,样品开始出现片状形貌,且随着Sr含量比例增加,片状结构明显;而n(Sr)/n(Ti)=9/1时,针状结构的Sr(OH)2·H2O已成为催化剂主要形貌.24

图2 ST-4/1样品在12 h中形貌的变化照片Fig.2 Morphology changes of ST-4/1 in 12 h

图3 不同Sr/Ti摩尔比Sr/TiO2光催化剂的SEM图Fig.3 SEM images of Sr/TiO2catalysts with different Sr/Ti molar ratios
图4为不同Sr/Ti摩尔比Sr/TiO2催化剂的高分辨透射电镜(HRTEM)表征,大图为5 nm尺寸下的样品高分辨率图谱,小图为0.2-1.0 μm不同尺寸下的样品全貌.结果进一步证实,样品形貌与晶型的改变随着Sr/Ti摩尔比的变化也可分为3个阶段.n(Sr)/n(Ti)≤3/2时,样品颗粒呈球状,且具有一定的团聚现象;n(Sr)/n(Ti)处于3/2与4/1之间时,样品结构由球状转变为片状.且ST-4/1样品的片状结构最为规整及明显,且出现了明显的分界.而n(Sr)/n(Ti)=9/1时,样品片状结构逐渐减少,可以看到片状明显的变薄.结合XRD表征分析,此时针状结构的Sr(OH)2·H2O已经逐步取代了片状结构的Sr2TiO4.
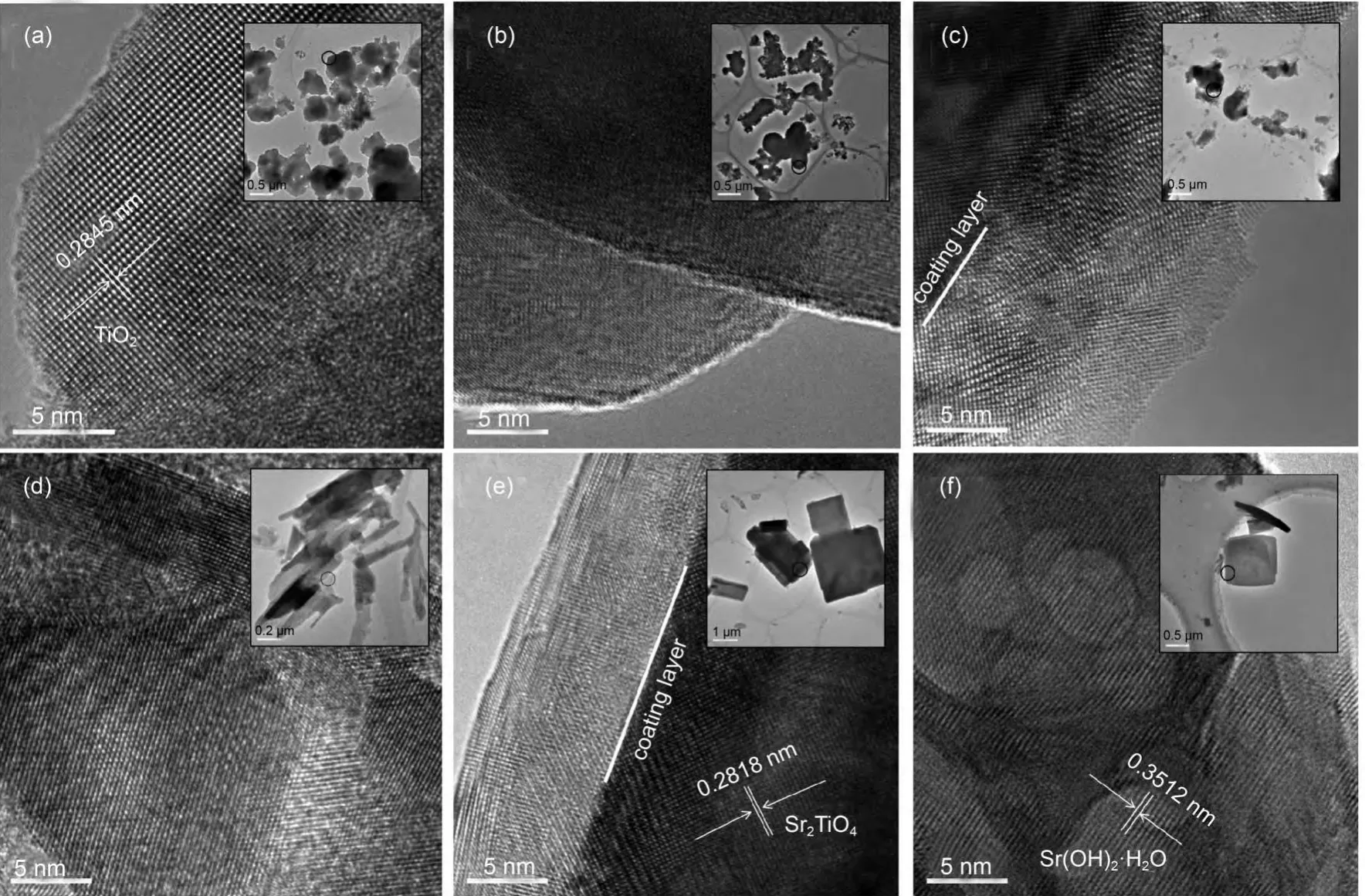
图4 不同Sr/Ti摩尔比Sr/TiO2光催化剂的TEM图Fig.4 TEM images of Sr/TiO2catalysts with various Sr/Ti molar ratios
3.3 红外吸收光谱表征分析
图5为不同Sr/Ti摩尔比Sr/TiO2催化剂的固体粉末红外吸收光谱表征.结果表明,催化剂ST-4/1在近红外区出现了较为明显的―OH基团的红外峰25,26(峰位3592 cm-1),证实样品表面中含有Sr(OH)2成分.而在中段区,所有样品均出现了CO2的吸收峰(2361与2342 cm-1)和的特征振动吸收带25,27(1451 cm-1).CO2吸收峰的出现由于空气中CO2的影响,而吸收峰的出现是由于Sr(NO3)2在700°C高温焙烧下硝酸盐残留的原因.在远红外区,ST-4/1与ST-9/1均出现了不同强度的红外峰(1026 cm-1).根据文献报道,28此为配位不饱和的晶格氧O2-峰.
3.4 紫外漫反射光谱UV-Vis分析
图6为不同Sr/Ti摩尔比样品的紫外可见漫反射光谱图.根据图6结果,不同Sr含量比例Sr/TiO2催化剂均在可见光区域内的490 nm波长左右发生吸收.结合形貌变化,低Sr含量下,样品可见光吸收均随着Sr含量比例增大而变强.ST-4/1催化剂的可见光吸收最强.而ST-9/1催化剂可见光吸收强度下降但依旧高于ST-3/2催化剂.结合XRD表征分析,结果表明片状钙钛矿Sr2TiO4的存在更有利于对可见光的吸收.而Sr(OH)2·H2O则会降低样品可见光的吸收.
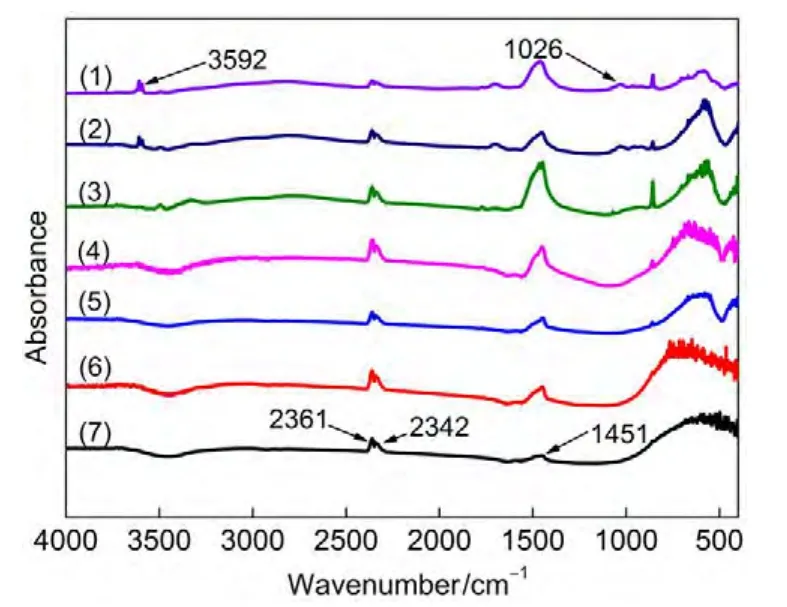
图5 不同Sr/Ti摩尔比Sr/TiO2光催化剂红外吸收光谱图Fig.5 Infrared spectra of Sr/TiO2catalysts with various Sr/Ti molar ratios
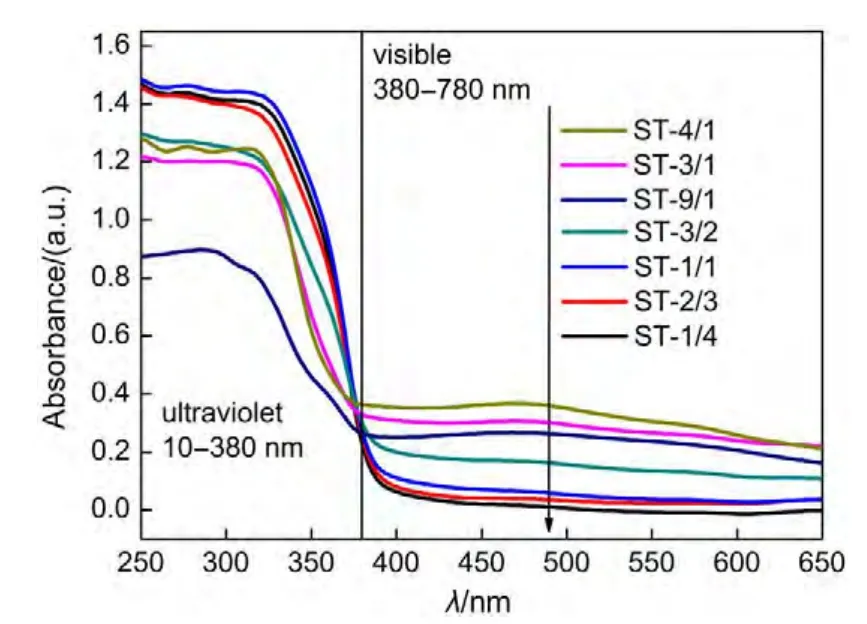
图6 不同Sr/Ti摩尔比Sr/TiO2光催化剂紫外-可见漫反射光谱图Fig.6 UV-Vis diffuse reflectance spectra of Sr/TiO2 photocatalysts with various Sr/Ti molar ratios
3.5 催化剂的光催化活性
为排除Sr/TiO2催化剂对于亚甲基蓝的吸收作用影响,样品先于暗箱环境吸附20 min.图7为不同Sr/Ti摩尔比的Sr/TiO2催化剂20 min暗箱吸附实验数据.结果显示,不同Sr/Ti摩尔比的Sr/TiO2催化剂在20 min内对于亚甲基蓝的吸附降解效率很低,且在20 min均匀混合后吸附趋于饱和状态.从图7可知,Sr含量增加也有利于污染物在催化剂表面的吸附,表面吸附量增加,表明催化剂表面反应物浓度增加,从而提高了催化反应速率.
实验过程中排除吸附作用的影响.图8与图9为可见光照射下锶钛光催化剂催化降解亚甲基蓝的活性数据比较,速率常数计算采用一级动力学方程式.29,30结果显示,当n(Sr)/n(Ti)≤3/2时,样品可见光下催化降解的一级反应速率常数在同一个数量级上,反应速率随着n(Sr)/n(Ti)比例的变大而增大,ST-1/1的一级反应速率为同等光照条件下商用二氧化钛P25的11.9倍;而当Sr含量适当增加时,样品光催化活性得到大幅提高,一级反应速率相对低n(Sr)/n(Ti)比例时提高了几个数量级.其中,ST-4/1催化剂表现出最高的光催化活性,其一级反应速率常数为SrTiO3钙钛矿催化剂的5.0倍,为商用P25的86.7倍.
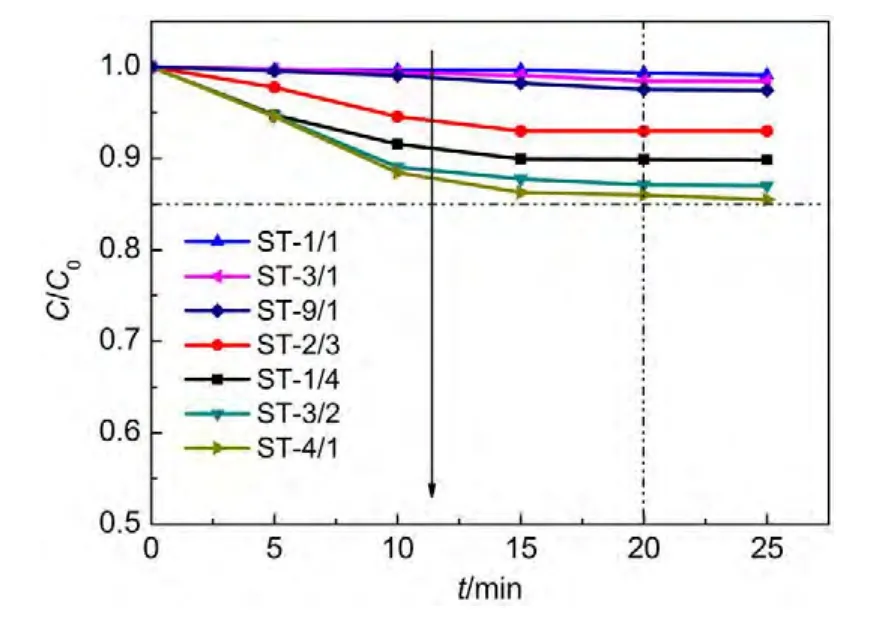
图7 不同Sr/Ti摩尔比Sr/TiO2光催化剂对亚甲基蓝的暗箱吸附作用Fig.7 Adsorption of camera obscura for methylene blue by Sr/TiO2photocatalysts with different Sr/Ti molar ratios
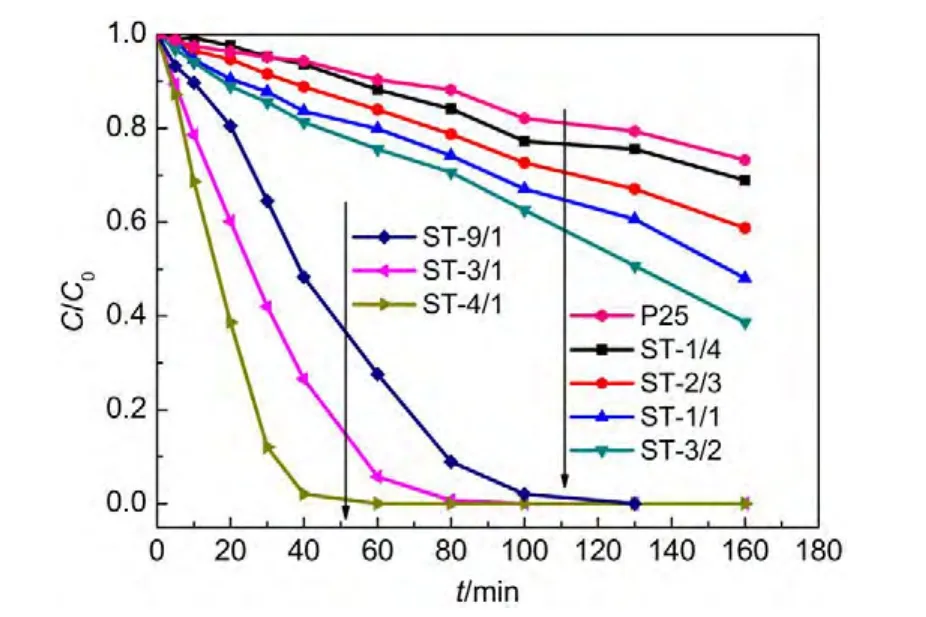
图8 可见光下P25及不同Sr/Ti摩尔比例Sr/TiO2光催化剂对亚甲基蓝的降解作用Fig.8 Degradation of P25 and Sr/TiO2photocatalysts with different Sr/Ti molar ratios for methylene blue under visible light
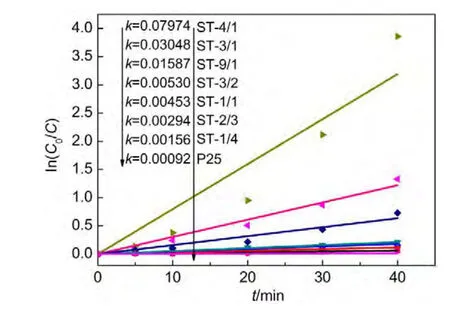
图9 可见光下不同Sr/Ti摩尔比Sr/TiO2光催化剂降解亚甲基蓝的一级反应速率常数Fig.9 First-order reaction rate contents of Sr/TiO2 photocatalysts with different Sr/Ti molar ratios for degradation of methylene blue under visible light
图10为不同Sr/Ti摩尔比的Sr/TiO2催化剂形貌与光催化模型示意图,在低Sr含量下,样品随Sr含量的增加其可见光催化活性提高归因于SrTiO3晶相,在可见光范围内,SrTiO3的增加利于样品的光催化活性提高.31,32而当Sr含量继续增加至n(Sr)/n(Ti)=1时,样品可见光光催化活性的大幅提高,归因于片状钙钛矿Sr2TiO4晶相,根据文献报道,33电子掺杂的Sr2TiO4具有良好的电传导性,导致Sr2TiO4成为很好的电子转移层,在光催化过程中,受光照射产生的电子将很快转移到Sr2TiO4表面,有效降低了电子与空穴的复合几率.
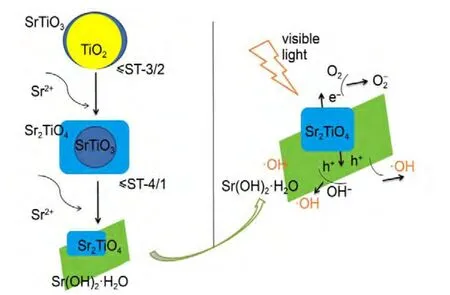
图10 不同Sr/Ti摩尔比例Sr/TiO2光催化剂形貌变化与ST-1/1的光催化模型示意图Fig.10 Morphology change of Sr/TiO2photocatalysts with different Sr/Ti molar ratios and schematic diagram of photocatalytic model of ST-1/1 catalyst
光催化剂的吸光性能和吸附作用是影响光催化效率的一个重要因素.结合紫外-可见漫反射光谱表征,其对于可见光的吸光性能恰好反映了对应样品的光催化活性数值,吸附作用也是如此.随着反应物在催化剂表面吸附,浓度随之增加,从而也提高了催化活性.
4 结论
通过分步沉积法成功制备了不同Sr/Ti摩尔比的Sr/TiO2催化剂.不同Sr/Ti摩尔比例下,Sr/TiO2催化剂呈现出不同结构形貌与光催化活性.在n(Sr)/n(Ti)≤3/2情况下,Sr/TiO2催化剂呈现以 TiO2和SrTiO3组成的球状结构,可见光催化活性因SrTiO3晶相的增加而提高;当n(Sr)/n(Ti)处于3/2与4/1之间时,样品呈现规则的片状结构,且随着Sr/Ti摩尔比例增大,催化剂组成由SrTiO3和Sr2TiO4变为Sr2TiO4和Sr(OH)2·H2O,当出现Sr2TiO4时,由于Sr2TiO4具有良好的电传导性,导致Sr2TiO4成为很好的电子转移层,在光催化过程中,受光照射产生的电子将很快转移到Sr2TiO4表面,有效降低了电子与空穴的复合几率,催化剂对可见光催化活性大幅提高.其中,ST-4/1催化剂表现出最高的光催化活性,其一级反应速率常数为SrTiO3钙钛矿催化剂的5.0倍,为商用P25的86.7倍.
(1)Hu,P.;Hou,D.;Shi,H.;Chen,C.;Huang,Y.;Hu,X.Applied Surface Science2014,319,244.doi:10.1016/j.apsusc.2014.07.141
(2) Leong,K.H.;Gan,B.L.;Ibrahim,S.;Saravanan,P.Applied Surface Science2014,319,128.doi:10.1016/j.apsusc.2014.06.153
(3)Dong,F.;Xiong,T.;Sun,Y.;Zhao,Z.;Zhou,Y.;Feng,X.;Wu,Z.Chemical Communications2014,50,10386.doi:10.1039/C4CC02724H
(4) Dong,F.;Li,Q.;Sun,Y.;Ho,W.ACS Catalysis2014,4,4341.doi:10.1021/cs501038q
(5) Xiong,T.;Huang,H.;Sun,Y.;Dong,F.Journal of Materials Chemistry A2015,3,6118.doi:10.1039/C5TA00103J
(6)Dong,F.;Wang,Z.;Li,Y.;Ho,W.;Lee,S.C.Environmental Science&Technology2014,48,10345.doi:10.1021/es502290f
(7) Huang,X.;Chen,H.Applied Surface Science2013,284,843.doi:10.1016/j.apsusc.2013.08.019
(8) Wang,Y.;Li,J.;Peng,P.;Lu,T.;Wang,L.Applied Surface Science2008,254,5276.doi:10.1016/j.apsusc.2008.02.050
(9) Kurokawa,H.;Yang,L.;Jacobson,C.P.;De Jonghe,L.C.;Visco,S.J.Journal of Power Sources2007,164,510.doi:10.1016/j.jpowsour.2006.11.048
(10) Kuwata,N.;Sata,N.;Saito,S.;Tsurui,T.;Yugami,H.Solid State Ionics2006,177,2347.doi:10.1016/j.ssi.2006.05.043
(11) Xie,J.;Ji,T.H.;Ouyang,X.H.;Mao,Z.Y.;Shi,H.J.Solid State Communications2008,147,226.doi:10.1016/j.ssc.2008.05.026
(12)Ge,W.W.;Zhu,C.H.;An,H.P.;Li,Z.Z.;Tang,G.D.;Hou,D.L.Ceramics International2014,40,1569.doi:10.1016/j.ceramint.2013.07.044
(13) Jing,L.;Xin,B.;Yuan,F.;Xue,L.;Wang,B.;Fu,H.The Journal of Physical Chemistry B2006,110,17860.doi:10.1021/jp063148z
(14) Sulaeman,U.;Yin,S.;Sato,T.Effect of Sr/Ti Ratio on the Photocatalytic Properties of SrTiO3.InMaterials Science and Engineering,3rd International Congress on Ceramics,Osaka,Japan,Nov 14-18,2010;IOP Science:England,2011.
(15) Xu,J.;Wei,Y.;Huang,Y.;Wang,J.;Zheng,X.;Sun,Z.;Fan,L.;Wu,J.Ceramics International2014,40,10583.doi:10.1016/j.ceramint.2014.03.037
(16) Konta,R.;Ishii,T.;Kato,H.;Kudo,A.The Journal of Physical Chemistry B2004,108,8992.doi:10.1021/jp049556p
(17) Wang,C.;Qiu,H.;Inoue,T.;Yao,Q.International Journal of Hydrogen Energy2014,39,12507.doi:10.1016/j.ijhydene.2014.06.059
(18) Sulaeman,U.;Yin,S.;Sato,T.Applied Physics Letters2010,97,103102.doi:10.1063/1.3486466
(19)Ohno,T.;Tsubota,T.;Nakamura,Y.;Sayama,K.Applied Catalysis A:General2005,288,74.doi:10.1016/j.apcata.2005.04.035
(20)Yang,G.R.;Yan,W.;Wang,J.N.;Zhang,Q.;Yang,H.H.Journal of Sol-Gel Science and Technology2014,71,159.doi:10.1007/s10971-014-3346-0
(21) Jiao,Z.B.;Chen,T.;Yu,H.C.;Wang,T.;Lu,G.X.;Bi,Y.P.Journal of Colloid and Interface Science2014,419,95.doi:10.1016/j.jcis.2013.12.056
(22) Lu,P.W.Fundamentals of Inorganic Materials Science;Wuhan University of Technology Press:Wuhan,2006.[陆佩文.无机材料科学基础.武汉:武汉理工大学出版社,2006.]
(23) Chen,J.Z.Modern Crystal Chemistry;Science Press:Beijing,2010.[陈敬中.现代晶体化学.北京:科学出版社,2010.]
(24) Feng,X.L.;Wang,G.Y.Journal of Changchun University of Science and Technology(Natural Science Edition)2005,28,76.[冯秀丽,王公应.长春理工大学学报(自然科学版),2005,28,76.]
(25)Gao,Y.F.;Masuda,Y.;Yonezawa,T.;Koumoto,K.Chemistry of Materials2002,14,5006.doi:10.1021/cm020358p
(26)Huang,S.T.;Lee,W.W.;Chang,J.L.;Huang,W.S.;Chou,S.Y.;Chen,C.C.Journal of the Taiwan Institute of Chemical Engineers2014,45,1927.doi:10.1016/j.jtice.2014.02.003
(27) Yuvaraj,S.;Lin,F.Y.;Chang,T.H.;Yeh,C.T.Journal of Physical Chemistry B2003,107,1044.doi:10.1021/jp026961c
(28) Cai,S.;Xu,Y.D.;Cai,S.;Li,X.S.;Huang,J.S.;Guo,X.X.Chinese Journal of Catalysis1996,17,22.[余 林,徐奕德,蔡 晟,李新生,黄家生,郭燮贤.催化学报,1996,17,22.]
(29)Yu,C.;Fan,C.;Yu,J.C.;Zhou,W.;Yang,K.Materials Research Bulletin2011,46,140.doi:10.1016/j.materresbull.2010.08.013
(30) Tennakone,K.;Ileperuma,O.A.;Bandara,J.M.S.;Kiridena,W.C.B.Semiconductor Science and Technology1992,7,423
(31) Yang,L.B.;Jing,L.Q.;Li,S.D.;Jiang,B.J.;Fu,W.;Fu,H.G.Chemical Journal of Chinese Universities2007,28,415.[杨立滨,井立强,李姝丹,蒋保江,付 薇,付宏刚.高等学校化学学报,2007,28,415.]
(32)Xu,Y.L.Fundamentals of Oxide and Compound Semiconductor;Xidian University Press:Xian,1991.[徐毓龙.氧化物与化合物半导体基础.西安:西安电子科技大学出版社,1991.]
(33)Lee,K.H.;Ishizaki,A.;Kim,S.W.;Ohta,H.;Koumoto,K.Journal of Applied Physics2007,102,033702.
