三羟甲基氨基甲烷绿色合成金纳米粒子
陈 峰,曹博智,杨光参
(温州大学物理与电子信息工程学院,浙江温州 325035)
三羟甲基氨基甲烷绿色合成金纳米粒子
陈 峰,曹博智,杨光参†
(温州大学物理与电子信息工程学院,浙江温州 325035)
首次利用三羟甲基氨基甲烷(Tris)作为还原剂,在碱性条件下还原氯金酸溶液;通过调节Tris和NaOH的配比、反应时间和添加稳定剂,控制合成稳定的金纳米粒子,粒子尺寸在15 – 47 nm之间.
三羟甲基氨基甲烷;合成;金纳米粒子
在众多的金属纳米材料中金纳米粒子具有良好的生物相容性、分子识别功能,一直被视为是生物大分子(核酸分子-DNA)超灵敏检测[1]、生物传感[2-3]及核酸分子或药物分子在细胞内定向输运[4]的最佳载体.在众多的制备方法中最为经典的方法是Turkevitch-Frens的柠檬酸钠还原法[5]、Brust-Schiffrin相转移法[6]以及种子生长法(Seed-growth method)[7],这几种方法是最容易做到在金纳米粒子表面上修饰生物分子的,然而这些方法的合成或修饰过程中存在一定的毒性[8].为了减少金纳米粒子在实验中对生物机体的毒性,实现环境友好型和生物相容型的金纳米粒子合成,并能够在生物医学领域有更好的应用,近十多年来研究者们不断研发生物相容的“绿色”还原方法.所谓绿色合成方法是直接利用生物分子或生物相容分子作为还原剂和稳定剂制备金纳米粒子,它们的制备过程与柠檬酸钠还原方法类似,可以还原AuⅢ成Au0并保持金纳米粒子在溶液中的稳定性.目前,已有的“绿色”还原剂有脂质体[9]、自然植物的提纯物[10]、壳聚糖[11]等.
为了在“绿色”还原的基础上,使反应条件更加温和,实验操作简单易行,我们首次利用三羟甲基氨基甲烷还原氯金酸制备金纳米粒子.三羟甲基氨基甲烷(Tris (Hydroxymethyl) Aminomethane,简称Tris),又名氨基丁三醇,是一种有机化合物,其分子式为(HOCH2)3CNH2,是最常见的生物化学和分子生物学实验中的缓冲液成分和滴定标准物,可有效地治疗急性肺损伤患者酸中毒[12],诱导磷脂双层膜形成波纹结构的单层膜[13].由于它含有三个同等地位的羟基,具有一定的还原性,且活性较强,因此实验在较为温和的条件即可完成,实现了绿色还原.通过调节Tris的量、反应时间或添加稳定剂可得到不同尺寸稳定的金纳米粒子胶体溶液.
1 实验设计
1.1 实验仪器及药品
1.1.1 实验仪器
超声波清洗机(宁波新芝生物科技有限公司,SB-5200-DTD)、锥形瓶、UV-2450紫外-可见光谱仪(日本岛津公司,分辨率0.1 nm)、场发射高分辨电子显微镜JEM-2100F(TEM,日本电子,加速电压为200 kv).
1.1.2 试验药品
超纯水(Milli-Q system,18.2 MΩ)、氯金酸(北京国药,分析纯)、氢氧化钠(上海国药,分析纯)、三羟甲基氨基甲烷、柠檬酸三钠(SCRC,北京).
1.2 实验过程
1.2.1 药品配制
取0.5 ml浓度为1%的氯金酸溶液加到锥形瓶中,同时加入49.5 ml超纯水将其浓度稀释至0.01%,配制质量分数为1%的氢氧化钠和柠檬酸三钠(citrate)溶液以及浓度为10 mM的Tris溶液(PH=7.5)待用.
1.2.2 金纳米粒子合成
利用Frens方法[14]制备金纳米粒子作为参照.
将盛有50 ml质量分数为0.01%的HAuCl4溶液的锥形瓶放入超声机中,设定温度为50℃,超声加热15分钟,此时实际温度为43℃,取1 ml Tris与2 ml NaOH的混合液加入氯金酸溶液中.由于将超声机加盖,30分钟后溶液实际温度达到了53℃,加入200 μl柠檬酸钠溶液作为稳定剂,继续超声30分钟,溶液颜色逐渐加深,最终呈现酒红色,实验完成.
为了找到最佳的反应条件,反复进行多组实验,对不同时间段的温度实时监测,研究不同还原剂比率、不同时间、有无稳定剂条件下的反应情况.
(1)将还原剂的量扩大一倍,向超声加热15分钟(实际温度达到28℃)的50 ml氯金酸溶液中加入2 ml NaOH和2 ml Tris的混合液,溶液颜色慢慢变红,超声20分钟后,温度达到48℃,再加入200 μl的柠檬酸钠溶液,继续超声10分钟停止实验.
(2)为了保持相同的反应时间,利用(1)中,同样比率的反应溶液,先将反应溶液超声反应30分钟,实际温度达到44℃,再加入200 μl的柠檬酸钠溶液超声30分钟,溶液颜色较(1)中更鲜亮.
(3)不添加柠檬酸钠作为稳定剂,在氯金酸溶液超声加热15分钟后, 直接加入4 ml体积比1∶1的Tris-NaOH混合液加入HAuCl4溶液中,观察液体颜色变化,2分钟内液体变为淡紫色,持续振荡,溶液颜色逐渐加深,由粉红色渐渐变为红色,超声60分钟后停止实验.
(4)将盛有50 ml质量分数为0.01%的HAuCl4溶液的锥形瓶放入超声机中,设定温度为50℃,超声加热15分钟后实际温度为43℃,加入1∶1的NaOH和Tris的混合液2 ml,超声加热30分钟,溶液温度达到47℃,但颜色几乎没有变化,再加入1 ml的NaOH溶液颜色迅速变红,超声15分钟,溶液温度逐渐达到50℃,15分钟后停止实验.将制备好的溶液分装、离心(转速12 000 r/min下离心30分钟,移去上清液,加入等量的超纯水稀释)备用.
为了便于讨论,将上述6种方法制备的溶液分别进行编号:样本1,样本2,……,样本6.
2 结果与讨论
2.1 样品溶液的紫外光谱研究
利用UV-2450紫外-可见光谱仪,测量6种样品溶液的紫外吸收光谱,扫描范围为300 – 800 nm,不同溶液样本的紫外吸收峰及吸收强度曲线见图1.由图1可知,它们的吸收峰分布在518 – 540 nm之间,属于金纳米粒子的等离子体吸收范围[5],表明了金纳米粒子的生成.其中,柠檬酸钠还原制备的金纳米粒子的吸收峰在519 nm,而其他样品的吸收峰值均大于519 nm,这是因为随着金纳米粒子的粒径增大,紫外吸收峰会发生红移[15].紫外吸收强度的高低,表现为样品溶液颜色的深浅,颜色越鲜亮,则吸收强度越大.
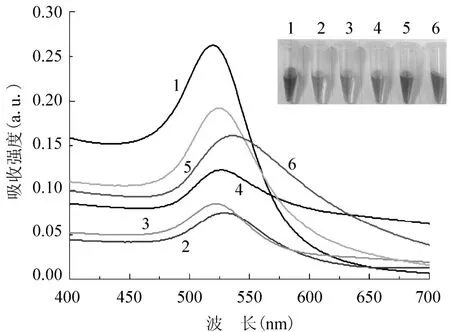
图1 不同样本金纳米粒子的紫外吸收光谱
2.2 金纳米粒子的形貌表征
样品溶液的颜色能够初步反映金纳米粒子的形貌特征.金纳米粒子溶液样本均为红色,可推断这些金纳米粒子的形状大致为球形.将样品溶液滴加在铜网上干燥,利用JEM-2100F场发射高分辨电子显微镜(TEM)对每种金纳米粒子进行形貌(图2)和粒径分布统计(图3).由透射电镜图片可知,金纳米粒子为球形或类球形,并具有良好的分散性,平均粒径在15 – 47 nm之间.

图2 柠檬酸钠及Tris方法合成的金纳米粒子的TEM图像
2.3 NaOH对金纳米粒子合成的影响
Tris是一种胺类有机物,在水溶液中由于电子效应、溶剂化效应等,呈现出弱碱性,但不会吸收空气中的二氧化碳,具有较高的稳定性,自身碱性受温度影响较大[16].实验过程中我们发现,Tris只有在强碱条件下才能显现出其还原性,而少量的NaOH不能促进反应发生.必须在反应过程中需要加入足量的NaOH溶液作为辅助因子,而且NaOH的加入顺序对实验结果也会产生很大的影响,NaOH只有在与Tris混合或在Tris之后加入到氯金酸溶液中,才能完成实验;若先将NaOH加入氯金酸溶液中,则反应无法进行.
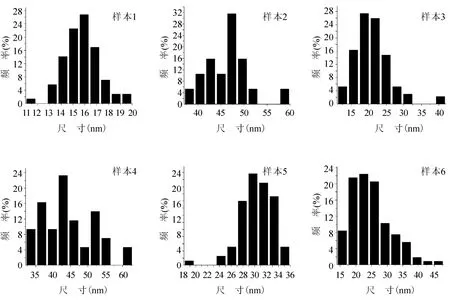
图3 柠檬酸钠及Tris方法合成的金纳米粒子相应的粒径分布图
2.4 稳定剂对金纳米粒子的影响
实验发现,Tris-NaOH混合液还原氯金酸,无论是否存在稳定剂均能得到稳定的金纳米粒子溶液.表明Tris在反应过程中自身也可作为稳定剂.表1为不同反应条件下,金纳米粒子的平均粒径.比较在相同反应条件下,稳定剂对金纳米粒子的影响.样本2是加入稳定剂情况下,金纳米粒子平均粒径为46.11 nm,样本6是不加入稳定剂的情况下,平均粒径为44.31 nm.表明稳定剂的有无,对制备金纳米粒子尺寸影响较小.差别在于加入少量柠檬酸钠后,柠檬酸根包覆在金粒子表面使其粒径稍微变大,所以反应中柠檬酸钠作用可忽略.
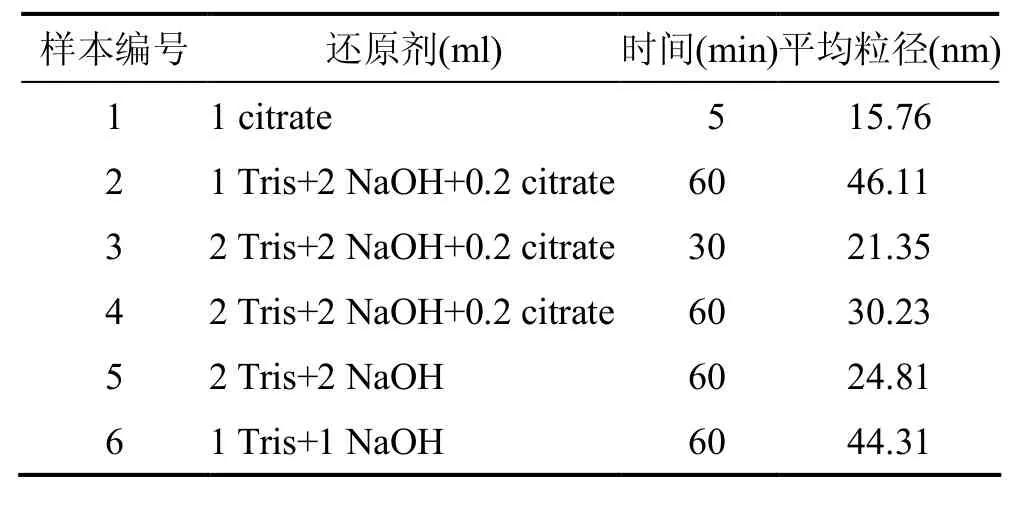
表1 不同反应条件下, 金纳米粒子的平均粒径
2.5 反应时间和温度对金纳米粒子合成的影响
从表1可以看出,反应时间对合成金纳米粒子的尺寸有较大的影响.反应时间越长,形成的颗粒也就越大.温和条件下,反应过程相对缓慢.加入足量还原剂后,Au3+逐渐被还原成Au0,金原子积聚成核.较短时间内,小核的金纳米粒子被周围的Tris分子包围,稳定的分散于溶液中(21.35 nm);当反应时间较长时,会有更多的Au0被还原出来,形成的更大的纳米颗粒(30.23 nm).
温度也是实验成功的关键因素.实验研究发现,Tris在室温下不能自发的还原氯金酸形成Au0,所以在加入还原剂之前,必须预先对氯金酸溶液进行热处理,使其温度达到28℃以上.因此在反应前,需要先对氯金酸溶液超声加热15分钟.
2.6 Tris还原法形貌可控展望
图2中样本4中的金纳米粒子在反应中局部出现聚集情况,将图片放大,见图4.可以看到:聚集的金纳米粒子仅表现为单层、双层,甚至是三层的叠加,而不会团聚成一个整体,这说明Tris还原的金纳米粒子能够保持较好的分散性.同时发现,在众多的球形粒子中,存在个别其他形貌的粒子(三角形、正方形、长方形).所以可以通过调整实验方案,来实现金纳米粒子的形貌控制.

图4 样本4中金纳米粒子的TEM放大图像
3 结 论
Tris超声法还原氯金酸,实验操作安全简便、反应条件温和,不会对环境造成污染和破坏,是一种“绿色”还原方法.利用三羟甲基氨基甲烷(Tris)作为还原剂,在碱性条件下还原氯金酸溶液;通过调节Tris和NaOH的配比、反应时间和添加稳定剂,控制合成稳定的金纳米粒子.
实验发现:
(1)Tris只有在NaOH的促进下才能进行还原反应,而且与NaoH加入的顺序有很大关系,只有与Tris混合或在Tris之后加入到反应溶液中,才能完成实验.
(2)Tris自身可作稳定剂,不需要再加入其他稳定试剂.
(3)反应时间对金纳米粒子的尺寸会有一定的影响,反应时间越长,形成的颗粒也就越大.温度是实验成功的关键因素,Tris在室温下不能自发的还原氯金酸形成Au0.
(4)反应中,2 ml Tris+2 ml NaOH混合液,能够还原制得较稳定且分散的金纳米粒子.通过调节实验条件,可实现控制合成多种尺寸的单分散球形金纳米粒子.
[1] Zanoli L M, Spoto G. Functionalized gold nanoparticles for ultrasensitive DNA detection [J]. Analytical and bioanalytical chemistry, 2012, 402(5): 1759-1771.
[2] Mirkin C A, Letsinger R L, Mucic R C, et al. A DNA-based method for rationally assembling nanoparticles into macroscopic materials [J]. Nature, 1996, 382(6592): 607-609.
[3] Anker J N, Hall W P, Lyandres O, et al. Biosensing with plasmonic nanosensors [J]. Nature materials, 2008, 7(6): 442-453.
[4] Ghosh P, Han G, De M, et al. Gold nanoparticles in delivery applications [J]. Advanced drug delivery reviews, 2008, 60(11): 1307-1315.
[5] Daniel M C, Astruc D. Gold nanoparticles: assembly, supramolecular chemistry, quantum-size-related properties, and applications toward biology, catalysis, and nanotechnology [J]. Chemical reviews, 2004, 104(1): 293-346.
[6] Brust M, Walker M, Bethell D, et al. Synthesis of thiol-derivatised gold nanoparticles in a two-phase liquid-liquid system [J]. J Chem Soc, Chem Commun, 1994, (7): 801-802.
[7] Sau T K, Murphy C J. Room temperature, high-yield synthesis of multiple shapes of gold nanoparticles in aqueous solution [J]. Journal of the American Chemical Society, 2004, 126(28): 8648-8649.
[8] Murphy C J, Gole A M, Stone J W, et al. Gold nanoparticles in biology: beyond toxicity to cellular imaging [J]. Accounts of Chemical Research, 2008, 41(12): 1721-1730.
[9] He P, Urban M W. Phospholipid-stabilized Au-nanoparticles [J]. Biomacromolecules, 2005, 6(3): 1224-1225.
[10] Kumar K P, Paul W, Sharma C P. Green synthesis of gold nanoparticles with zingiber officinale extract: Characterization and blood compatibility [J]. Process Biochemistry, 2011, 46(10): 2007-2013.
[11] Laudenslager M J, Schiffman J D, Schauer C L. Carboxymethyl chitosan as a matrix material for platinum, gold, and silver nanoparticles [J]. Biomacromolecules, 2008, 9(10): 2682-2685.
[12] Kallet R H, Jasmer R M, Luce J M, et al. The treatment of acidosis in acute lung injury with tris-hydroxymethyl aminomethane (THAM) [J]. American journal of respiratory and critical care medicine, 2000, 161(4): 1149-1153.
[13] Mou J, Yang J, Shao Z. Tris (hydroxymethyl) aminomethane (C4H11NO3) induced a ripple phase in supported unilamellar phospholipid bilayers [J]. Biochemistry, 1994, 33(15): 4439-4443.
[14] Frens G. Controlled nucleation for the regulation of the particle size in monodisperse gold suspensions [J]. Nature, 1973, 241(105): 20-22.
[15] Newman J D S, Blanchard G J. Formation of gold nanoparticles using amine reducing agents [J]. Langmuir, 2006, 22(13): 5882-5887.
[16] Bates R G, Hetzer H B. Dissociation constant of the protonated acid form of 2-amino-2-(hydroxymethyl)-1, 3-propanediol (tris-hydroxymethyl)-aminomethane and related thermodynamic quantities from 0 to 50° [J]. The Journal of Physical Chemistry, 1961, 65(4): 667-671.
Ultrasonic Synthesis Method of Gold Nanoparticles Using Tris (Hydroxymethyl) Aminomethane
CHEN Feng, CAO Bozhi, YANG Guangcan
(College of Physics and Electronic Information Engineering, Wenzhou University, Wenzhou, China 325035)
This paper introduces the method for reduction of the chloroauric acid solution under the alkaline condition via first use of tris (hydroxymethyl) aminomethane (Tris) as a reducing agent. The controled synthsis of gold nanoparticles proves stabilized through adjusting the ratio of Tris and NaOH, reaction time and accretion of stabilizers, which makes the size of ions between 15nm and 47 nm.
Tris (Hydroxymethyl) Aminomethane; Synthesis; Gold Nanoparticles
O648
A
1674-3563(2015)01-0032-06
10.3875/j.issn.1674-3563.2015.01.006 本文的PDF文件可以从xuebao.wzu.edu.cn获得
(编辑:封毅)
2014-03-26
研究生创新基金(31606036010187)
陈峰(1987年- ),男,安徽亳州人,硕士研究生,研究方向:DNA与蛋白质相互作用的红外光谱研究.† 通讯作者,yanggc@wzu.edu.cn

