绿色木霉JD-1固态发酵玉米芯产纤维素酶条件优化
武金霞,武 建,朱 晓,张贺迎*
(1.河北大学 生命科学学院,河北 保定 071002;2.河北大学 生物技术研究中心,河北 保定 071002)
纤维素酶是水解纤维素及其衍生物生成葡萄糖的一组酶的总称,是由多种葡萄糖苷键水解酶组成的复杂酶系[1]。纤维素酶能够将植物纤维原料水解,在食品、饲料、纺织、农产品加工和资源再生等方面具有广泛的用途和应用前景。纤维素酶的工业化生产目前主要有固体发酵法和液体深层发酵法,一般液态发酵纤维素酶活力较高,但生产成本高,废液排放大。固态发酵法具有设备投资小、能耗低、环境污染小等优点[2-3],采用固态发酵法利用廉价纤维素丰富的材料生产纤维素酶是降低生产成本的有效途径[4-5]。林建国等[6-9]研究了固态发酵酒糟、稻草、秸秆、中药残渣、水葫芦等生产纤维素酶,取得了一定结果。但固态发酵存在易染菌、传质不均匀、水活度低等缺陷,常导致酶活力较低。
目前认为绿色木霉(Trichoderma viride)是产纤维素酶能力较强的微生物菌株之一[10-12]。虽然近年利用植物纤维原料生产酒精方面的研究有了重大进展,但仍然存在成本较高的问题。关键是纤维素酶活力低和酶产率低,从而造成纤维素酶生产成本高。因此,提高纤维素酶活力和酶产率,降低纤维素酶制备成本是实现植物纤维资源转化的工业化生产的关键。玉米是我国的主要粮食作物,其副产物产量高达几十亿吨,但其利用率一直很低。本研究以实验室保存的绿色木霉菌株发酵玉米芯,在单因素试验基础上,应用正交试验设计,对其固态发酵产纤维素酶条件进行优化,为降低纤维素酶生产成本及玉米芯废弃物的有效利用提供科学依据。
1 材料与方法
1.1 材料与试剂
1.1.1 菌种
绿色木霉(Trichoderma viride)JD-1:河北大学生命科学学院实验室保藏。
1.1.2 培养基
马铃薯葡萄糖琼脂(potato dextrose agar,PDA)培养基:马铃薯200 g,葡萄糖20 g,琼脂20 g,自来水1 000 mL,pH自然,121℃灭菌20 min。
固态发酵培养基(500 mL三角瓶):玉米芯(过40目筛)14 g,麸皮(过40目筛)6 g,Mandels无机盐营养液40 mL,自然pH,121℃灭菌20 min。
1.1.3 化学试剂
3,5-二硝基水杨酸(分析纯):成都市科龙化工试剂厂;CMC-Na(分析纯):成都市科龙化工试剂厂;酒石酸钾钠(分析纯):天津市凯通化学试剂有限公司;滤纸:杭州特种纸业有限公司;磷酸氢二铵(分析纯):天津市风船化学试剂科技有限公司。
1.2 仪器与设备
HS-800D恒温水槽:太仓市利达实验设备有限公司;LDZX-50KBS立式压力蒸汽灭菌器:上海申安医疗器械厂;YMJ-S250F霉菌培养箱:上海姚氏仪器设备厂;722型可见分光光度计:上海舜宇恒平科学仪器有限公司;HC-2518R高速冷冻离心机:科大创新有限公司中佳分公司。
1.3 试验方法
1.3.1 孢子悬液的制备
将培养4d的PDA平板,用灭过菌的蒸馏水洗下孢子,用移液枪转移到含玻璃珠和无菌水的灭菌三角瓶中充分振荡。在显微镜下用血球计数板计数,调整孢子浓度至107个/mL,作为种子液,备用。
1.3.2 固态发酵
将制备好的孢子菌悬液接种到已经配好的固态发酵培养基上,接种量为10%,28℃条件下下恒温恒湿(相对湿度95%)发酵培养4 d,在36 h摇动三角瓶,防止培养基板结影响通气。
1.3.3 粗酶液的制备
取固态发酵物1 g,加入生理盐水10 mL(1∶10),在摇床上30℃、180 r/min水浴浸提l h,然后在5 000 r/min的冷冻离心机上离心15 min,提取上清液用生理盐水定容至10 mL,即为粗酶液。放置10 min,待测。
1.3.4 纤维素酶活力测定[13]
羧甲基纤维素酶(carboxymethyl cellulase,CMCase)活力测定:采用3,5-二硝基水杨酸(dinitrosalicylicacid,DNS)法。酶活力单位定义为:在50℃、pH4.8、恒温作用30min的条件下,以水解反应中每分钟由底物羧甲基纤维素钠(carboxy methylated cellulose-Na,CMC-Na)生成1 μmol葡萄糖所需的酶量为1个酶活力单位(IU/g)。
滤纸酶(filter paper lyase,FPAase)活力测定酶活力单位定义为:在50℃、pH 4.8、恒温作用60 min的条件下,以水解反应中每分钟由底物(杭州一号定性滤纸)生成1μmoL葡萄糖所需的酶量为1个酶活力单位(IU/g)。滤纸酶活力计算公式如下:

式中:5.56为1mg葡萄糖的微摩尔数(1000/180=5.56),μmoL;样品质量为发酵后的测定固体质量,g。
1.3.5 单因素试验确定菌株固态发酵工艺
分别选取玉米芯与麸皮质量比(10∶0、9∶1、7∶3、5∶5、3∶7、1∶9、0∶10(g∶g))、氮源种类(豆粕、尿素、氯化铵、磷酸氢二铵、硫酸铵、硝酸钾)、氮源含量(0、1%、2%、3%、4%)、发酵温度(25 ℃、28℃、31℃、34℃)、发酵时间(48 h、60 h、72 h、84 h、96 h、108 h、120 h)、料水比(1∶1.0、1∶1.5、1∶2.0、1∶2.5、1∶3.0(g∶mL))及接种量(5.0%、7.5%、10.0%、12.5%、15.0%)等影响因素来考察其对纤维素酶活力的影响。每个试验重复3次。
1.3.6 正交试验优化固态发酵工艺
结合单因素结果,以纤维素酶活力为评价指标,选取选择玉米芯∶麸皮(A)、料水比(B)、发酵温度(C)、发酵时间(D)4个因素进行正交试验,从而优选最佳固态发酵条件,正交试验因素与水平如表1所示。
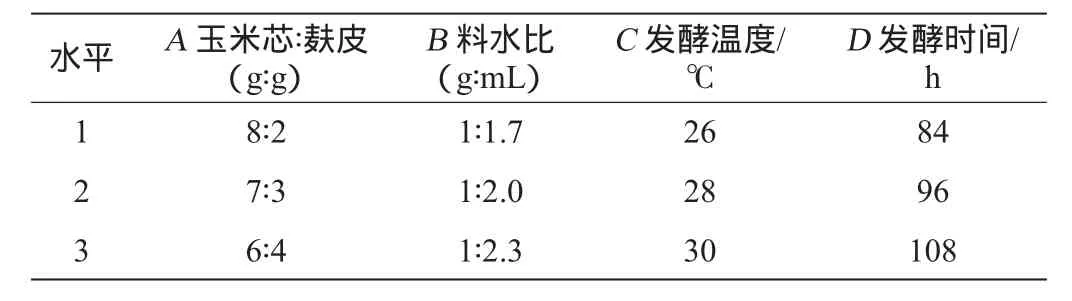
表1 固态发酵工艺优化正交试验因素与水平Table 1 Factors and levels of orthogonal experiments for solid-state fermentation process optimization
2 结果与分析
2.1 固体发酵单因素试验结果
2.1.1 不同原料比例对纤维素酶活力的影响
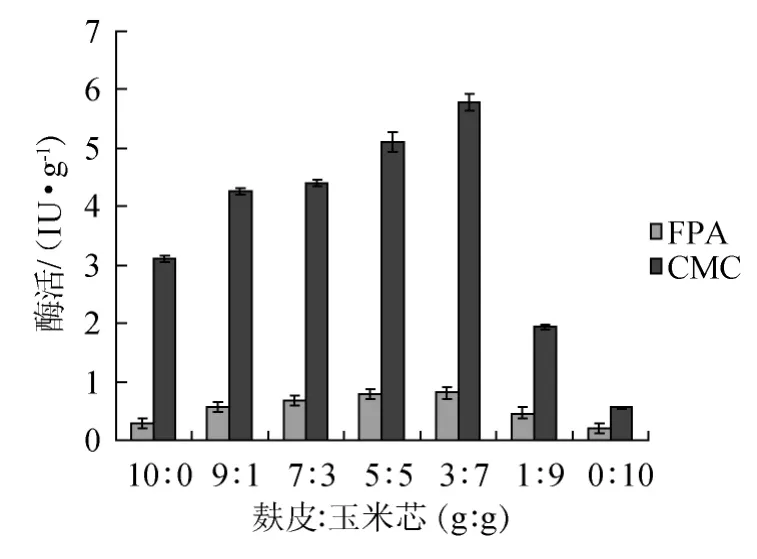
图1 玉米芯和麸皮质量比对纤维素酶的影响Fig.1 Effect of wheat bran and corn cob ratio on cellulase activity
发酵培养基的配制中改变原料配比,玉米芯和麸皮质量比分别为10∶0、9∶1、7∶3、5∶5、3∶7、1∶9、0∶10(g∶g),其他发酵条件相同,不同玉米芯和麸皮质量比对纤维素酶活力的影响结果见图1。
由图1可知,随着玉米芯和麸皮质量比增大,羧甲基纤维素酶及滤纸酶活力逐渐提高。结果表明,玉米芯∶麸皮=7∶3(g∶g)时纤维素酶活力最高,CMC酶活达5.78 IU/g,滤纸酶活力0.81 IU/g。因此,玉米芯∶麸皮7∶3(g∶g)为宜。
2.1.2 不同氮源对纤维素酶活力的影响
在发酵物料中添加不同种类的氮源(豆粕、尿素、氯化铵、磷酸氢二铵、硫酸铵、硝酸钾),添加量均为1%,其他发酵条件相同,不同氮源对纤维素酶活力的影响结果见图2。
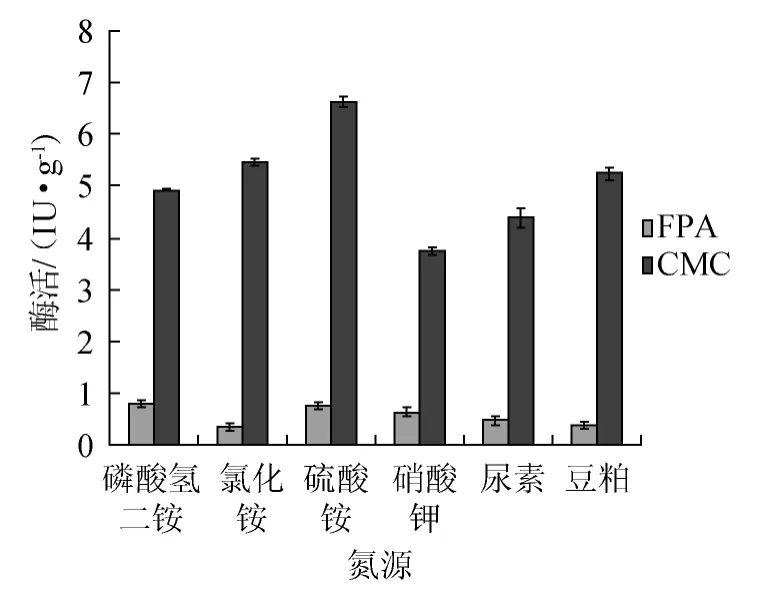
图2 不同氮源对纤维素酶的影响Fig.2 Effect of different nitrogen sources on cellulase activity
由图2可知,不同氮源对产纤维素酶有不同程度的影响。结果表明,铵态氮比其它态氮更有利于该菌株。添加1%硫酸铵时纤维素酶活最高CMC酶活达6.62 IU/g,滤纸酶活力0.79IU/g。为最佳氮源,磷酸氢二铵、氯化铵、豆粕其次。因此,氮源选择硫酸铵为宜。
2.1.3 硫酸铵添加量对纤维素酶活力的影响
在发酵物料中分别添加0、1%、2%、3%、4%硫酸铵,其他发酵条件相同,不同硫酸铵添加量对纤维素酶活力的影响,结果见图3。
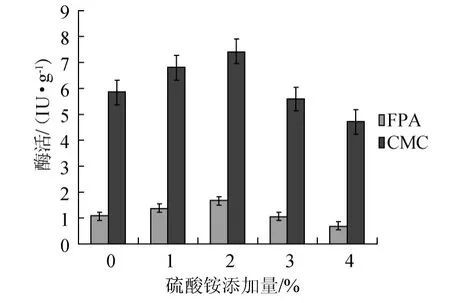
图3 不同硫酸铵添加量对纤维素酶的影响Fig.3 Effect of ammonium sulphate addition on cellulase activity
由图3可知,随着硫酸铵添加量增加,羧甲基纤维素酶及滤纸酶活力增加。结果表明,硫酸铵添加量为2%时,纤维素酶活最高,CMC酶活为7.43IU/g,滤纸酶活力1.66IU/g。因此,最佳硫酸铵添加量为2%。
2.1.4 不同料水比对纤维素酶活力的影响
培养基中水分含量是微生物体内外的溶媒,对微生物营养物质的吸收、代谢产物(酶)的合成和分泌有着重要作用[14]。考察不同料水比1∶1.0、1∶1.5、1∶2.0、1∶2.5、1∶3.0(g∶mL)对产酶的影响结果见图4。
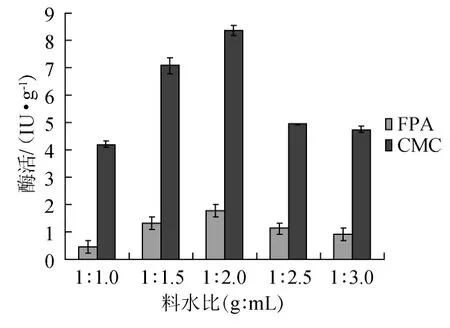
图4 不同料水比对纤维素酶的影响Fig.4 Effect of different solid to liquid ratio on cellulase activity
由图4可知,在一定范围内,随着料水比的增加,纤维素酶活增加,料水比为1∶2(g∶mL)时,纤维素酶活最高,CMC酶活达8.36 IU/g,滤纸酶活力1.78 IU/g。之后料水比再增加,纤维素酶活降低,发酵表现为前期生长缓慢,后期渐渐生长,发酵周期有所延长。因此,料水比1∶2(g∶mL)为宜。
2.1.5 接种量对纤维素酶活力的影响
接种量分别为5.0%、7.5%、10.0%、12.5%、15.0%,其他发酵条件相同,考察不同接种量对纤维素酶活力的影响,结果见图5。
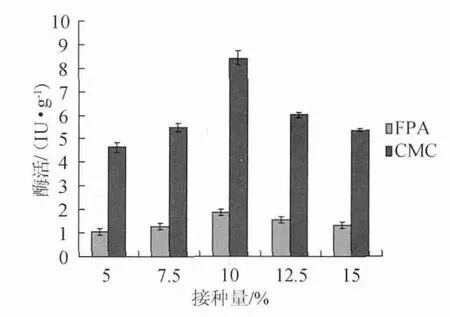
图5 不同接种量对纤维素酶活力的影响Fig.5 Effect of different inoculum on cellulase activity
由图5可知,随着接种量增加,酶活增加,在10%时纤维素酶活达到最大,CMC酶活8.41 IU/g,滤纸酶活力1.85 IU/g。之后再加大接种量,纤维素酶活降低,原因可能是菌丝生长旺盛,会形成抑制,另外菌体大量生长产热多,使培养基内部温度升高,从而影响了产酶[15]。因此,接种量10%为宜。
2.1.6 发酵温度对纤维素酶活力的影响
在发酵温度分别为25℃、28℃、31℃、34℃,其他发酵条件相同时,考察不同发酵温度对纤维素酶活力的影响,结果见图6。

图6 发酵温度对纤维素酶活力的影响Fig.6 Effect of fermentation temperature on cellulase activity
由图6可知,在28℃、31℃时纤维素酶处在较高水平,温度再高纤维素酶活受到抑制。结果表明,在28℃培养时,纤维素酶活力达到最高,CMC酶活8.43 IU/g,滤纸酶活力1.89 IU/g。因此,发酵温度28℃为宜。
2.1.7 发酵时间对纤维素酶活力的影响
从发酵48h起每隔12h测定纤维素酶酶活力,其他发酵条件相同,考察不同发酵时间对纤维素酶活力的影响,结果见图7。
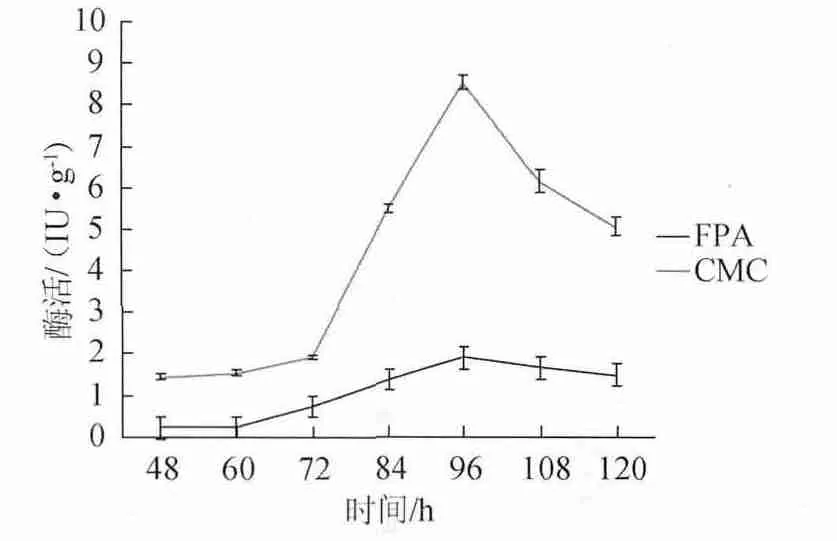
图7 发酵时间对纤维素酶活力的影响Fig.7 Effect of fermentation time on cellulase activity
由图7可知,在培养过程中,CMC酶活和滤纸酶活均呈现出先升高后下降的趋势,在培养96 h时,均达到产酶高峰,CMC酶活8.53 IU/g,滤纸酶活力1.9 IU/g。发酵时间>96 h,酶活力快速下降。因此,发酵时间96 h为宜。
2.2 固态发酵工艺优化正交试验结果
在单因素试验基础上,固定硫酸铵添加量为2%,接种量为10%,以羧甲基纤维素酶活力为评价指标,选取选择玉米芯∶麸皮(A)、料水比(B)、发酵温度(C)、发酵时间(D)为4个因素进行正交试验,结果与分析见表2,方差分析见表3。
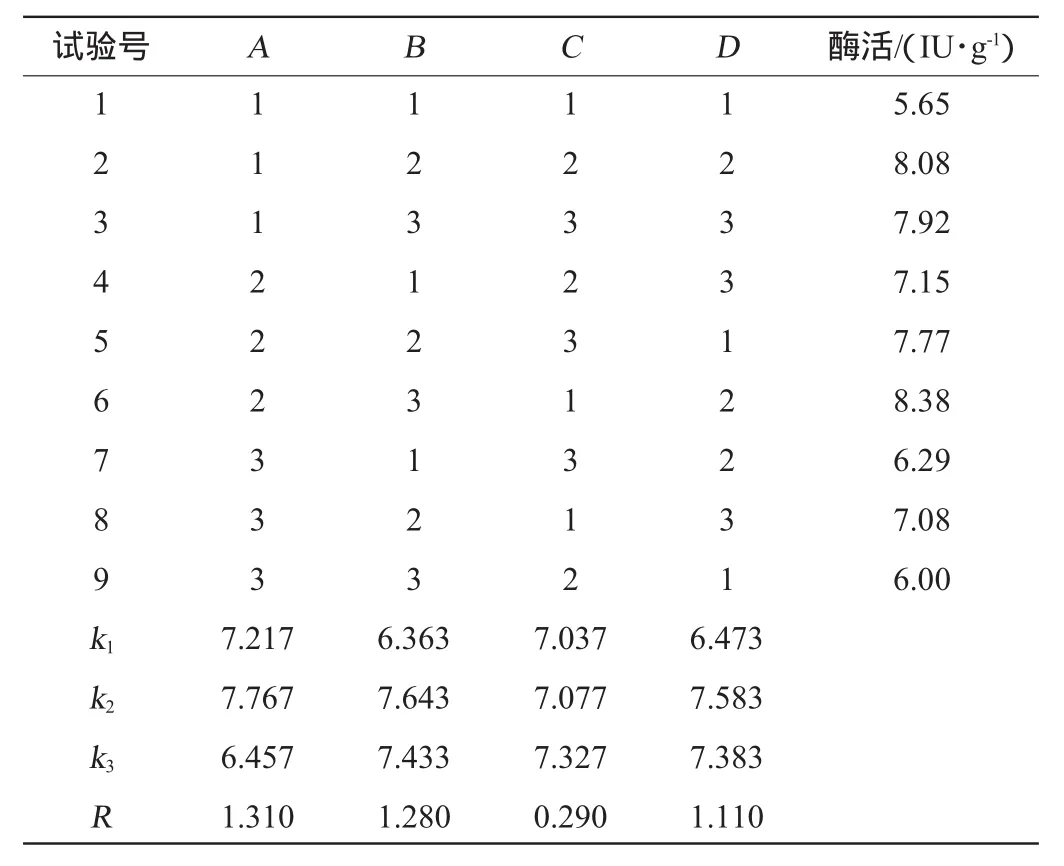
表2 固态发酵工艺优化正交试验结果与分析Table 2 Results and analysis of orthogonal experiments for solid state fermentation process optimization
由表2可知,极差的大小顺序为A>B>D>C,即玉米芯:麸皮>料水比>发酵时间>发酵温度,说明在绿色木霉固态发酵过程中,对产酶影响最大的因素是原料配比,料水比、发酵时间次之,温度的影响最小。绿色木霉固态产酶发酵的最优条件为A2B2C3D2,即玉米芯∶麸皮=7∶3(g∶g),发酵温度30 ℃,料水比=1∶2.0(g∶mL),固态发酵时间96 h。在此最佳条件下进行验证试验,3组平行实验的CMCase平均酶活为8.95 IU/g;FPAase平均酶活为2.00 IU/g。
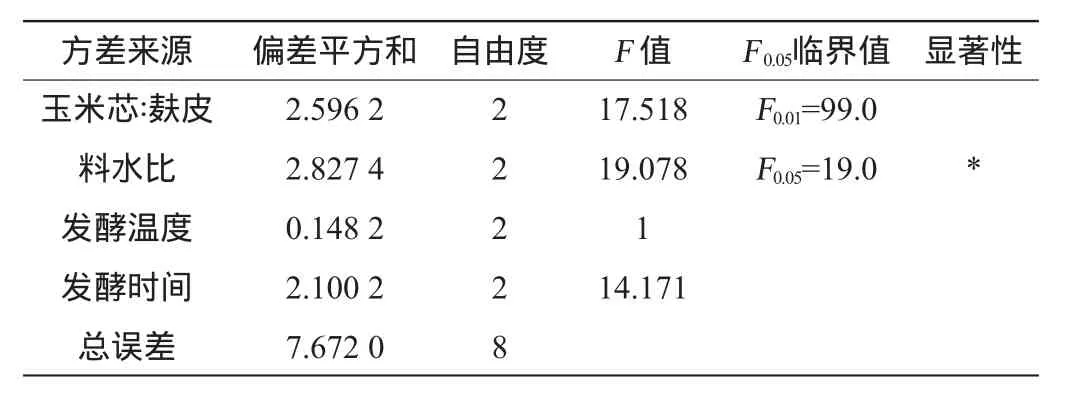
表3 正交试验结果方差分析Table 3 Variance analysis of orthogonal experiments results
由表3可知,料水比对结果影响显著(P<0.05),其余因素对结果影响均不显著。
3 结论
微生物的生长和代谢产物的积累受培养基组成如碳源、氮源、无机盐、生长因子等多种因素的影响,上述因素对不同菌株的影响也各不相同。本研究发现,绿色木霉JD-1固态发酵玉米芯产纤维素酶的最优条件是玉米芯与麸皮质量比7∶3(g∶g),发酵温度30 ℃,料水比1∶2.0(g∶mL),发酵时间96 h,接种量为10%,硫酸铵添加量为2%。在此最佳发酵工艺条件下,CMCase酶活力为8.95 IU/g,FPAase酶活达2.00 IU/g,酶活力高于已有的一些报道。
天然农作物秸秆和玉米芯等生物质具有高度复杂的结构和成分组成,在其降解过程中需要多种酶的共同作用,木质素的崩解有利于纤维素成分的降解,而纤维素的完全降解需要内切β-1,4-葡聚糖酶、外切β-1,4-葡聚糖酶、β-1,4-葡聚糖苷酶的协同作用。
在后续深入研究中,应对菌株进行改造,以期得到高产纤维素酶和纤维素酶组分比例协调的菌株,提高产酶量,降低生产成本;另一方面需要筛选具有不同产酶特性的菌株,采用多菌株的混合发酵,以丰富发酵物的酶系,提高秸秆资源的综合利用效率。
[1]KUPSKI L,PAGNUSSATT F A,BUFFON J G,et al.Endoglucanase and total cellulase from newly isolatedRhizopus oryzaeandTrichoderma reesei:production,characterization,and thermal stability[J].Appl Biochem Biotech,2014,172(1):458-468.
[2]LONG C,OU Y,GUO P,et al.Cellulase production by solid state fermentation using bagasse withPenicillium decumbensL-06[J].Ann Microbiol,2009,59(2):517-523.
[3]任红梅,刘左军,伍国强,等.木霉W2固态发酵产羧甲基纤维素酶的研究[J].生物技术进展,2013,3(4):270-276.
[4]DHANKHAR R,DHAKA A.Bioconversion of water hyacinth to ethanol by using cellulase fromTrichoderma atrovirideAD-130[J].Adv Mater Res,2014,918:145-148.
[5]许宪松,周玉杰,张建安,等.微波预处理稻壳对纤维素酶固态发酵的影响[J].可再生能源,2006,128(4):21-25.
[6]林建国,胡 瑛,王常高,等.绿色木霉固态发酵啤酒糟生产纤维素酶的研究[J].食品与发酵科技,2009,45(3):30-32.
[7]于 莹,姚日生,齐本坤,等.绿色木霉ZY-1固态发酵产纤维素酶[J].生物加工过程,2009,7(1):54-58.
[8]高晗旸,孙 清,吕济敏,等.利用紫外诱变绿色木霉对玉米秸秆进行酶解糖化的研究[J].沈阳农业大学学报,2013,44(2):237-240.
[9]杜晓兵,郭龙伟,阚国仕,等.绿色木霉Sn-9106固态发酵中药残渣产纤维素酶研究[J].中国酿造,2013,32(5):103-107.
[10]SUN W C,CHENG C H,LEE W C.Protein expression and enzymatic activity of cellulases produced byTrichoderma reeseiRut C-30 on rice straw[J].Process Biochem,2008,43(10):1083-1087.
[11]覃玲灵,何 钢,陈介南.里氏木霉及其纤维素酶高产菌株的研究进展[J].生物技术通报,2011(5):43-49.
[12]EVELEIGH D E,MANDELS M,ANDREOTTI R,et al.Measurement of saccharifying cellulase[J].Biotechnol Biofuels,2009,2(1):21.
[13]赵 爽,纪凤娣,赵章林,等.酒曲中羧甲基纤维素酶活力测定影响因素分析[J].中国酿造,2014,33(10):118-122.
[14]陈晓萍,孙付保,陈晓旭,等.响应面法优化康宁木霉产纤维素酶固态发酵培养基 [J].食品与生物技术学报,2011,30(1):106-112.
[15]王晓明,孙玉辉,张 欢,等.绿色木霉固态发酵生产纤维素酶条件优化与酶的固定化[J].浙江农业学报,2014,26(1):186-193.

