酶解小麦蛋白组分变化及其超氧阴离子去除活性
王章存,曹 芹,王许东,赵学伟,安广杰
(1.郑州轻工业学院 食品与生物工程学院,河南 郑州 450000;2.郑州新威营养技术有限公司,河南 郑州 450000)
谷氨酰胺是人体合成蛋白质和核苷酸的重要原料,它具有促进淋巴细胞的增殖、增强人体免疫功能、提高机体的抗氧化能力、促进大脑发育、提高机体耐力、抗疲劳、抗衰老等一系列生理功能[1-2],已被用于药品和保健食品[3]。近年来的研究表明,以肽形式存在的结合态谷氨酰胺比游离谷氨酰胺的作用效果更明显[4-5]。因此,以蛋白质为原料通过酶解法制备含谷氨酰胺活性肽的研究受到人们的高度重视[6-9]。
小麦蛋白中的谷氨酰胺含量高达35%以上,是目前已知含谷氨酰胺最多的蛋白质[10]。以小麦蛋白为原料通过蛋白酶水解可以获得含有结合态谷氨酰胺的活性肽,它具有原料丰富、价格较低等优势。但目前小麦蛋白酶解研究多以酶解产物的溶解性、水解度或小肽含量等单一指标来优化酶解条件,而不同处理条件下的酶解产物组分变化与其抗氧化活性之间的关联性研究却少见报道[11-12]。
该文在初步比较几种蛋白酶对小麦蛋白水解效率的基础上,进一步研究酶解进程中小麦蛋白的分子组分变化及其清除超氧阴离子的活性,为制备具有较高抗氧化活性的谷氨酰胺活性肽提供必要的理论基础。
1 材料与方法
1.1 材料与试剂
小麦蛋白(又名谷朊粉):河南莲花味精公司;碱性蛋白酶2.4 L、复合蛋白酶、中性蛋白酶:Novozymes公司;木瓜蛋白酶:东恒华道公司;蛋白质/肽标准品及其分子质量分别为:细胞色素C(12 500 u),抑肽酶(6 500 u),杆菌酶(1 450 u),乙氨酰-乙氨酰-酪氨酰-精氨酸(451 u)和乙氨酰-乙氨酰-乙氨酸(189 u):郑州利研仪器设备公司。
1.2 仪器与设备
UV8100B紫外可见分光光度计:Lab-Tech公司;600型高效液相色谱仪、2487紫外检测器、M32工作站:美国Waters公司;TSK gel G2000 SWXL(7.8 mm×300 mm)凝胶色谱柱:日本TOSOH公司;LD5-2A型离心机:北京医用离心机厂;SHZ-88A型往复水浴恒温振荡器:太仓市实验设备厂。
1.3 方法
1.3.1 不同蛋白酶水解小麦蛋白效率的比较
在每个酶反应器中加入蒸馏水,将样品小麦蛋白按20 mg/mL添加量分散其中,分别调整温度和pH值,使之分别适应碱性蛋白酶(55℃,pH 8.5)、复合蛋白酶(50℃,pH 7.0)、中性蛋白酶(50℃,pH 7.0)和木瓜蛋白酶(60℃,pH 6.5)反应条件,然后,按酶活为500U/g加入上述4种蛋白酶,反应2 h后,于沸水浴中灭酶10 min后测定水解度(degree of hydrolysis,DH)。
1.3.2 小麦蛋白的酶解
在酶反应器中将小麦蛋白分散到蒸馏水中(使其质量浓度为20 mg/mL),加热到50℃,用1 mol/L NaOH溶液调整pH值为7.0后加入蛋白酶(500 U/g),然后于第0.5 h、1.0 h、2.0 h、3.0 h、4.0 h取出酶解物,沸水浴灭酶后用于指标分析。
1.3.3 水解度测定[13]
采用GB 18186—2000《酿造酱油》中的方法测定氨基酸态氮含量,它与样品总氮含量比值(%)即为水解度(DH)。
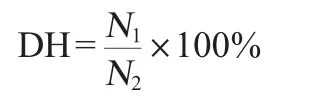
式中:N1为样品中氨基酸态氮含量,mg;N2为样品总氮含量,mg。
1.3.4 可溶性氮含量测定
将酶解后样品放入带盖离心管中,在2 000 r/min转速条件下离心10 min,把上清液转移到凯氏消化管中,加入浓硫酸消化后,按照凯氏定氮方法[14]测定氮含量,它与所取样品中总氮含量比值即为水可溶性氮含量(nitrogen soluble index,NSI)。
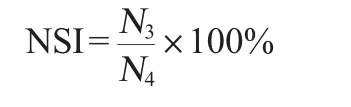
式中:N3为样品中可溶部分含氮量,mg;N4为样品总氮含量,mg。
1.3.5 酸溶性氮含量[15]
将样品分散在10%三氯乙酸(trichloroaceticacid,TCA)溶液(样品固形物含量不超过5%),45℃水浴振荡15 min后,于2 000 r/min转速离心10 min。将上清液转移到凯氏消化管中,于90℃蒸干后,加入浓硫酸消化,按照文献[14]测定氮含量,它与所取样品中总氮含量比值即为酸溶性氮含量(TCA-NSI)。

式中:N5为样品中TCA可溶部分含氮量,mg;N6为样品总氮含量,mg。
1.3.6 分子质量分布测定
采用高效液相色谱法测定[15],TSK gel G2000 SWXL(7.8×300 mm)色谱柱,柱温30℃,上样量10 μL,流动相为乙腈∶水∶三氟乙酸=45∶55∶0.1,流速0.5 mL/min,检测波长220 nm。用分子质量已知的标准品作工作曲线。
1.3.7 超氧阴离子清除率测定
[16]方法。在试管中分别加入0.05 mol/L,pH 8.2的Tris-HCl缓冲液3.0 mL和待测样品0.1 mL,用蒸馏水补至4.0 mL,再加入6.0 mmol/L的邻苯三酚溶液0.08 mL,迅速摇匀,于波长320 nm处每隔30 s测一次吸光度值(共测6次),以不加样品和邻苯三酚的溶液为空白调整仪器零点,对照组以蒸馏水来代替样品,分别作吸光度值随时间变化曲线的回归方程,其斜率为邻苯三酚的自氧化速率A。用下式来计算样品对超氧阴离子的清除率。

式中:A对照为对照组邻苯三酚自氧化速率,ΔA/min;A样品为样品组邻苯三酚自氧化速率,ΔA/min。
1.3.8 数据统计
应用SPSS软件对数据进行处理。
2 结果与分析
2.1 不同蛋白酶水解小麦蛋白效率的比较
小麦蛋白具有较强的吸水特性,且吸水后形成面筋团,难以在水中分散。为了比较不同蛋白酶对小麦蛋白的水解效率,考查了几种蛋白酶在各自最适酶解温度和pH条件下,在加入相同酶活力单位(500 U/g)、相同反应时间(2.0 h)后小麦蛋白的水解度和溶解性能(见图1)。

图1 不同蛋白酶水解产物的水解度和溶解性Fig.1 DH and NSI of different enzymatic hydrolysates
由图1可知,在底物浓度、加酶量和反应时间均相同的条件下,不同酶制剂对小麦蛋白的水解效率有很大差别,中性蛋白酶和木瓜蛋白酶的水解效果远不如碱性蛋白酶和复合蛋白酶。碱性和复合蛋白酶的水解度接近(分别为9.6%和8.9%),但碱性蛋白酶水解物的溶解性能不如复合蛋白酶(分别为36.2%和39.1%)。一般来讲,用同一种酶水解时,酶解物的水解度越高其溶解性越好,但用不同酶制剂水解时,不一定呈现这种趋势。这也反映两种酶的水解特性差异,即由于酶切割位点的差异,即使DH相同,其酶解物的分子大小和组成未必相同,因而表现出不同的溶解性能。所以,该试验选择复合蛋白酶进一步研究酶解过程中小麦蛋白水解产物的成分特征及其抗氧化活性的变化。
2.2 不同酶解时间条件下小麦水解蛋白成分的特征
2.2.1 溶解性能的变化
在50℃、pH 7.0条件下,用复合蛋白酶水解小麦蛋白,分析不同酶解时间所得产物水解度、水溶性氮和酸溶性氮含量的变化,结果见图2。
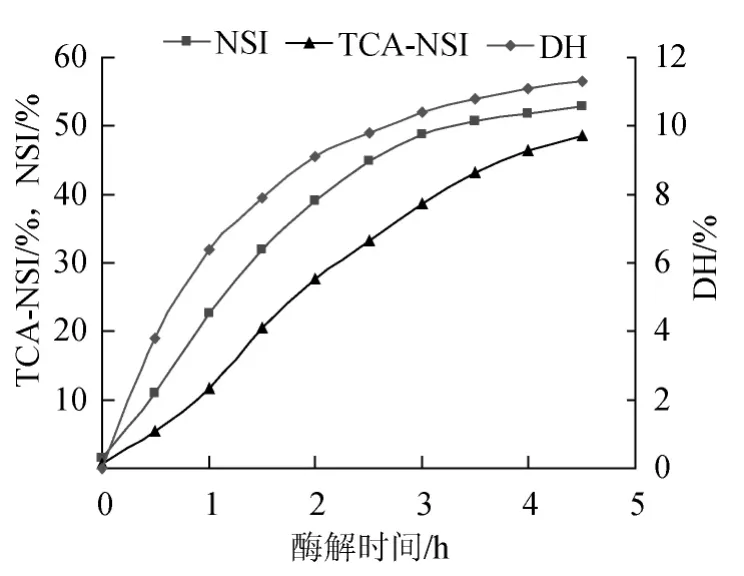
图2 不同酶解进程中产物的性能指标Fig.2 DH,NSI and TCA-NSI of hydrolysates with different hydrolysis time
由图2可知,酶解过程中,随着水解时间的增加,酶解产物在水中和在三氯乙酸中的溶解性均呈增加趋势,但三者之间的增加幅度并非同步,在起初的1 h内,酶解物的水溶性比酸溶性的含量增加幅度大,酶解后期(3.5 h),酶解物的水溶性指标增加趋于平缓,而酸溶性蛋白仍保持较高的增加幅度,表明水溶性的蛋白质分子继续水解为更小的肽分子。本研究表明,以酸溶性蛋白含量为评价指标来确定最佳酶解时间更合适,最终选择复合蛋白酶的最佳酶解时间为4 h。
2.2.2 酶解产物的分子质量分布
分子质量大小是蛋白质或肽组分的重要特征,也是了解其溶解性和功能性变化的分子基础。图3是小麦蛋白经复合蛋白酶水解1 h、2 h、3 h和4 h(分别以T1,T2,T3,T4表示)时产物的凝胶色谱图,通过标准品蛋白质/肽制作的标准曲线,确定不同分子质量对应的保留时间,将其分为8个分子量区间,按归一化法计算各区间组分的比例(见图4)。
由图3、图4可以看出,随着酶解时间的延长,各区间组分的比例发生规律性变化,且不同酶解时间的产物组分在多个区间的相对比例有较大差异,而在分子质量为500~1000u区间的相对含量变化不大。蛋白质酶解过程中的分子质量逐渐变小,其中500~1 000 u区间不是最后的区间,其成分不是固定不变的,而是处于动态变化中,即:酶解过程中较大分子降解后会生成该区间的成分,同时该区间原有的部分成分会降解为更小的分子。水解物的溶解性能、分子质量分布及其超氧离子清除能力。对比分析各项指标的变化规律,结果表明,随着酶解时间延长,各项指标变化趋势一致,但其变化幅度并非相同,最终选择4 h为最佳酶解时间。这反映了蛋白质酶解物的超氧阴离子清除能力具有较复杂的分子机制,有待于深入研究。

图3 不同酶解时间条件下产物的凝胶色谱图Fig.3 Gel chromatography of hydrolysates with different hydrolysis time

图4 不同酶解时间水解物分子质量分布比例Fig.4 Proportion of molecular weight of different hydrolysates
2.3 小麦水解蛋白的超氧阴离子清除能力
图5表示不同酶解时间所得产物清除超氧阴离子的能力大小。可以看出,随着酶解时间的延长,其超氧阴离子清除率提高,但与产物水解度DH、溶解性的变化幅度(图2)并非完全吻合,在酶解1 h和2 h时其清除率值很小(分别为5.58%和12.62%),酶解3 h和4 h时酶解产物的清除率分别为27.39%和28.51%,即酶解时间超过3 h后,虽然酶解产物中小分子肽的含量增加,但其抗氧化活性增加幅度较小。说明较小的肽分子有利于表现抗氧化活性,长短不一的肽分子之间还可能有一定的协调作用。文献[12]中大豆肽分子的抗氧化活性也有类似现象。本研究以酶解物清除超氧阴离子的能力为指标,确定复合蛋白酶的最优酶解时间为4 h。
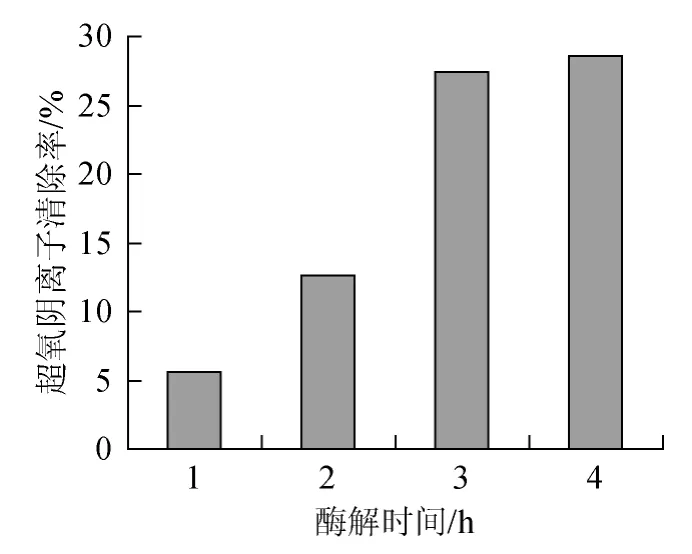
图5 不同酶解时间对超氧阴离子清除率的影响Fig.5 Effect of different hydrolysis time on clearance ratio of superoxide anion
3 结论
本研究以小麦蛋白为原料,首先以酶解物的溶解性能为指标比较了几种常用蛋白酶的水解效率,在此基础上,选择酶解效率较高的复合蛋白酶,深入研究酶解过程中
参考文献:
[1]EWASCHUK J B,MURDOCH G K,JOHNSON IR,et al.Glutamine supplementation improves intestinal barrier function in a weaned piglet model ofEscherichia coliinfection[J].Brit J Nutr,2011,106(6):870-877.
[2]CHAMORRO S,BLAS C,GRANT G,et al.Effect of dietary supplementation with glutamine and a combination of glutamine-arginine on intestinal health in 25-d-old weaned rabbits[J].J Anim Sci,2009,88(1):170-180.
[3]VAN ZWOL A,NEU J,VAN ELBURG R M.Long-term effects of neonatal glutamine-enriched nutrition in very-low-birth-weight infants[J].Nutr Rev,2011,69(1):2-8.
[4]HAYNES T E,LI P,LIU X L,et al.L-Glutamine or L-alanyl-L-glutamine prevents oxidant-or endotoxin-induced death of neonatal enterocytes[J].Amino Acids,2009,37(1):131-142.
[5]CRUZAT V F,BITTENCOURT A,SCOMAZZON S P.Oral free and di-peptide forms of glutamine supplementation attenuate oxidative stress and inflammation induced by endo-toxemia[J].Nutrition,2014,30(5):602-611.
[6]肖 香,钱静亚,崔凤杰,等.碱性蛋白酶降解小麦面筋蛋白制备抗氧化产物的工艺优化[J].食品研究与开发,2009,30(8):38-40.
[7]马洪龙,韩 飞,李爱科.碱性蛋白酶水解小麦面筋蛋白制取谷氨酰胺肽的研究[J].粮油食品科技,2014,2(1):54-57.
[8]杨得胜,张源淑,邹思湘.水解面筋蛋白高效制备谷氨酰胺结合肽的研究[J].食品科学,2006,27(9):181-185.
[9]SUETSUNA K,CHEN J R.Isolation and characterization of peptides with antioxidant activity derived from wheat gluten[J].Food Sci Technol Res,2002,8(3):227-230.
[10]王章存,张子峰,张新武,等.一种测定蛋白质或其水解物中结合态谷氨酰胺含量的方法.中国,CN 201410131180.7[P].2014-04-03.
[11]刘树兴,乔晓林.木瓜蛋白酶酶解谷朊粉制备抗氧化多肽的[J].食品工业科技,2013,34(21):167-171.
[12]林 琳,崔凤杰,闫桂强.不同分子量小麦面筋蛋白酶解多肽的分离及其抗氧化活性研究[J].粮食与饲料工业,2010,23(8):34-36.
[13]中国调味品协会.GB 18186—2000酿造酱油[S].北京:中国标准出版社,2000.
[14]中华人民共和国卫生部.GB 5009.5—2010食品安全国家标准食品中蛋白质的测定[S].北京:中国标准出版社,2010.
[15]全国粮油标准化技术委员会.GB/T 22492—2008大豆肽粉[S].北京:中国标准出版社,2008.
[16]王章存,徐 贤.酶解大豆蛋白制取超氧阴离子清除活性肽的研究[J].食品工业科技,2008,29(10):142-145.

