从豆渣中提取水溶性大豆多糖的工艺优化研究
桂雨豪,郭蔼明,杨锦杰,钟振声*
(华南理工大学 化学与化工学院,广东 广州 510640)
豆渣是大豆食品加工的副产物,我国每年用于食品加工的大豆约1 000万t左右,按每加工1 t大豆产生2 t湿豆渣来算,我国大豆行业每年产生约2 000万t湿豆渣[1-3]。目前,大部分豆渣被用作饲料、肥料使用,资源的利用度不高。豆渣干物质中含有约30%的水溶性多糖类物质[1-3],是一种天然的功能性活性成分,具有良好的抗氧化和稳定酸性乳液中蛋白质的作用[4-5]。如何高值利用豆渣中的生理活性物质是一个有应用前景的研究课题。
目前对水溶性大豆多糖(soybean soluble polysaccharide,SPSS)的提取方法主要有热水提取法、酸法、碱法、微波法和超声波辅助酶解法等[5-11]。MAKIO M等[12]用热水蒸煮大豆子叶得到了38%的SPSS;汪洪涛等[13]在酸性条件提取SPSS,提取率达到36.02%;KAWAMURA S等[14]在90 ℃水中逐步加入草酸铵和0.5%的NaOH得到了32%的SPSS;尹艳等[15]对微波提取豆渣中水溶性大豆多糖进行研究,提取率为18.04%;田瑞红等[16]采用超声波协同纤维素酶法提取水溶性大豆多糖,最后提取率为25.92%。
本实验主要利用水压热法从豆渣中提取水溶性大豆多糖的工艺,在密闭反应体系中水受热变成蒸汽并形成一定的压力,豆渣纤维素、半纤维素等的碳链发生裂解,形成分子质量更小的水溶性大豆多糖。水压热法不需要添加其他化学物质或酶制剂,产物的分离提纯比较简单,生产设备也比微波法和超声波法简单。本研究探讨了各项工艺参数对所得多糖产品品质的影响,尝试用简单的工艺在兼顾产物品质的同时提高SPSS的收率,为生产高品质的水溶性大豆多糖提供一条思路。
1 材料与方法
1.1 材料与试剂
豆渣粗纤维:广州华汇公司提供;盐酸、氢氧化钠等均为分析纯试剂。
1.2 仪器与设备
岛津UV-2450紫外可见分光光度计:杭州瑞析科技有限公司;Scientz-10N冷冻干燥机:上海仪电科学仪器股份有限公司;PHS-3CpH计:宁波新芝生物科技股份有限公司;RE-52AA旋转蒸发器、SHZ-D(Ⅲ)水循环真空泵:上海亚荣生化仪器厂;DF-101s集热式恒温加热磁力搅拌器:巩义予华仪器公司;PCF高压反应釜:郑州探索者实验室设备有限公司。
1.3 实验方法
1.3.1 水溶性大豆多糖的制备
将烘干的豆渣粗纤维过40目筛,加入一定体积的蒸馏水,搅拌均匀,加入1∶1(V/V)HCl将溶液调至合适的pH值,放入高压反应釜中反应一定时间,过滤。取滤液,浓缩至一定体积,在-40℃冷冻干燥,得到大豆粗多糖。
1.3.2 多糖透明度测定[17]
多糖透明度测定按照国家粮食行业标准LS/T 3301—2005《可溶性大豆多糖》中的方法进行。称取3.00 g粗多糖样品,慢慢加入97 mL水中,搅拌均匀,配制成3%多糖水溶液。以蒸馏水作参比,用1 cm比色皿,在波长610 nm处测定透光率表示多糖透明度。
1.3.3 还原糖测定
还原糖含量测定按照国标GB/T 5009.7—2008《食品中还原糖含量的测定》中的直接滴定法进行[18]。
1.3.4 粗多糖的产率
粗多糖的产率计算公式如下:

1.3.5 多糖纯度[17]
可溶性多糖含量测定按照国家粮食行业标准LS/T 3301—2005《可溶性大豆多糖》中附录A中方法进行,所得可溶性多糖含量与大豆粗多糖质量之比即为多糖的纯度。
1.3.6 单因素试验
分别以提取温度(80℃、100℃、110℃、120℃、130℃、140 ℃)、提取时间(1 h、2 h、3 h、4 h、5 h)、pH值(2.5、3.5、4.5、5.5、6.5)、固液比(1∶5、1∶10、1∶15、1∶20、1∶25(g∶mL))为影响因素,考察各因素对粗多糖产率、还原糖含量、透明度、多糖纯度的影响。
1.3.7 正交试验设计
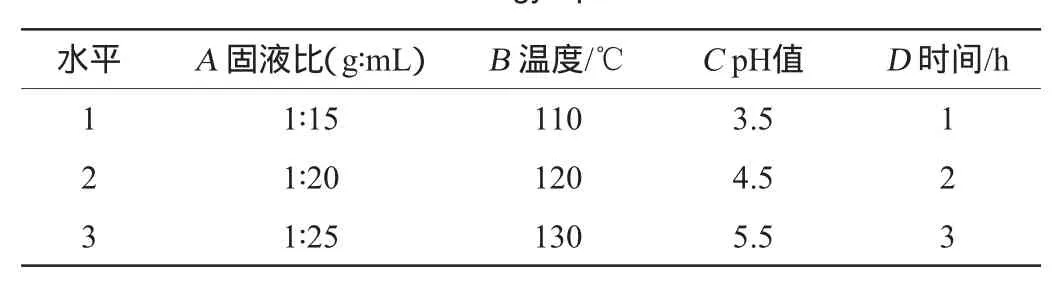
表1 提取工艺优化正交试验因素与水平Table 1 Factors and levels of orthogonal experiments for extraction technology optimization
在单因素试验的基础上,进行4因素3水平正交试验。综合评分(Z)标准为:将各项指标除以最大值再乘以100为该项得分,设定粗多糖产率(x)、还原糖含量(y)、透明度(m)、多糖纯度(n)各项系数为0.25,对四项指标加权求和。通过公式Z=0.25x-0.25y+0.25m+0.25n,得到综合评分(Z)。
2 结果与分析
2.1 单因素试验结果分析
2.1.1 提取温度对产率、还原糖含量、透明度、多糖纯度的影响
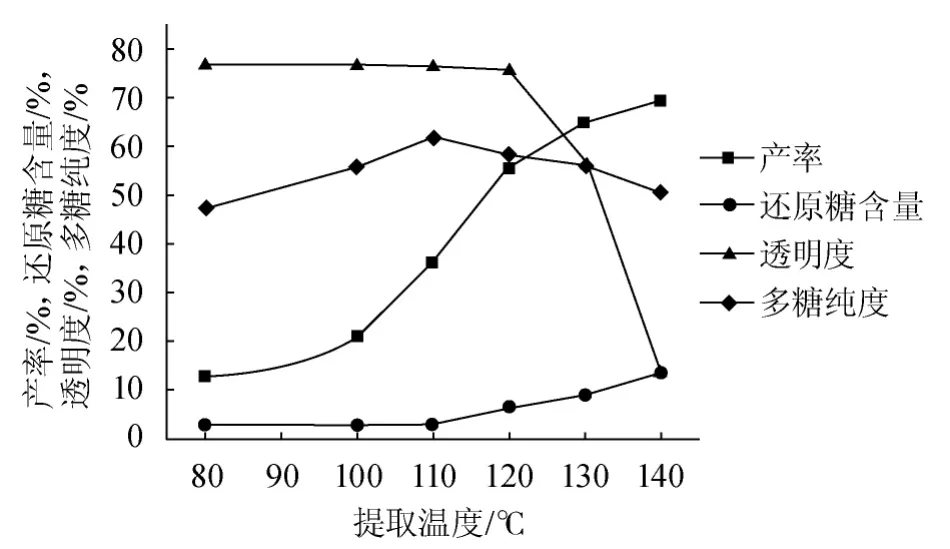
图1 提取温度对粗多糖产率、还原糖含量、透明度、水溶性大豆多糖纯度的影响Fig.1 Effect of extraction temperature on crude polysaccharides yield,reducing sugar content,transparency and purity of SPSS
由图1可知,在固液比1∶20(g∶mL)、反应时间2 h、pH 4.5的固定条件下,产率、还原糖含量与温度呈正比例关系,80~120℃产率提高最快,120℃以后增长幅度开始下降;而还原糖含量在110℃以前基本保持不变,之后呈线性增长并有持续增长的趋势。在80~120℃之间,产物透明度基本保持不变,温度>120℃后透明度直线下降。多糖纯度随着温度升高先增后减,在110℃纯度最高。综合考虑,选择提取温度120℃为宜。
2.1.2 提取时间对粗多糖产率、还原糖含量、透明度、多糖纯度的影响
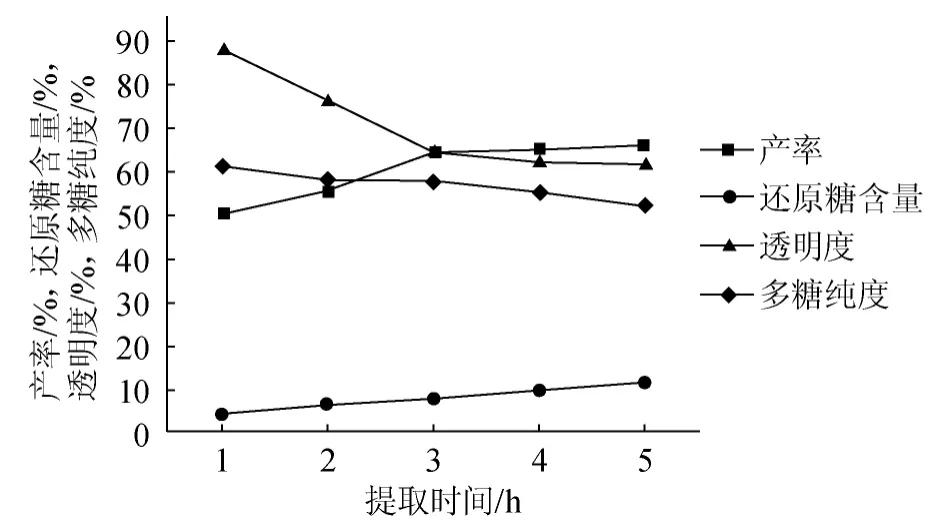
图2 提取时间对粗多糖产率、还原糖含量、透明度、多糖纯度的影响Fig.2 Effect of extraction time on crude polysaccharides yield,reducing sugar content,transparency and purity of SPSS
由图2可知,在固液比1∶20(g∶mL)、温度120 ℃、pH 4.5的固定条件下,产率、还原糖含量与提取时间呈正比例关系,在1~3 h内,产率随提取时间逐渐升高,3 h之后基本维持稳定;而还原糖与提取时间一直保持着线性的增长。透明度和多糖纯度与时间呈反比例关系,在3 h以前,透明度随时间的增长显著降低,3 h后下降趋势变换并有逐渐稳定的趋势;多糖纯度虽然一直降低,但是在2~3 h之间变化较慢。为了得到高品质的多糖产品,选择提取时间以2 h为宜。
2.1.3 pH值对粗多糖产率、还原糖含量、透明度、多糖纯度的影响
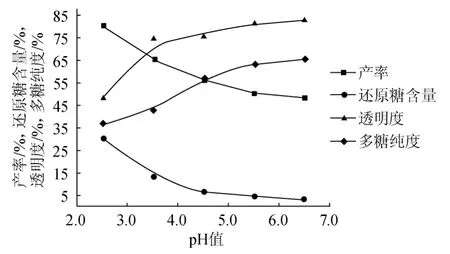
图3 pH对粗多糖产率、还原糖含量、透明度、多糖纯度的影响Fig.3 Effect of pH on crude polysaccharides yield,reducing sugar content,transparency and purity of SPSS
由图3可知,在固液比1∶20(g∶mL)、温度120 ℃、提取时间3 h的固定条件下,产率、还原糖含量与pH值呈反比例关系,在pH 2.5~4.5时,产率和还原糖含量下降速度很快,当pH>4.5以后,下降速度变缓。透明度和多糖纯度与pH值呈正比例关系,在pH 2.5~4.5,透明度和多糖纯度显著提高,pH>4.5以后,透明度和多糖纯度缓慢提高并有逐渐不变的趋势。综合考虑,选择pH 4.5为宜。
2.1.4 固液比对粗多糖产率、还原糖含量、透明度、多糖纯度的影响

图4 固液比对粗多糖产率、还原糖含量、透明度、多糖纯度的影响Fig.4 Effect of solid-liquid ratio on the crude polysaccharides yield,reducing sugar content,transparency and purity of SPSS
由图4可知,在温度120℃、pH 4.5、提取时间2 h的固定条件下,产率、多糖纯度、透明度与固液比呈正比例关系,在固液比1∶5~1∶15(g∶mL),产率、透明度、多糖纯度均有显著提高;在固液比>1∶15(g∶mL)以后,上升变缓;而还原糖含量与固液比变化关系不大。综上所述,选择固液比定在1∶20(g∶mL)为宜。
2.2 多糖提取的工艺优化正交试验
为了优化酸性条件下提取水溶性大豆多糖的工艺条件,考察各因素对试验结果的影响情况,在单因素试验基础上,设计4因素3水平的L9(34)正交试验,结果与分析见表2。
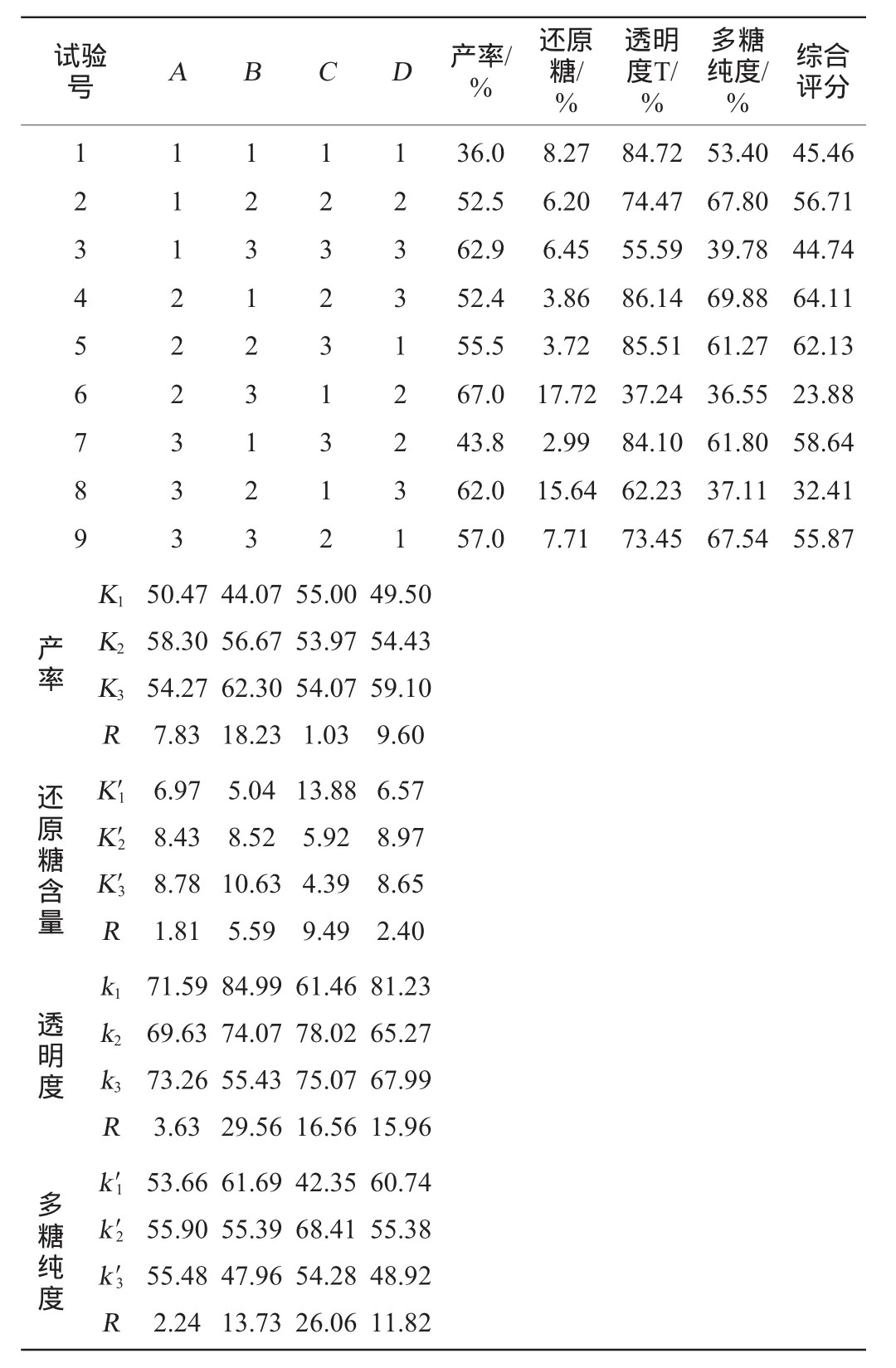
表2 提取工艺优化正交试验结果与分析Table 2 Results and analysis of orthogonal experiments for extraction technology optimization
由表2可知,以粗多糖产率为评价指标各因素的影响顺序为提取温度(B)>提取时间(D)>固液比(A)>pH值(C),温度对产率的影响最大,粗多糖产率最高的组合是A2B3C1D3,即最佳提取工艺为固液比1∶20(g∶mL),提取温度130℃,pH 3.5,提取时间3 h。
以还原糖为评价指标各因素的影响顺序为pH值(C)>提取温度(B)>提取时间(D)>固液比(A),提取温度对还原糖含量的影响最大,还原糖最低的组合是A1B1C3D1,即最佳提取工艺为固液比1∶15(g∶mL),提取温度110 ℃,pH 5.5,提取时间1 h。
以透明度为评价指标各因素的影响顺序为提取温度(B)>pH值(C)>提取时间(D)>固液比(A),提取温度对透明度的影响最大,透明度最高的组合是A3B1C2D1,即最佳提取工艺为固液比1∶25(g∶mL),提取温度110 ℃,pH 4.5,提取时间1 h。
以多糖纯度为评价指标各因素的影响顺序为pH值(C)>提取温度(B)>提取时间(D)>固液比(A),pH值对多糖纯度的影响最大,多糖纯度最高的组合是A2B1C2D1,即最佳提取工艺为固液比1∶20(g∶mL),提取温度110 ℃,pH 4.5,提取时间1 h。
综合考虑,提取温度对可溶性大豆多糖产品影响最大,pH值和提取时间其次,固液比的影响较小。根据综合评分,组合4评分最高,所以宜选用A2B1C2D3组合,即工艺条件为固液比1∶20(g∶mL),提取温度110 ℃,pH 4.5,提取时间3 h。在此最佳条件下得到的水溶性大豆多糖产率为52.4%,透明度为86.14%,还原糖含量为3.86%,多糖纯度为69.88%。
3 结论
本研究通过单因素试验考察了固液比、温度、pH值、提取时间对水溶性大豆多糖产品各方面的影响,通过正交试验确定了影响产率、透明度、还原糖含量、多糖纯度的主次顺序。通过综合评价系统得出了采用水压热法从豆渣提取大豆多糖的最佳工艺条件为固液比1∶20(g∶mL),温度110℃,pH 4.5,提取时间3 h。在此最佳条件下得到的水溶性大豆多糖产率为52.4%,透明度为86.14%,还原糖含量为3.86%,多糖纯度为69.88%。
[1]张振山,叶素萍,李 泉,等.豆渣的处理与加工利用[J].食品科学,2004,25(10):400-405.
[2]董 英.大豆渣营养价值及其综合利用[J].粮食与油脂,2001(12):41-42.
[3]高金燕.豆渣的营养与药用价值[J].中国食物与营养,2003(11):48-50.
[4]FURUTA H,MAEDA H.Rheological properties of water-soluble soybean polysaccharides extracted under weak acidic condition[J].Food Hydrocolloid,1999,13(3):267-274.
[5]谭永辉,王文生,秦玉昌,等.豆渣中水溶性大豆多糖的提取与应用[J].大豆科学,2008,27(1):150-153.
[6]FURUTA H,TAKAHASHI T,TOBE J,et al.Extraction of water-soluble soybean polysaccharides under acidic conditions[J].Biosci Biotech Biochem,1998,62(12):2300-2305.
[7]NAKAMURA A,FURUTA H,MAEDA H,et al.Analysis of structural components and molecular construction of soybean soluble polysaccharides by stepwise enzymatic degradation[J].Biosci Biotech biochem,2001,65(10):2249-2258.
[8]NAKAMURA A,YOSHIDA R,MAEDA H,et al.Soy soluble polysaccharide stabilization at oil-water interfaces[J].Food Hydrocolloid,2006,20(2):277-283.
[9]田瑞红,江连洲,胡少新,等.超声波酶法提取豆渣中水溶性多糖条件的优化[J].食品工业科技,2011,32(11):305-308.
[10]张学兵.水溶性大豆多糖的提取及其在酸性乳饮料中的应用研究[D].杭州:浙江工商大学硕士论文,2009.
[11]马殿君,张永泰.水溶性大豆多糖的制备及其在酸性乳饮料中的应用[J].饮料工业,2007,10(7):19-21.
[12]MAKIO M.Polysaccharides of soybean seeds:Part I.Polysaccharide constituents of“hot-water-extract”fraction of soybean seeds and an arabinogalactan as its major component[J].Agr Biol Chem,1965,29(6):564-573.
[13]汪洪涛,陈 成,李小华,等.豆渣中水溶性大豆多糖提取工艺的优化[J].江苏农业科学,2013,41(12):290-292.
[14]KAWAMURA S,NARASAKI T.Studies on the carbohydrates of soybeans:partVI.componentsugarsoffractionatedpolysaccharides,especially identification of fucose in some hemicelluloses[J].Agr Biol Chem,1961,25(7):527-531.
[15]尹 艳,高文宏,于淑娟.微波提取水溶性大豆多糖工艺研究[J].食品研究与开发,2008,29(2):21-23.
[16]田瑞红,江连洲,胡少新,等.超声波酶法提取豆渣中水溶性多糖条件的优化[J].食品工业科技,2011(11):305-308.
[17]南京财经大学.LST 3301—2005可溶性大豆多糖[S].北京:中国标准出版社,2005.
[18]中国疾病预防控制中心营养与食品安全所,北京市疾病预防控制中心.GB/T 5009.7—2008食品中还原糖含量的测定[S].北京:中国标准出版社,2008.

