骨髓基质干细胞与功能化自组装多肽的生物相容性研究
李鹏斌 王凯 车彪 郑启新 张振兴
论著·实验研究
骨髓基质干细胞与功能化自组装多肽的生物相容性研究
李鹏斌 王凯 车彪 郑启新 张振兴
目的检测骨髓基质干细胞 (BMSCs)在功能化自组装多肽水凝胶中分化及生物相容性。方法自组装多肽RADA16与多肽RADA16-IKVAV委托上海吉尔生物科技公司合成,将两者混合制备功能化自组装多肽水凝胶,用原子力显微镜(AFM)观察其形态学特征。体外分离、扩增、纯化鼠BMSCs并流式分析其表面抗原标志,将BMSCs分别接种到接种到RADA16自组装多肽水凝胶(对照组)与功能化自组装多肽水凝胶(实验组)表面。激光扫描共聚焦显微镜 (LSCM)观察细胞迁移情况。应用Nestin、MAP2、GFAP免疫荧光染色,检测骨髓基质干细胞分化情况。结果AFM显示功能化自组装多肽水凝胶由纳米纤维组成,其直径为7.0~8.0 nm。分离的BMSCs细胞表面标志CD90、CD44、CD34和CD45的阳性率分别为93.71%、92.5%、1.1%、2.18%。共培养后实验组中BMSCs的增殖及迁移能力均明显高于对照组 (<0.05);实验组中 MAP2阳性细胞百分率较对照组显著提高(<0.05),GFAP阳性细胞百分率较对照组显著降低 (<0.05)。结论功能化自组装多肽水凝胶具有良好的细胞生物相容性,从而为神经组织工程提供了一个有前景的生物材料。
水凝胶;骨髓基质干细胞;生物相容性;生物材料
近年来,一系列用于组织工程的自组装多肽水凝胶被设计并合成出来。水凝胶支架为细胞提供了一个三维生长空间,较传统的二维培养,这种立体的培养更接近于细胞在机体内的生长方式。并且通过在自组装多肽的末端修饰几个短序列生物活性模体 (motifs)进行功能化,用以促进不同细胞的黏附生长,从而为组织修复、组织工程提供了一种极有前景的生物材料[1]。
正常组织细胞外基质(ECM)含有大量的层粘连蛋白能使前体细胞如骨髓间充质干细胞 (mesenchymalstem cells, MSCs)向神经元分化,多肽片断异亮氨酸-赖氨酸-缬氨酸-丙氨酸-缬氨酸(isoleucine-lysinevaline-alanine-valine,IKVAV)是层粘连蛋白的1链中包含的核心功能片断,能降低神经元的死亡率,并诱导轴突的发生和生长[2],架抑制胶质瘢痕形成并促进轴突延伸生长[3],RADA l6(精氨酸-丙氨酸-天冬氨酸-丙氨酸-16)是自我互补的两亲性多肽,在水溶液中能自组装成含水量超过99%的水纳米凝胶纤维,可以让营养物质和氧气运输到其内种植的细胞内;降解只形成氨基酸,对机体不会产生不良影响。本实验通过直接固相法在RADAl6的羧基末端修饰IKVAV模体合成RADA l6-IKVAV,将自组装多肽RADAl6与多肽RADAl6-IKVAV混合制备功能化自组装多肽水凝胶,并且检测骨髓基质干细胞 (BMSCs)在功能化自组装多肽水凝胶中定向分化及细胞相容性。
1 材料和方法
1.1 动物与主要试剂
Sprague-Dawley大鼠(华中科技大学同济医学院动物中心提供),雌雄不限,4周龄,体重约100g;低糖 DMEM、胎牛血清、胰蛋白酶、DMEM/F12购于Gibco公司;碱性成纤维细胞生长因子(bFGF)、表皮生长因子(EGF)、Hoechst 33342、维甲酸 (RA)、音猬因子 (SHH)购自Sigma公司;一抗:兔抗大鼠神经上皮干细胞蛋白(nestin)抗体、胶质酸性蛋白 (glial fibrllary acidic protein,GFAP)抗体、兔抗大鼠微管相关蛋白-2(Microtubule-associated protein-2,MAP-2)抗体;二抗:异硫氰酸荧光素 ((fluorescein isothiocyanat,FIFC)标记羊抗鼠,均购自武汉博士德公司。
1.2 材料
多肽RADA16的序列为:can-RADARADARADARADA -CONH2,多肽RADA16-IKVAV的序列为:can-RADARADARADARADA-GG-IKVAV-CONH2,均委托上海吉尔生物科技公司合成。用高效液相色谱仪和质谱仪进行纯化和分析:RADA16相对分子质量为1712.78,RADA16-IKVAV相对分子质量为2337.57,纯度均大于98%。将多肽加入无菌去离子水中,使终浓度为0.5%(W/V),并用超声波破碎30 min。将0.5%RADA16溶液与0.5%RADA16-IKVAV溶液以4:1的体积比混合制备功能化自组装多肽溶液。
1.3 原子力显微镜 (AFM)检测
原子力显微镜型号:Nanoscope IV(VEECO,USA)。成像模式:轻敲模式,将0.5%功能化自组装多肽溶液用超声波破碎30分钟,然后将多肽溶液稀释到0.01%的工作浓度,在室温下静置2小时。吸取溶液10uL滴到新剥离的云母片表面,置于室温下自然干燥。
1.4 BMSCs的取材和培养
大鼠用体积百分比为10%水合氯醛30mg/kg腹腔注射麻醉,无菌分离出双侧股骨和胫骨,剪去两侧骨端,用含15%(体积分数)胎牛血清的LG-DMEM培养基反复冲洗骨髓腔,吹打分散细胞,过200目筛网。装入10 m L的无菌离心管中,1000r/m in离心10分钟,离心半径10cm,去除上清和脂肪细胞,相同培养基重悬,1000r/m in离心5分钟,吸取细胞层的上半部分重悬,以3×104/m L的密度接种至50m L培养瓶中,置于37℃、5%(体积分数)的CO2饱和湿度孵育箱中,48小时后首次换液,以后每72小时换液1次,当细胞完全融合时,0.25%胰蛋白酶1∶3消化传代,接种密度为3×104/m L,继续培养,取第6代细胞备用。
1.5 BMSCs流式鉴定
将鼠BMSCs用0.25%胰酶消化后用含10%FBS的培养液终止消化,2000rpm/m in离心去除培养基。PBS溶液洗1遍,将每个条件下的细胞浓度调整至1×106/m L。取1m L细胞悬液加入流式管中,PBS溶液洗两遍,缓冲液(Binding buffer)重悬。加入抗CD90、CD44、CD34和CD45抗体,其同型非特异性IgG-PE对照,避光室温反应20分钟。流式上机检测。
1.6 BMSCs与水凝胶复合培养
将0.5%RADA16溶液与0.5%功能化自组装多肽溶液用超声波破碎30分钟,然后将浓度稀释为0.25%。100uL/孔加至Transwell小室(Corning,USA)上室的聚碳酸脂膜(孔径8um)上,加入BMSCs培养基触发多肽溶液自组装。37℃孵育30分钟,此时水凝胶已形成。取第六代BMSCs,调整细胞密度为105/m L,以200uL/孔种植于RADA16自组装多肽水凝胶 (对照组)与功能化自组装多肽水凝胶 (实验组)表面。开始每组加诱导液5ng/m L的bFGF和EGF,6天后改为混合2umol/m L RA和15ng/m L Shh诱导,各组均3天换一次液,18天停止诱导,定期置于倒置相差显微镜下观察与照相。
1.7 细胞分化检测
复合培养培养13天后,小心吸出Transwell小室中培养基,PBS漂洗3次,4%多聚甲醛室温下固定;吸出固定液,PBS漂洗3次;2%BSA封闭非特异性抗原;加一抗Nestin (rabbit anti-rat,1∶100),MAP2(rabbit anti-rat,1∶100),GAFP(rabbitanti-rat,1∶100),CC-1(rabbitanti-rat,1∶100),37℃孵育;PBS漂洗3次;加入FITC荧光二抗 (goat antirabbit,1:50),37℃避光孵育;PBS漂洗3次;用Hoechst33342(5ug/m L)对细胞核进行染色,以确定细胞总数。激光共聚焦扫描显微镜下观察,激发光波长为490nm,发射光波长为515nm。每个Transwell小室随机选择10个不同的视野,计数抗原阳性细胞数和 Hoechst33342染色阳性的正常细胞的胞核数,然后计算阳性细胞在总细胞数中所占的比例。
1.8 统计学方法
采用SPSS13.0统计软件进行统计学分析。数据以均数±标准差±s)表示,采用 检验,<0.05为有统计学意义。
2 结果
2.1 多肽自组装后纳米纤维观察
原子力显微镜检测结果显示,功能化自组装多肽水凝胶均由纳米纤维组成。纤维直径为20~30nm,长度可达数百纳米,常温形态水凝胶状(图1),纳米纤维交织形成立体网状结构 (图2)。

图1 RADA16与多肽RADA16-IKVAV自组装形成的多肽水凝胶

图2 原子力显微镜下自组装多肽水凝胶形成纳米纤维结构
2.2 BMSCs流式分析鉴定
检测分离的鼠BMSCs表面标志,结果CD90、CD44、CD34和CD45的阳性率分别为93.71%、92.5%、1.1%、2.18%,BMSCs阳性表达CD90、CD44抗原标记(图3),同时不表达造血干细胞抗原标记CD34和CD45(图4),所分离出的BMSCs纯度较高。细胞贴壁状态良好,并呈指数增殖。(图3,4彩图见插页)
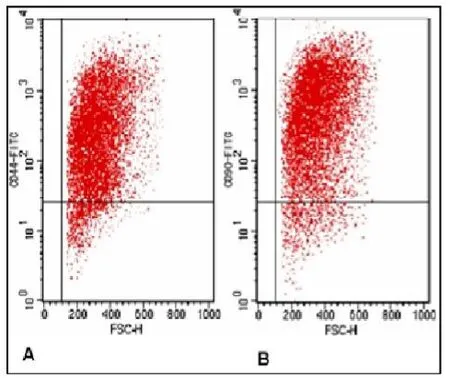
图3 流式细胞仪检测BMSCs细胞表面高表达特异标记CD90、CD44
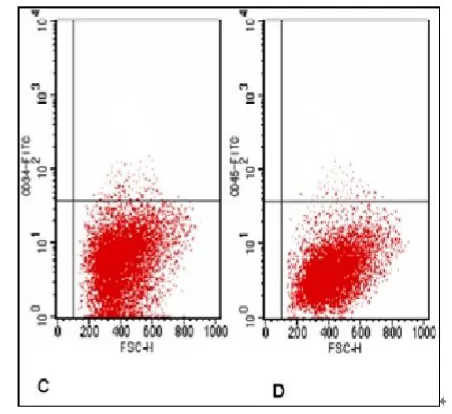
图4 流式细胞仪检测BMSCs细胞表面不表达造血干标记CD34、CD45
2.3 细胞在水凝胶中的形态和迁移
接种后的细胞数量较多,突起较长,并交织成网状结构,加预诱导液6天中细胞增值迅速,6天后加入诱导剂后细胞间隙增宽,可见细胞突起伸长,细胞间可形成连接,10天左右实验组可见神经干细胞球状形态逐渐减少,周围明显出现花瓣状形态(图5),具有神经细胞形态特点的细胞数量逐渐增多,形成双极或多极细胞,13天后细胞有多个突起发出分支,相互交织成网,实验组细胞的变化明显于对照组(图6),到16天后细胞转化达到峰值,形态也不再发生明显改变,具有典型的神经细胞形态,对照组表现不明显。(图5,6彩图见插页)
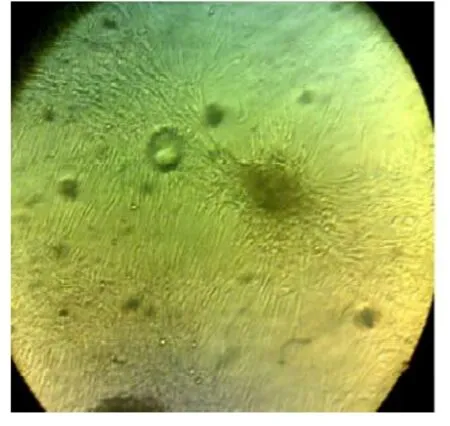
图510 天左右实验组神经干细胞球周围明显出现花瓣状形态×100

图6 实验组细胞形成双极或多极相互交织成网×100
2.4 骨髓基质干细胞分化检测
预诱导4天天开始出现神经干细胞蛋白的阳性,中期6~12天加诱导剂后Nestin阳性细胞开始减少,实验组明显于对照组,发绿色荧光(13.014±3.124)%(图7),神经细胞标志在实验组与对照组增多,实验组为MAP2(59.171±1.839) %(图8)和GFAP(22.103±1.034)%(图9),对照组为MAP2 (29.354±4.845)%和GFAP(36.354±4.846)%,说明BMSCs在按神经细胞分化的方向发展,晚期12~18天后,实验组MAP2(72.536±1.018)%、GFAP(21.536±1.018)%,向神经细胞分化明显于对照组MAP2(31.016±2.371)%和GFAP (23.451±3.735)%,与对照组相比,实验组中向MAP2阳性细胞分化的比例显著增高(<0.05),向GFAP阳性细胞分化的比例明显降低 (<0.05)。(图7,8,9彩图见插页)
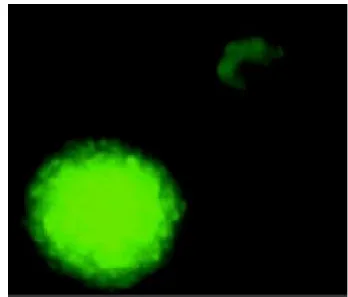
图76 天后激光共聚焦显微镜检测到神经干细胞标记nestin绿色荧光×40

图810 天后激光共聚焦显微镜检测到神经元标志MAP2绿色荧光×40
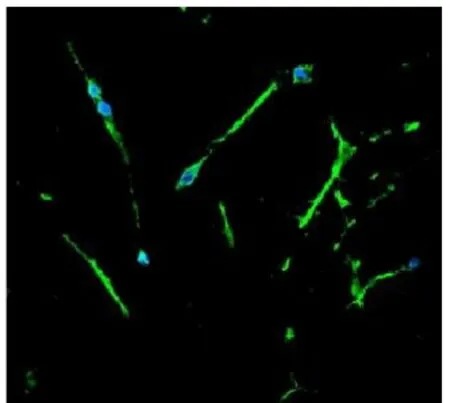
图910 天后激光共聚焦显微镜检测到星型胶质细胞GFAP绿色荧光×20
3 讨论
多肽分子源于自然界、结构简单、无毒副反应及免疫反应、种类繁多、具有好的生物相容性,张曙光等[1]首次从酵母蛋白中发现了一组可自组装的离子互补型多肽,开拓了一个分子自组装技术的新领域,随后设计合成了可支持多种细胞三维生长的RADA16自组装多肽水凝胶[4],近几年来许多研究者通过改变多肽的氨基酸序列,已设计出了众多具有特殊功能的纳米自组装材料应用于不同的科研领域[5,6],这种多肽可根据所培养细胞的特征,改变短肽的氨基酸序列、带电性质,并自组装可构建"智能化"的多肽纳米水凝胶,其结构与功能可随周围环境发生改变,为细胞量身打造生存环境,多肽水凝胶中含水量极高,可以模拟充盈充满水性液体的机体组织,这种柔软、润湿的表面增加细胞的亲和性,为细胞的生长提供一个理想的生活环境,在调控细胞行为和功能研究方面取得了令人瞩目的研究进展。
RADA16是自我互补的两亲性多肽,单元序列为([COCH3]-RADARADARADARADA-[COCH2]),由极性氨基酸 (精氨酸和天冬氨酸)与非极性氨基酸 (丙氨酸)交替排列,分子之间间隔的A形成疏水面,R和D形成亲水面。自组装成纳米纤维的过程成形成 折叠结构,在亲水面往复形成且补离子键组装为纳米纤维,这种多肽水凝胶支架材料在体内不会引起明显的免疫反应和炎症反应[7];功能化多肽纳米纤维不仅在结构上类似于ECM,且在功能上模拟ECM,就是将具功能的特异短肽序列从天然ECM中分离,通过自组装或表面修饰或者改性,将功能活化的抗原表位序列呈递在纳米纤维表面调控细胞生物学行为。来自层粘连蛋白的IKVAV序列具有促进神经细胞的粘附、生长及分化[8],有实验证实神经干细胞存在IKVAV受体LBP110[9,10],及其对BMSCs相容性[11],本实验通过直接固相法在RADA16的羧基末端修饰IKVAV模体合成RADA16-IKVAV,将自组装多肽RADA16与多肽RADA16-IKVAV混合制备功能化自组装多肽水凝胶。髓基质干细胞具有多向分化潜能。有其他干细胞无法比拟的优势,我们根据各种因子在干细胞定向分化过程中的不同作用,以及无毒和高效的原则,选择了四种细胞因子:预诱导剂bFGF和EGF,定向诱导剂(SHH+RA)。结果显示功能化自组装多肽水凝胶能促进BMSCs迁移,提高其BMSCs向神经元分化的比例,并抑制其向星型胶质细胞分化。
本研究结果证实我们设计构建的自组装多肽凝胶对髓基质干细胞有良好细胞相容性,是一种新型的神经组织工程的支架材料。多肽分子自组装在组织工程材料制备方面显示出巨大的潜力,为生物材料的研究开创了一个新方向。
[1] Zhang S.Designer Self-Assembling Peptide Nanofiber Scaffolds for Study of 3-D Cell Biology and Beyond.[J].Adv CancerRes, 2008,99:335-362.
[2] Jackson AR,Yuan TY,Huang CY,et al.Effect of compression and anisotropy on the diffusion of glucose in annulus fibrosus[J].Spine,2008,1:1-7.
[3] Tysseling-Mattiace VM,Sahni V,Niece KL et al.Self-assembling nanofibers inhibit glial scar formation and promote axon elongation after spinal cord injury[J].Neurosci,2008,14:3814-3823.
[4] Zhang s,Holmes t,Lockshin c,etal.Spontaneous assembly of a self-complementary oligopeptide to form a stable macroscopic membrane[J].Natl Acad SciUSA,1993,90(8):3334-3338..
[5] Ruan lp,zhang hy,luo hl,et al.Designed amphiphilic peptide forms stable nanoweb,slow ly releases encapsulated hydrophobic drug,and accelerates animal hemostasis[J].Natl Acad Sci USA, 2009,106(13):5105-5110.
[6] Zhou qh,lin j,wang j,etal.A designed amphiphilic peptide containing the silk fibroinmotif asa potential carrier of hydrophobic drugs[J].Prog NatSci,2009,19:1529-1536.
[7] DavisME,Motion JP,Narmoneva DA,etal.Injectable self-assebling peptide nanofibers create intramyocardial microenvironments for endothelial cells[J].Circulation,2005,111:442-450.
[8] HellerDA,GargaV,KelleherKJ,etal.Patterned networksofmouse hippocampal neurons on peptide-coated gold surfaces[J].Biomaterials,2005,26:883-889.
[9] Howard MJ,Gershon MD.Developmentof LBP110 expression by neural crest-derived enteric precursors:migration and differentiation potential in ls/lsmutantmice[J].Neurobiol,1998,35:341-354.
[10]Chalazonitis A,Tennyson VM,Kibbey MC,et al.The alpha1 subunit of laminin-1 promotes the development of neurons by interacting with LBP110 expressed by neural crest-derived cells immunoselected from the fetal mouse gut[J].Neurobiol,1997,33:118-138.
[11]张伟,岳靓,等.自组装多肽纳米支架与骨髓间充质干细胞的生物相容性研究[J].中国矫形外科杂志,2011,19(22):1906-1909.
Biocompatibility of functionalized self-assembling peptide hydrogel with bone mesenchymal stem cells in vitro
Li Pengbin,Wang Kai,Che Biao,et al.Department of Orthopedics,the General Hospital of the Yangtze River, Shipping-Wuhan Brain Hospital,Wuhan Hubei,430019,China
Objective To Investigate the potential and differentiation of bone marrow stromal cells which in functional self-assembling peptide hydrogel.Methods The functionalized self-assembling peptide was made by mixing the self-assembling peptide RADA16 and peptide RADA16-IKVAV which was synthesized by the Shanghai Jier Biological Technology Company.The morphological features of the functionalized self-assembling peptide were studied by atom force microscope(AFM).In vitro isolation,amplification,purification rat BMSCs,And separated and identified by flow cytometry for the cell surface markers.BMSCs were seeded on the surface of both the functionalized self-assembling peptide hydrogel(experimental group)and RADA16 self-assembling peptide hydrogel(control group).The cell migration was detected by laser scan confocal microscope(LSCM).Immunofluorescence staining with Nestin,MAP2,and GFAPwas used to assess the differentiation of BMSCs.Results AFM showed that the functionalized self-assembling peptide hydrogel was made up of nanofibers with diameter of 7.0 to 8.0 nm.The surface markers of CD90,CD44,CD34 and CD45 on MSCs were93.71%,92.5%,1.1%and 2.18%respectively.The power of cell proliferation and migration in experimental group was significantly higher than that of control group (<0.05).Compared with control group,the percentage of MAP2 positive cells increased significantly(<0.05)and the percentage of GFAP positive cells decreased significantly (<0.05)in experimental group.Conclusion The functionalized self-assembling peptide hydrogel has good biocompatibility with NSCs,suggesting that it may be a promising biomaterial for neural tissue engineering.
Hydrogel;bone mesenchymal stem cells;Biocompatibility;Biomaterial
R651
A
李鹏斌(1981-)男,硕士,主治医师。研究方向:脊柱脊髓损伤。
*[通讯作者]王凯(1960-)男,硕士,主任医师。工作方向:生物骨科材料,创伤。
2014-09-21)
10.3969/j.issn.1672-5972.2015.02.002
swgk2014-09-0169
交通运输部长江航务管理局科技项目基金号:201210010
长江航运总医院,湖北武汉430060

