5 V正极材料LiMg Ni0.5-Mn1.5O4的电化学性能研究
朱振华,胡航,殷康健,郑圣泉,陈红雨,3
(1.华南师范大学化学与环境学院,广东广州510006;2.株洲泰和高科技有限公司,湖南株洲412000;3.广东高校储能与动力电池产学研结合示范基地,广东广州510006)
5 V正极材料LiMg Ni0.5-Mn1.5O4的电化学性能研究
朱振华1,胡航1,殷康健1,郑圣泉2,陈红雨1,3
(1.华南师范大学化学与环境学院,广东广州510006;2.株洲泰和高科技有限公司,湖南株洲412000;3.广东高校储能与动力电池产学研结合示范基地,广东广州510006)
通过Sol-Gel法,采用马来酸作为络合剂合成了正极材料LiMgxNi0.5-Mn1.5O4(=0、0.025、0.05和0.1),对产物进行了X射线衍射(XRD)、扫描电镜(SEM)表征和电化学性能测试,结果表明产物均为Fd3m型尖晶石结构,掺杂一定量Mg2+的LiNi0.5Mn1.5O4并未改变原有的结构;掺杂后的产物形貌和粒径发生了明显的变化;在1下循环50次后,掺杂Mg2+的样品的循环性能和容量保持率比未掺杂之前的好;Mg2+的掺入并未影响LiNi0.5Mn1.5O4的电化学反应过程。
Sol-Gel法;Mg2+;循环性能;容量保持率
LiMn2O4作为锂离子电池正极材料,其理论比容量高达148 mAh/g,尖晶石型LiMn2O4资源丰富,价格便宜,对环境污染小,已经成为锂离子电池正极材料研究热点之一[1]。但是在充放电过程中,材料存在姜-泰勒效应,电解液在高电压下分解,导致材料的比容量衰减。通过对锰酸锂掺杂镍元素,能大大改善材料性能,其中LiNi0.5Mn1.5O4的放电平台高达4.7 V,实际放电比容量可以达到140 Ah/g左右,且具有稳定的循环性能,使该材料与常规正极材料有了一定的竞争优势[2]。
目前,制备这种高压锂离子电池正极材料的主要方法有固相法、共沉淀法和溶胶-凝胶法[3]等。其中固相法混料不均匀,耗能大,最容易出现杂相;共沉淀法需要通过间接法制备目标产物;相对于其他的方法,溶胶-凝胶法更能实现各元素在原子水平上的均匀混合,制备出高性能的材料。
本文采用Sol-Gel法制备了5 V LiMg Ni0.5-Mn1.5O4材料,探讨了制备工艺对材料性能的影响,对终产物的晶体结构和形貌进行了X射线衍射(XRD)、扫描电镜(SEM)表征,并将其组装成扣式电池进行了电化学性能测试。
1 实验
1.1 正极材料LiMg Ni0.5-Mn1.5O4(=0,0.025,0.05,0.1)的制备
将化学计量比为1.05∶∶(0.5-)∶1.5的醋酸锂、醋酸镁、醋酸镍、醋酸锰混合物与一定量的顺丁烯二酸分别溶解在去离子水中,得到混合溶液和络合剂溶液。将混合物溶液和络合剂溶液同时加入60℃水浴中不断搅拌,同时用氨水调节pH=6.5~7.5,一直搅拌直至得到凝胶状物质后停止反应。将得到的凝胶置于90℃的真空干燥箱中干燥12 h,得到干凝胶。将干凝胶置于450℃下预烧4 h,取出研磨至粉末。再次将预烧产物置于900℃下煅烧5 h之后,退火至600℃并维持8 h,自然冷却至室温取出。按掺杂量将样品分别命名为TH-1、TH-2、TH-3和TH-4。
1.2 纽扣电池制作
组装CR2025型扣式电池对材料的电化学性能进行测试。以N-甲基吡咯烷酮作为分散剂,正极材料、乙炔黑、聚偏氟乙烯按照8∶1∶1(质量比)混合,调制成浆状涂覆在铝箔上,干燥后裁片。以锂片作为负极,隔膜为Celgard 2350,电解液为1 mol/L LiPF6/(EC+DMC)(体积比为1∶1)。整个操作过程在手套箱中进行,氧气和水分含量都控制在10-6以下,组装成CR2025型的扣式电池。在室温下以1(140 mA/g)的充放电倍率对纽扣电池进行恒流充放电测试,充放电截止电压范围3.5~4.9 V。用CHI660A型电化学工作站进行循环伏安(CV)测试,循环伏安扫描速度为0.2 mV/s,扫描范围为3.0~4.95 V。
1.3 样品的结构和形貌表征
采用X射线衍射仪对合成样品进行结构分析,Cu Kα线,管电压40 kV,管电流40 mA,波长为0.154 06 nm,X射线粉末衍射的步长为0.02°,扫描速度为8(°)/min,扫描范围为2θ=10°~80°。用场发射扫描电子显微镜观察材料形貌特征。
2 结果与讨论
2.1 XRD分析
图1是LiMg Ni0.5-Mn1.5O4在不同掺Mg2+量样品的XRD谱图。
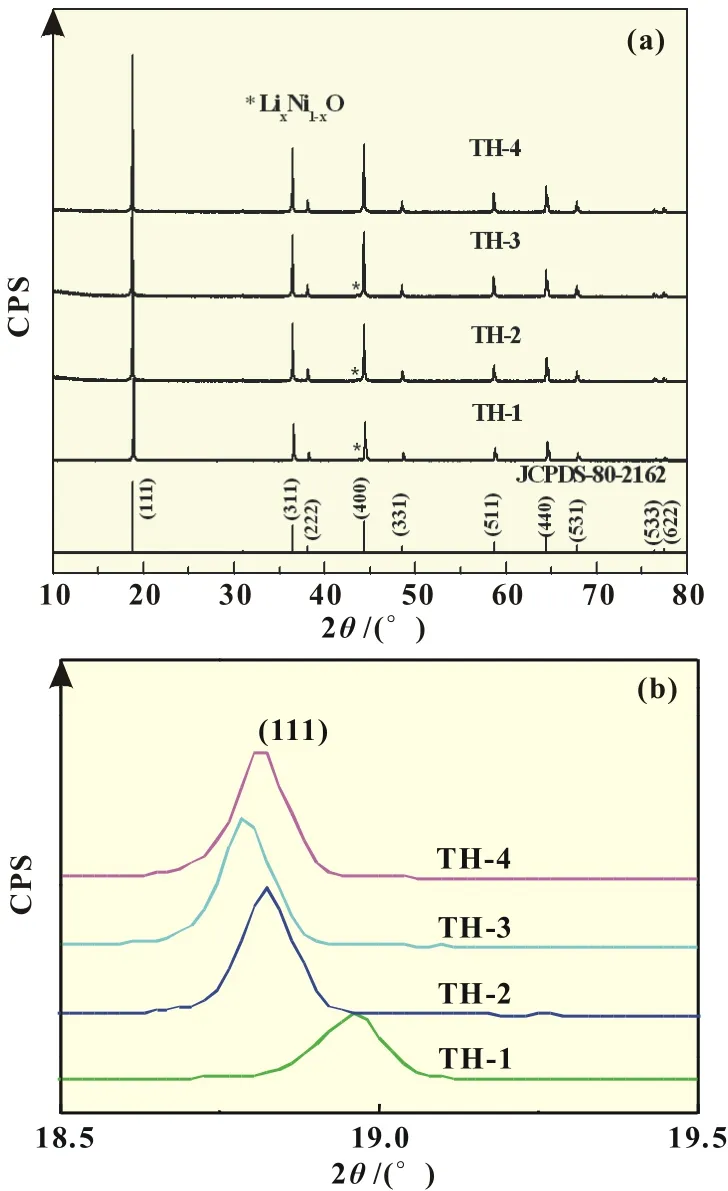
图1 不同掺Mg2+量样品的XRD图
从图1所示的XRD结果可以看出:所有样品各个衍射峰位置与LiNi0.5Mn1.5O4的JCPDS卡片(No.80-2162)标准值吻合较好,均为Fd3m型尖晶石结构,没有出现明显的晶态杂质峰;在2θ=30°的附近没有出现明显的(220)衍射峰,说明样品中的Mn和Ni没有进入Li的位置[2]。根据图1(b)所示的(111)峰放大图可知,掺杂后样品的(111)峰均向2θ减小的方向发生偏移,衍射峰强度增强且逐渐变窄,这可能是由于Mg2+(半径为0.072 nm)取代部分Ni2+(半径为0.069 nm)后使得LiNi0.5Mn1.5O4晶格发生微小扩张所致。
由图1也可以看出:掺杂微量的Mg2+的样品保持了Li-Ni0.5Mn1.5O4原有的尖晶石型结构,掺杂后的样品的衍射峰均比TH-1强,说明掺杂之后样品的结晶度均提高。原因可能是掺杂Mg2+后降低了Mn3+在结构中的含量,使Mn离子所带的正电荷增加,降低了材料中Li+和Mn3+的混乱度,使体系的能量降低[4]。
2.2 样品的形貌分析
材料的晶体结构对锂离子电池的电化学性能有着至关重要的作用,活性物质的粒子形貌、颗粒大小和尺寸分布也是影响材料电化学性能的关键因素[5]。图2是四种样品在10 000倍下的SEM图,从图中可以看出:颗粒之间有不同程度的团聚现象,TH-1的粒径为100~400 nm,TH-2、TH-3和TH-4的粒径均为1~3μm。掺杂Mg2+后,一次颗粒尺寸明显增大,表面变得更光滑,结晶度明显提高,这是由于Mg的掺杂提高了产物结晶度,这与XRD结果相一致。

图2 不同掺Mg2+量样品的SEM图
2.3 电化学性能分析
图3是四种产物在1下不同次数的恒流放电曲线。从图3和表1中可以看出TH-1、TH-2、TH-3和TH-4首次循环的放电比容量分别为128.4、113.0、88.8和77.9 mAh/g;在第50次循环时,TH-1、TH-2、TH-3和TH-4的放电比容量分别为126.1、114.0、97.4和84.5 mAh/g,其容量保持率分别为98.2%、100.9%、109.7%和108.5%。图4是四种产物在1下50次循环的性能曲线。从图4和表1中可以看出,掺杂Mg2+之后样品的初始放电比容量均低于TH-1,这是由于Mg掺杂会取代部分的活性物质Ni,从而降低产物的容量[6]。循环50次之后TH-2、TH-3和TH-4的循环稳定性好,无衰减,容量保持率均高达100%以上。而TH-1虽然有着较高的初始放电比容量,但循环50次之后容量有所衰减,容量保持率仅为98.2%,远远低于掺杂之后的产物的容量保持率,这可能与产物的颗粒大小、形貌和结晶度有关[5,7]。这也说明Mg的掺杂不仅提高了产物的结晶度和颗粒光滑度,也在一定程度上提高了产物的循环性能和容量保持率。
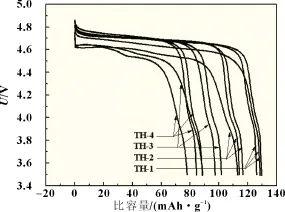
图3 不同循环次数的恒流放电曲线
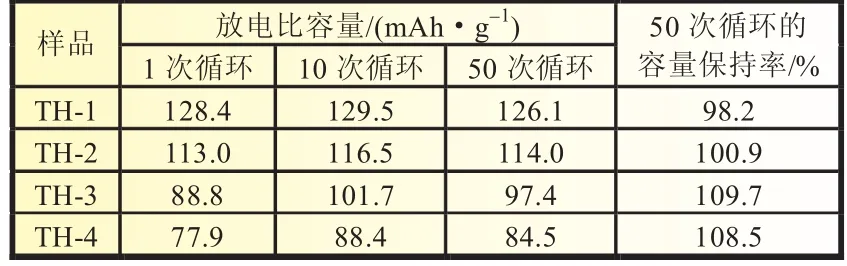
表1 不同掺Mg2+量样品1、10和50次循环的放电比容量和50次循环后的容量保持率
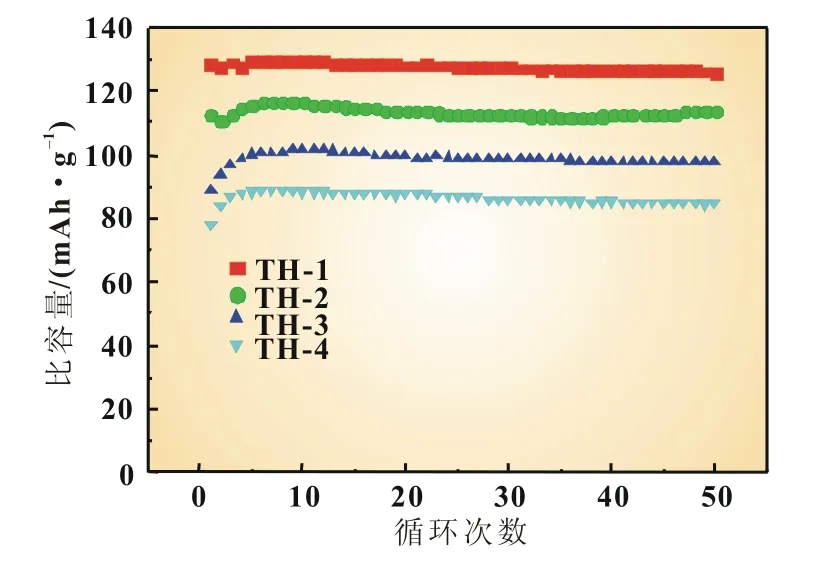
图4 50次循环的恒流放电曲线
图5 是四种样品在0.2 mV/s扫速下的首次CV曲线。从图5中可知,每个样品的循环伏安曲线中均存在3对明显的氧化还原峰,峰型尖锐,分别对应着4.0 V附近的Mn4+/Mn3+氧化还原反应和4.7 V附近的Ni2+/Ni3+和Ni3+/Ni4+氧化还原反应[3]。随着掺Mg2+量的增加,产物在4.7 V平台的氧化峰逐渐向更高的电压平台移动,这表明随着掺Mg2+量的增加,需要更高的电压才能使Li+从基体中脱出[8]。此外,并没有观察到其他杂峰的存在,说明Mg2+的掺入并没有影响LiNi0.5Mn1.5O4的电化学反应过程。
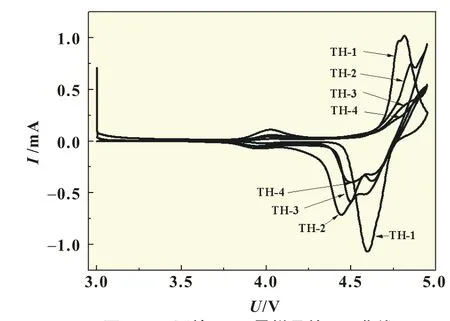
图5 不同掺Mg2+量样品的CV曲线
3 结论
在较低的温度下,采用顺丁烯二酸作为络合剂合成了锂离子电池正极材料LiMg Ni0.5-Mn1.5O4(=0、0.025、0.05和0.1)材料,Mg元素的掺入有利于结晶度提高,但并没有改变LiNi0.5-Mn1.5O4原有的尖晶石结构;掺杂Mg的产物的粒径明显增大,表面变得更光滑;恒流充放电测试结果表明,虽然未掺杂的LiNi0.5Mn1.5O4的比容量比掺杂之后的产物高,但是随着循环的进行,掺杂之后的产物具有更好的循环性能和容量保持率;CV测试表明Mg2+的掺入并没有影响LiNi0.5Mn1.5O4的电化学反应过程。
[1]WHITTINGHAM M S.Lithium batteries and cathode materials[J]. Chem Rev,2004,104:4271-4301.
[2]AKLALOUCHA M,AMARILLA J M,ROJAS R M,et al.Chromium doping as a new approach to improve the cycling performance at high temperature of 5 V LiNi0.5Mn1.5O4-based positive electrode[J].J Power Sources,2008,185:501-511.
[3]YANG T Y,ZHANG N Q.Enhanced rate performance of carboncoated LiNi0.5Mn1.5O4cathode material for lithium ion batteries[J]. Electrochim Acta,2011,56(11):4058-4064.
[4]LAFONT U,LOCATI C,BORGHOLS W J H,et al.Nanosized high voltage cathode material LiMg0.05Ni0.45Mn1.5O4:structural,electrochemical and in situ investigation[J].J Power Sources,2009,189 (1):179-184.
[5]SHIN Y,MANTHIRAM A.Origin of the high voltage(>4.5 V)capacity of spinel lithium manganese oxides[J].Electrochim Acta, 2003,48(24):3583-3592.
[6]OOMS F G B,KELDER E M,SCHOONMAN J,et al.High-voltage LiMgδNi0.5–δMn1.5O4spinels for Li-ion batteries[J].Solid State Ionics, 2002,152/153:143-153.
[7]AMDOUNI N,ZAGHIB K,GENDRON F,et al.Structure and insertion properties of disordered and ordered LiNi0.5Mn1.5O4spinels prepared by wet chemistry[J].Ionics,2006,12:117-126.
[8]FEY G T K,LU C Z,KUMAR T T P.Preparation and electrochemical properties of high-voltage cathode materials,LiM Ni0.5-Mn1.5O4(M=Fe,Cu,Al)[J].J Power Sources,2003,115(2):332-345.
Study on electrochemical performance of 5 V cathode materials LiMg Ni0.5-Mn1.5O4
ZHU Zhen-hua1,HU Hang1,YIN Kang-jian1,ZHENG Sheng-quan2,CHEN Hong-yu1,3
5 V LiNi0.5Mn1.5O4spinel cathode materials were successfully synthesized by a maleic acid-assisted sol-gel reaction.The structure,morphology and electrochemical properties of the materials were examined by X-ray diffraction,scanning electron microscopy and electrochemical tests.The results show that the as-synthesized LiNi0.5Mn1.5O4are crystallized in spinel structure with Fd3m space group.Doping with certain amount of Mg2+did not change the basic structure of LiNi0.5Mn1.5O4but greatly affected its mophology and particle size.At the chargedischarge rate of 1,the electrochemical performance of Mg-doped LiNi0.5Mn1.5O4showed better cyclic performance and higher capacity retention rate than the pure LiNi0.5Mn1.5O4after 50 cycles.Doping with Mg2+also did not affect the electrochemical reaction process of LiNi0.5Mn1.5O4.
Sol-Gel method;Mg2+;cyclic performance;capacity retention rate
TM 912
A
1002-087 X(2015)03-0469-03

2014-08-12
朱振华(1986—),男,湖南省人,硕士,主要研究方向为高压和三元材料。
陈红雨,教授,E-mail:battery@scnu.edu.cn

