香稻不育系ISSR正交体系优化及验证
徐君+刘凤军+张国芹+徐瑶+谢裕林+陈培峰+王建平+乔中英+黄萌+朱勇良

摘要:利用正交试验设计,从Taq酶、Mg2+、模板DNA、dNTP、引物5种因素的4个水平对香稻不育系的ISSR-PCR反应体系进行优化,确立适合香稻的ISSR-PCR反应体系:1.0 U Taq酶、2.5 mmol/L Mg2+、40 ng模板DNA、0.25 mmol/L dNTP、0.1 μmol/L引物浓度。进一步验证试验表明,在该体系下将筛选的13个ISSR引物对15个香稻不育系进行PCR扩增,均可获得稳定、清晰的条带。
关键词:香稻;ISSR-PCR;正交优化
中图分类号: S511.03 文献标志码: A
文章编号:1002-1302(2015)04-0021-03
收稿日期:2014-05-28
基金项目:江苏省自然科学基金(编号:BK2010207);江苏省苏州市应用基础项目(编号:YJG0902)。
作者简介:徐 君(1982—),男,江苏苏州人,硕士,助理研究员,研究方向为植物细胞工程。Tel:(0512)65386213;E-mail:flyforever007@163.com。
通信作者:朱勇良,副研究员,研究方向为水稻遗传育种和生态安全标准化栽培。Tel:(0512)65386213;E-mail:thszyl@126.com。
ISSR(inter-simple sequence repeats)标记技术,是基于PCR(polymerase chain reaction)技术的DNA分子标记技术,采用17~22碱基的重复锚定引物扩增重复序列之间的片段,具有重复性较好、稳定程度高、多态性丰富等优点,已被广泛应用于品种鉴定、遗传多样性分析、遗传作图等研究[1]。利用ISSR标记对水稻进行遗传分析及分类研究已有不少报道,如研究栽培稻与野生稻的亲缘关系[2]、分析中国疣粒野生稻的遗传多样性[3]、对水稻光温敏核不育系进行分子鉴定和遗传分析[4]等。
江苏太湖地区农业科学研究所从事水稻育种和相关工作已有多年,在太湖地区稻资源的收集、保存、种质鉴定及品质改良方面进行了较多的研究和摸索工作,目前收集有各类水稻资源超过2 000份。对资源的鉴定是资源利用的基础,对所收集水稻资源的遗传多样性进行客观评价,可以为遗传多样性的保护、品种鉴定及提高育种效率提供科学依据[5]。水稻的分子标记,现阶段以SSR(simple sequence repeats)标记为主[6-7],但是关于更为经济、简便的ISSR报道相对较少。稳定的扩增体系是ISSR结果应用于遗传分析的前提[8],由于ISSR-PCR反应条件易受多种因素干扰,简单的单因素不能满足体系建立要求。本研究采用正交试验设计,从Taq酶、Mg2+、模板DNA、dNTP、引物5种因素的4个水平出发,对香稻不育系ISSR反应体系进行优化分析,以期为今后进一步将该技术应用于水稻育种辅助工作奠定基础。
1 材料与方法
1.1 材料
试验材料是选自江苏太湖地区农业科学研究所近期选育和引进的有代表性的15个香稻不育系材料:苏香粳1号A、太湖粳6号A、吴江3号A、9703A、软玉A、苏04-799A、95122A、06A、运糯6028A、扬粳9538A、皖稻68A、苏香粳1号A(红莲型)、吴江3号A(红莲型)、太湖粳6号A(红莲型)、9703A(红莲型)。
试验所采购的所有试剂包括:DNA Marker、PCR试剂盒、电泳相关试剂,全部购自生工生物工程(上海)股份有限公司。
本试验所用ISSR引物是参照加拿大哥伦比亚大学(UBC)所设计的引物序列,并由生工生物工程(上海)股份有限公司合成。
1.2 试验方法
1.2.1 水稻基因组DNA提取 取0.1 g左右水稻的叶片,直接放入离心管中,置于-70 ℃备用。
基因组DNA的提取采用改良的CTAB法[9],用1%琼脂糖凝胶电泳初步检测DNA质量,并通过紫外-可见分光光度计测定D260 nm、D280 nm,检测DNA的质量和浓度。将提取原液放置于-20 ℃保存。用于PCR反应的DNA工作液进一步稀释至100n g/μL,备用。
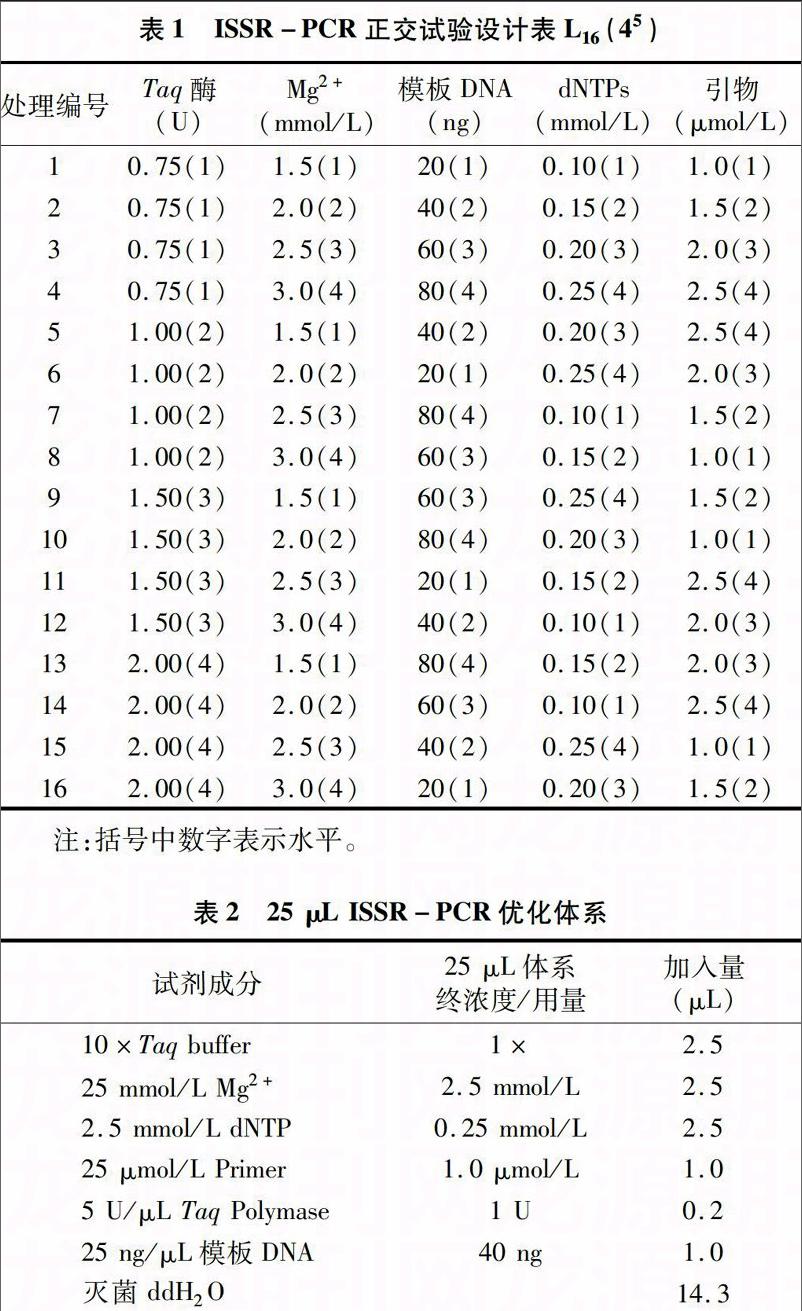
1.2.2 正交优化ISSR-PCR反应 采用L16(45)正交设计表,由Taq酶、Mg2+、模板DNA、dNTP、引物5种因素各4个水平组成,共计16个处理,正交试验设计见表1。以水稻不育系吴江3号A(红莲型)DNA为模板,用ISSR引物UBC835[5′-(AC)8YT-3′]进行试验。各处理总体积为25 μL,每个处理中均加入2.5 μL无Mg2+的10×Taq buffer,不足的体积用超纯水补足,详见表2。
PCR扩增的程序:94 ℃预变性5 min;94 ℃变性30 s,52 ℃退火45 s,72 ℃延伸1.5 min,35个循环;72 ℃延伸 5 min;4 ℃终止反应。
将PCR扩增产物用1%琼脂糖凝胶电泳分离,EB染色后于UV凝胶成像系统中观察结果。
1.2.3 ISSR引物及优化体系验证 根据钱韦等的报道[3-4],筛选13个ISSR引物,对15个香稻不育系进行扩增,验证所筛选引物对不育系的通用性及ISSR-PCR扩增体系的稳定性。
表1 ISSR-PCR正交试验设计表L16(45)
处理编号 Taq酶
(U) Mg2+
(mmol/L) 模板DNA
(ng) dNTPs
(mmol/L) 引物
(μmol/L)
1 0.75(1) 1.5(1) 20(1) 0.10(1) 1.0(1)
2 0.75(1) 2.0(2) 40(2) 0.15(2) 1.5(2)
3 0.75(1) 2.5(3) 60(3) 0.20(3) 2.0(3)
4 0.75(1) 3.0(4) 80(4) 0.25(4) 2.5(4)
5 1.00(2) 1.5(1) 40(2) 0.20(3) 2.5(4)
6 1.00(2) 2.0(2) 20(1) 0.25(4) 2.0(3)
7 1.00(2) 2.5(3) 80(4) 0.10(1) 1.5(2)
8 1.00(2) 3.0(4) 60(3) 0.15(2) 1.0(1)
9 1.50(3) 1.5(1) 60(3) 0.25(4) 1.5(2)
10 1.50(3) 2.0(2) 80(4) 0.20(3) 1.0(1)
11 1.50(3) 2.5(3) 20(1) 0.15(2) 2.5(4)
12 1.50(3) 3.0(4) 40(2) 0.10(1) 2.0(3)
13 2.00(4) 1.5(1) 80(4) 0.15(2) 2.0(3)
14 2.00(4) 2.0(2) 60(3) 0.10(1) 2.5(4)
15 2.00(4) 2.5(3) 40(2) 0.25(4) 1.0(1)
16 2.00(4) 3.0(4) 20(1) 0.20(3) 1.5(2)
注:括号中数字表示水平。
表2 25 μL ISSR-PCR优化体系
试剂成分 25 μL体系
终浓度/用量 加入量
(μL)
10×Taq buffer 1× 2.5
25 mmol/L Mg2+ 2.5 mmol/L 2.5
2.5 mmol/L dNTP 0.25 mmol/L 2.5
25 μmol/L Primer 1.0 μmol/L 1.0
5 U/μL Taq Polymase 1 U 0.2
25 ng/μL模板DNA 40 ng 1.0
灭菌 ddH2O 14.3
2 结果与分析
2.1 基因组DNA提取与检测
检测同一批提取的DNA样品结果表明,主带明亮,略有拖尾现象。说明CTAB法快速提取DNA效果良好,但存在DNA降解现象;后续试验表明,该法提取基因组DNA可满足PCR试验需求。
2.2 正交优化ISSR-PCR反应
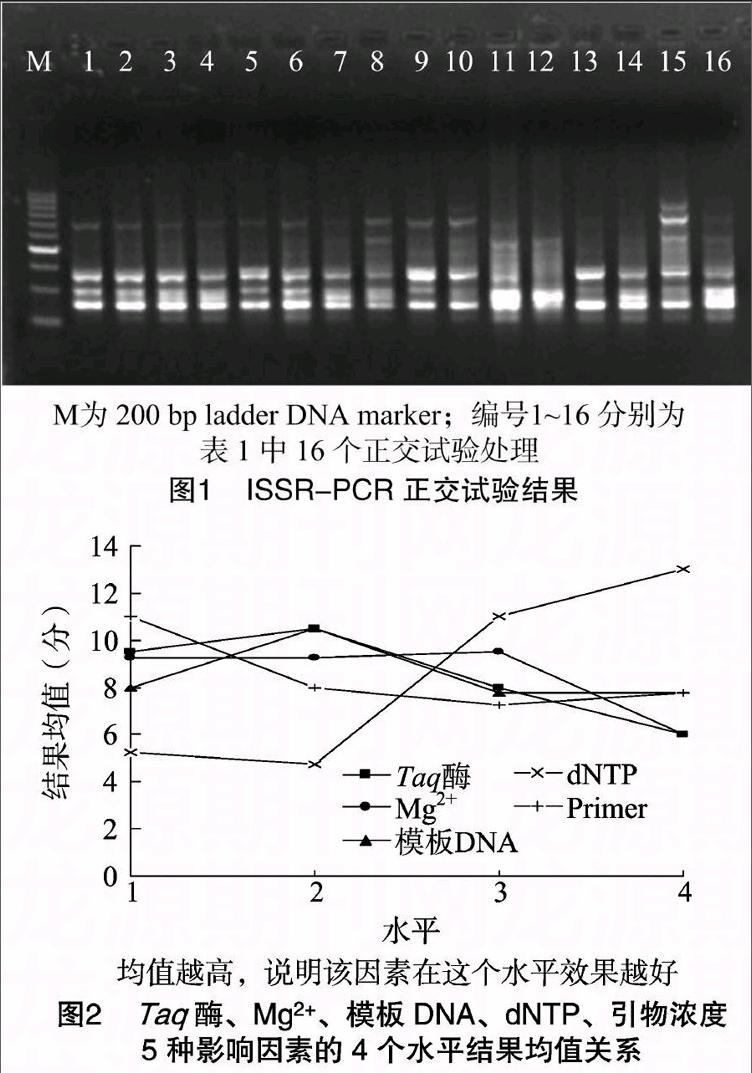
依据琼脂糖电泳条带的强弱和杂带的多少做直观分析。从图1可以看出,在16个处理组合中,由于Taq 酶、Mg2+、模板DNA、dNTP、引物浓度5种影响因素组合的不同,扩增效果存在着明显差异。按照扩增结果将16个处理从高到低依次打分,条带数量丰富、背景清晰的记为16分;与之相反,扩增结果最差的为1分。编号1-16的评分结果分别为9、8、11、10、15、14、7、6、12、13、4、3、1、2、16、5分。图2直观分析结果显示,Taq 酶、Mg2+、模板DNA、dNTP、引物浓度的最佳条件组合分别为1.0 U、2.5 mmol/L、40 ng、0.25 mmol/L、0.1 μmol/L。
2.3 ISSR引物的筛选及体系验证
以吴江3号A基因组DNA为模板,根据文献报道选择13个适用于水稻的ISSR引物(引物编号、序列见表3),利用这13个引物对供试的15个香稻不育系材料进行PCR 扩增,
结果如图3所示。可以看出,15份材料均可扩增出稳定、清晰的条带。试验共扩增出89条DNA条带,条带大小为 160~1 600 bp,其中引物UBC809扩增出的清晰条带最多,为12条;引物UBC807、UBC855、UBC888的扩增条带数最少,仅有5条。总体看出,13个引物共产生25条多态性带,引物扩增产物的多态性比率较低,仅为28.1%。
表3 所筛选的ISSR引物序列及扩增带数
引物编号 引物序列 扩增带数
(条)
UBC807 5′-(AG)8T-3′ 5
UBC808 5′-(AG)8C-3′ 7
UBC809 5′-(AG)8G-3′ 12
UBC811 5′-(GA)8C-3′ 8
UBC 835 5′-(AG)8YC-3′ 7
UBC 855 5′-(AC)8YT-3′ 5
UBC 857 5′-(AC)8YG-3′ 7
UBC 864 5′-(ATG)6-3′ 8
UBC 880 5′-GGAGAGGAGAGGAGA-3′ 7
UBC 888 5′-BDB(AC)7-3′ 5
UBC 889 5′-DBD(CA)7-3′ 6
UBC 890 5′-VHV(GT)7-3′ 6
UBC 891 5′-HVH(GT)7-3′ 6
注:Y=(C,T),B=(C,G,T),D=(A,G,T),H=(A,C,T),V=(A,C,G)。
3 结论与讨论
ISSR标记基于PCR技术,较RAPD、RFLP等第一代标记稳定,但也受多种因素影响,试验的可靠性和稳定性与PCR反应条件有很大关系[10]。本试验的目的在于建立1套成本低廉、操作简便、可靠性高、表达稳定的ISSR-PCR技术体系,
以期提供大量遗传信息,应用于香稻种质资源的鉴定。研究中发现,不同反应体系下ISSR-PCR反应结果可能出现不同(带型不同),该情况在李雪等的研究中也有出现[8,11],分析其原因,可能是由于部分处理的引物浓度或Taq酶浓度过高而引起非特异扩增。非特异带的形成对研究结果会造成根本性误差,因此建立稳定的ISSR-PCR反应体系并对体系进行验证就显得更为重要[10,12]。
本试验利用正交设计优化,确定适用于香稻ISSR-PCR的体系为:1.0 U Taq酶,2.5 mmol/L Mg2+,40 ng模板DNA,0.25 mmol/L dNTP,引浓度0.1 μmol/L。在该体系下将所筛选13个ISSR-PCR引物对15个不育系材料进行验证扩增,结果表明,该体系广泛适用于各材料及所筛选的引物,且表达稳定、条带清晰。一般而言,13个ISSR引物扩增所获得的信息足以进行相关遗传分析,但笔者在试验中发现,所筛选的13个引物虽然扩增出较多数目的分子标记(89个),但标记总体多态性较低,仅为28.1%,分析原因可能是由于香稻不育系之间来源类似、亲缘关系较近。本试验结果如果要分析香稻不育系间的遗传关系,多态性标记数目显得不足。可在本试验基础上对香稻进行遗传分析,进一步筛选适宜的ISSR引物以获得更多的多态性标记,或采用分子标记结合表型标记的方法,以获得理想的结果。
参考文献:
[1]方宣钧,吴为人,唐纪良. 作物DNA标记辅助育种[M]. 北京:科学出版社,2001.
[2]何予卿,张 宇,孙 梅,等. 利用ISSR分子标记研究栽培稻和野生稻亲缘关系[J]. 农业生物技术学报,2001,9(2):123-127.
[3]钱 韦,葛 颂,洪德元. 采用RAPD和ISSR标记探讨中国疣粒野生稻的遗传多样性[J]. 植物学报,2000,42(7):741-750.
[4]李进波,牟同敏,方宣钧.12个水稻光温敏核不育系的ISSR标记鉴定及遗传分析[J]. 中国农学通报,2002,18(1):6-9.
[5]朱勇良,谢裕林,黄凌哲,等. 太湖稻区及国内部分香稻SSR指纹图谱构建及遗传多样性初析[J]. 植物遗传资源学报,2012,13(4):666-671.
[6]陈兆贵,邓汉超,赵淑平. 47份水稻品种资源的ISSR遗传多样性分析[J]. 基因组学与应用生物学,2009,28(3):498-502.
[7]李进波,牟同敏,夏建武,等. 利用微卫星标记鉴定两系杂交稻两优培胜的种子纯度[J]. 中国农学通报,2002,18(6):10-13.
[8]李 雪,韩 曙,杨正安,等. 大蒜ISSR-PCR反应体系的正交优化建立[J]. 中国农学通报,2013,29(10):126-131.
[9]Doyle J J. A rapid DNA isolation procedure for small quantities of fresh leaf tissue[J]. Phytochemical Bulletin,1987,9(1):11-15.
[10]孙清信,陈 坚,张 辉,等. 紫云英ISSR引物的筛选及PCR反应体系的优化[J]. 植物遗传资源学报,2012,13(5):870-878.
[11]王彦华,侯喜林,徐明宇. 正交设计优化不结球白菜ISSR反应体系研究[J]. 西北植物学报,2004,24(5):899-902.
[12]杨金花,秦瑞云,付庆云,等.菠菜ISSR-PCR体系的建立与优化[J].江苏农业科学,2013,41(2):36-38.

