外源水杨酸对棉花相关抗虫酶活性诱导的时间和浓度效应
王燕芳+吴瑛


摘要:采用喷雾方法,初步探讨外源水杨酸对棉叶总酚和抗虫酶活性的诱导作用,结果表明,在适度浓度和时间范围内,水杨酸(SA)能明显诱导棉叶中总酚含量、苯丙氨酸解氨酶(PAL)、多酚氧化酶(PPO)活性和胰蛋白酶抑制力(TI) 活性的增加;5 mmol/L 水杨酸处理后4 d对棉叶总酚含量、PAL活性和胰蛋白酶抑制力的诱导作用最为显著,水杨酸5 mmol/L处理后2 d和0.5 mmol/L 处理后4 d对棉叶PPO活性的诱导效果最优;随着水杨酸处理时间的延长,水杨酸诱导棉叶总酚含量和抗虫酶(PAL、PPO、TI)活性具有先升高后降低随后又升高的特点。这说明外源水杨酸能在一定程度上提高棉花抗虫相关的物质和酶活性以达到抗虫目的。
关键词:水杨酸;棉花;总酚;抗虫酶;总酚含量;苯丙氨酸解氨酶;多酚氧化酶
中图分类号: S562.01 文献标志码: A
文章编号:1002-1302(2015)04-0138-03
收稿日期:2014-09-25
基金项目:国家自然科学基金(编号:20867005)。
作者简介:王燕芳(1989—),女,山西忻州人,硕士,从事外源激素对棉花病虫害防治研究。E-mail:819710681@qq.com。
通信作者:吴 瑛,教授,从事化学教学与研究。E-mail:wuyingjuyuan@163.com。
水杨酸(SA)作为植物的一种重要信号分子,能激活植物超敏反应,诱导病程相关蛋白基因(PR)的表达,使植物产生系统性防御,增强其抗病能力。有研究表明,水杨酸在诱导抗虫方面也有重要作用[1-2],如杨扇舟蛾取食受水杨酸甲酯(MeSA)熏蒸后的黑杨叶片后,成虫对食物的消化吸收降低、发育历程延长、死亡率增加[3];利马豆遭二斑叶螨取食后,会释放一种含有MeSA的挥发物以吸引二斑叶螨的天敌智利捕食螨,从而起到间接抗虫作用[4]。 植物体内次生代谢产物含量和防御酶活性的变化是植物抗虫过程中的重要表现,具有重要的防卫功能[5]。目前,关于棉花在外源水杨酸诱导作用下的相关抗虫生理生化防御研究比较少,本试验从植物生理生化防御角度出发,探讨外源水杨酸不同浓度和作用时间下棉花体内相关抗虫酚类次生代谢产物和蛋白酶活性的变化,以明确外源水杨酸对棉花的抗虫诱导作用机制,为水杨酸在棉花生产上的科学利用提供理论依据。
1 材料与方法
1.1 材料与处理
试供棉花种子中棉40,由新疆维吾尔自治区阿拉尔市农业科学研究所提供。将大小均匀且饱满的种子撒播于10 cm×15 cm的塑料花盆中,每盆播种10粒,放置于重点实验室组培室中培养,试验用土为黄壤、蛭石、草木灰,按照 2 ∶ 2 ∶ 1 配比,经高温灭菌、晾晒。棉花生育期确保有适宜的湿度和温度、无病虫害,光照时间为18 h/d。棉花1~2片真叶期间苗,留苗4株/盆;待长至4~5片真叶期,叶面喷施含有1% Tween20和6%乙醇的不同浓度水杨酸,分别为0.05、0.5、5 mmol/L,以含1%Tween20、6%乙醇的水溶液为对照(CK),直至水珠落下为准,透明塑料袋套袋,12 h后摘除;在喷施后0、2、4、6、8 d分别剪取真叶叶片,液氮封存,待测。每处理重复3次。
1.2 测定方法
酚酸含量的测定[6]:称取0.1 g鲜叶,加入3 mL 95%乙醇研磨成匀浆;加入5 mL乙醇润洗,定容至10 mL,2 500 r/min 离心5 min,取上清液得粗提液;移取1.25 mL粗提液到10 mL具塞试管中,加1 mL福尔马林试剂摇匀,静置4~5 min;加2 mL 10%Na2CO3,置75 ℃水浴锅中保温 10 min,分光光度计于765 nm处比色。
多酚氧化酶(PPO)活性的测定[7]:称取鲜叶0.1 g,加入含7% PVP、浓度为0.1 mmol/L、pH值为7.4的磷酸缓冲液2.5 mL,于冰浴中研磨成匀浆;4 ℃下 5 500 r/min离心10 min,上清液即为酶液;移取0.1 mmol/L邻苯二酚1.5 mL、酶液05 mL和磷酸缓冲液1 mL,420 nm处比色,测定2 min内吸光度的变化。
苯丙氨酸解氨酶(PAL)活性的测定[8]:称取0.1 g鲜叶,加2.5 mL预冷的0.05 mmol/L、pH值为7.8的 Tris-HCl缓冲液和0.02 g PVP,于冰浴中研磨;4 ℃下 5 500 r/min离心 10 min;取0.2 mL上清液于5 mL试管中,加入3.8 mL Tris-HCl缓冲液和1 mL 0.6 mmol/L苯丙氨酸,40 ℃水浴1 h;加 0.2 mL 6 mmol/L HCl终止反应,290 nm处测吸光度。
胰蛋白酶抑制力(TI)活性的测定[9]:称取0.1 g鲜叶,加2 mL Tris-HCl缓冲液,冰浴研磨成匀浆;4 ℃ 下5 000 r/min离心10 min;取0.1 mL上清液和0.02 mL胰蛋白酶抑制液混合,25 ℃水浴30 min;取0.1 mL水浴后的混合液与2.9 mL BAEE进行反应,256 nm处测定吸光度的变化。
1.3 数据处理
采用SPSS 20软件单因素多重比较法,分析水杨酸对棉叶相关抗虫酶活性诱导效应的差异性。
2 结果与分析
2.1 水杨酸对棉叶总酚含量的诱导效应
由图1可见,随着处理后时间的延长,棉叶总酚含量呈现上升趋势,处理后4 d时棉叶总酚含量达到最大值,显著高于对照,其中,5 mmol/L 水杨酸处理的棉叶总酚含量均显著高于其他浓度处理(P<0.05),是CK的1.55倍;处理后6 d,总酚含量降到最低,除5 mmol/L 水杨酸外,各浓度处理均低于对照;处理后8 d,棉叶总酚含量迅速回升,0.5 mmol/L和 5 mmol/L 水杨酸处理的棉叶总酚含量均显著高于CK。经单因素多重比较分析可得,除处理后0 d和2 d之间无显著性差异(P=0.087)外,处理后其他时间的总酚含量均差异显著;0.05 mmol/L 水杨酸与CK处理后的总酚含量无显著性差异(P=0763)。水杨酸能明显诱导棉叶总酚物质的产生,处理后4 d,5 mmol/L 水杨酸处理对棉叶总酚含量的诱导作用最大。endprint
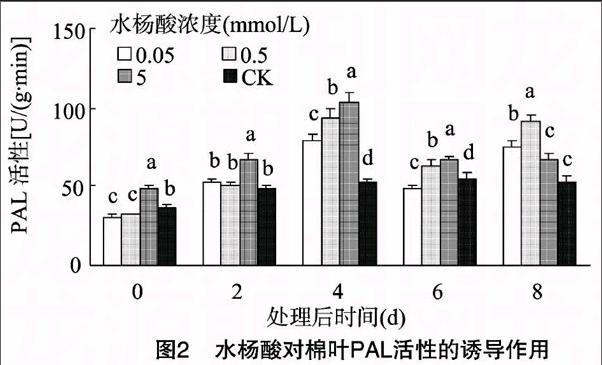
2.2 水杨酸对棉叶PAL活性的诱导效应
由图2可见,水杨酸处理后的棉叶,体内PAL活性在 0~4 d 内迅速增大,4~6 d骤降,6~8 d PAL活性又大幅回升;处理后4 d,随着水杨酸处理浓度的升高,棉叶PAL活性不断增大,且均显著高于CK(P<0.05),其中,5 mmol/L 水杨酸处理的棉叶PAL活性最大,是CK的2倍;水杨酸处理后6~8 d,0.5 mmol/L 处理的棉叶PAL活性迅速升高,8 d 时PAL活性最大,与其他处理均有显著性差异,较CK增加40.65%。经单因素多重比较分析可得,棉叶PAL活性的时序变化差异显著(P<005),各处理浓度间棉叶PAL活性差异显著,均高于CK。
2.3 水杨酸对棉叶PPO活性的诱导效应
由图3可见,不同浓度水杨酸处理的棉叶,体内PPO活性在0~4 d迅速升高,4~6 d活性骤降,而后稍有回升;处理后2 d,除0.05 mmol/L 水杨酸处理外,其他浓度处理均显著高于CK,其中5 mmol/L 水杨酸处理的棉叶PPO活性最大,是CK的1.63倍;处理后4 d,各处理棉叶PPO活性均显著高于CK,0.5 mmol/L 水杨酸处理的棉叶,其PPO活性显著高于其他浓度,0.05 mmol/L与5 mmol/L 水杨酸处理的棉叶PPO活性无显著差异(P>0.05);处理后6 d,棉叶体内PPO活性均明显低于CK;处理后8 d,0.5 mmol/L和5 mmol/L 水杨酸处理的棉叶体内PPO活性均显著高于CK。经单因素多重比较可得,水杨酸处理后2~4 d,棉叶PPO活性无显著性差异(P=0.087),处理后0 d和6 d,棉叶内PPO活性也无明显差异(P=0.163);0.05 mmol/L 水杨酸与CK处理对棉花PPO活性的诱导作用无明显差异(P=0.838)。5 mmol/L 水杨酸处理后2 d和0.5 mmol/L 水杨酸处理后4 d对棉叶PPO活性的诱导效果最为明显。
2.4 水杨酸对棉叶TI的诱导效应
由图4可见,不同浓度水杨酸处理后,棉叶中TI活性在 0~2 d 缓慢增加,均显著高于CK,但各浓度间对棉叶TI的诱导效果无明显差异;处理后4 d,各浓度处理对棉叶体内TI活性的诱导效应最为明显,其中,5 mmol/L 水杨酸处理对棉叶TI活性的诱导效果优于CK和其他浓度处理,但0.05 mmol/L和 0.5 mmol/L 水杨酸处理间无明显差异(P>0.05);处理后4~6 d,水杨酸对棉叶TI活性的诱导效应降低,除 0.05 mmol/L 外,其他浓度处理的棉叶TI浓度均显著高于CK;处理后8 d,水杨酸对棉叶TI活性的诱导效应有所回升,0.05、0.5 mmol/L 水杨酸处理对TI活性的诱导效果最为明显,5 mmol/L 水杨酸处理的棉叶体内TI活性与CK无显著差异。经单因素多重比较分析可得,处理后不同时间对棉叶体内TI活性的诱导效应差异显著,处理后4 d对TI的诱导效应最为明显;不同浓度的水杨酸处理,对棉叶TI活性的诱导效应明显高于CK,5、0.5 mmol/L 水杨酸处理对棉叶TI活性的诱导效果最为明显,且两者无显著差异(P=0.405)。
3 结论与讨论
Thulke等报道认为,水杨酸能激活植物局部几种防御反应,诱导植物体内苯酚类有毒物质的积累,而且还会诱导植物体内POD和甘露醇脱氢酶基因的表达[10]。周莹等研究结果表明,水杨酸在抵御生物胁迫过程中,会激发植物体内细胞壁的交联和木质化,PPO、PAL、POD等酶活性的表达[11]。另有研究表明,外源水杨酸会明显提高拟南芥叶片POD和PAL活性,同时也能诱导番茄幼苗叶片中PPO活性的升高[12-13]。本试验结果表明,棉花经水杨酸处理后,在一定作用时间和浓度范围内,会明显诱导棉叶中总酚含量、PAL活性、PPO活性和TI活性的增加,这与前人研究结论[10-13]吻合。
随着水杨酸处理时间的延长,棉叶中总酚含量、防御酶活性(PAL、PPO)和TI活性具有先升高后降低随后又有所回升的特点;高浓度水杨酸处理对棉叶防御功能的诱导效果优于低浓度,总体表现为5 mmol/L水杨酸处理的棉叶,4 d后对棉叶次生代谢、防御酶活性和蛋白酶抑制剂活性的诱导效果最好,这与张永军等的研究结果[14]类似,这可能与植物在防御过程中的“阈值”有关。可见,外源水杨酸适宜的浓度和处理时间,能明显提高棉叶防御物质的含量和防御酶活性。
参考文献:
[1]龙亚芹,王万东,王美存,等. 水杨酸(SA)诱导植物对病虫害产生抗性及作用机制研究[J]. 热带农业科学,2009,29(12):46-50.
[2]苗 进,李国平,韩宝瑜. 水杨酸和水杨酸甲酯在植物抗虫中的作用及机制研究进展[J]. 热带作物学报,2007,28(1):111-114.
[3]赵 玲,胡增辉,赵风君,等. 水杨酸甲酯诱抗黑杨对杨扇舟蛾生长发育的影响[J]. 北京林业大学学报,2005,27(1):75-78.
[4]Hountondji F C,Hanna R,Sabelis M W. Does methyl salicylate,a component of herbivore-induced plant odour,promote sporulation of the mite-pathogenic fungus neozygites tanajoae? [J]. Experimental &Applied Acarology,2006,39(1):63-74.
[5]杨 帆. 水杨酸、茉莉酸甲酯诱导黄瓜对西花蓟马(缨翅目:蓟马科)的抗性[D]. 武汉:华中农业大学,2009.
[6]王华磊,冯建荣,樊新民,等. 新疆17个杏品种的抗氧化指标与总酚含量的测定[J]. 果树学报,2008,25(6):828-831.
[7]章金明. MeSA、叶蝉为害和机械刺伤对茶芽挥发物及PAL、PPO酶活性影响[D]. 北京:中国农业科学院,2006.
[8]张晓玉,张温典,田 兰,等. 不同毒性玉米大斑病菌侵染对感病玉米叶片PAL活性的影响[J]. 玉米科学,2014,22(1):154-158.
[9]张 健,严善春,王 琪. 落叶松结实量对其防御酶和蛋白酶抑制剂活力的影响[J]. 林业科学,2009,45(8):96-100.
[10]Thulke O,Conrath U. Salicylic acid has a dual role in the activation of defence-related genes in parsley[J]. The Journal of Plant,1998,14(1):35-42.
[11]周 莹,寿森炎,贾承国,等. 水杨酸信号转导及其在植物抵御生物胁迫中的作用[J]. 自然科学进展,2007,17(3):305-312.
[12]王 媛,杨红玉,程在全.水杨酸诱导拟南芥对灰霉病的抗性与木质素含量的关系[J]. 植物保护,2007,33(4):50-54.
[13]胡彦江,张茹琴,王瑞荣,等. 水杨酸、乙酰水杨酸对番茄幼苗叶片中PPO和POD的诱导作用[J]. 西北植物学报,2007,27(2):262-266.
[14]张永军,郭予元,吴孔明,等. 化学调节剂诱导转Bt基因棉花杀虫蛋白和主要抗虫次生物的变化[J]. 棉花学报,2002,14(3):131-133.endprint

