金黄色葡萄球菌生物被膜形成与生物被膜相关基因的调查研究
贺建忠+陈宏伟+王贵强+王永+白万胜+郭新怀+王勇


摘要:以分离自全国9个省(市、区)的102株奶牛乳房炎源性金黄色葡萄球菌为研究对象,应用刚果红法(congo red agar,CRA)和半定量黏附试验(semi quantitative adherence assay,SQAA)检测了生物被膜形成情况,应用PCR法检测了8种生物被膜相关基因分布情况。结果发现,携带7种基因的菌株占有绝对优势,其次是携带6种基因的菌株;最流行的基因组合是SigB-icaR-icaA-icaD-sarA-rbf-SasG,比例高达66.7%;北京、内蒙古、宁夏、甘肃、广西、上海等地生物被膜形成与生物被膜相关基因的分布高度一致。以上研究结果表明,多种生物被膜相关基因组合是奶牛乳房炎源性金黄色葡萄球菌流行的主要特点,生物被膜形成和生物被膜相关基因的分布在大多数地区表现高度一致性,rbf和SigB基因可能在金黄色葡萄球菌生物被膜形成和乳房感染过程中发挥着重要作用。本研究结果将为金黄色葡萄球菌性乳房炎的防治提供一定的科学参考。
关键词:金黄色葡萄球菌;生物被膜;奶牛乳房炎;生物被膜相关基因
中图分类号: S852.61+1 文献标志码: A
文章编号:1002-1302(2015)04-0055-04
收稿日期:2014-04-15
基金项目:国家自然科学基金地区基金(编号:31260628);塔里木畜牧科技兵团重点实验室开放课题(编号:HS201204)。
作者简介:贺建忠(1977—),男,内蒙古五原人,硕士,副教授,研究方向为临床兽医学。E-mail:talimuhe_he@126.com。
通信作者:白万胜,副教授,研究方向为临床兽医学。E-mail:bwsdky@126.com。
金黄色葡萄球菌(Staphylococcus aureus,SA)是奶牛乳房炎(bovine mastitis)的主要病原之一,防治困难,常给乳业造成巨大的经济损失。SA易形成生物被膜(biofilm,BF),BF对抗生素治疗以及宿主免疫均可产生较强的抵抗力,因此被认为是乳房炎发病机制中一个重要毒力因子[1-2]。生物被膜形成受多种基因调控,这些调控基因统称为生物被膜相关基因(biofilm-associated genes,BAGs)。例如icaA和icaD的表达可促进BF的形成[3],icaR通过抑制ica的转录而抑制BF的形成。此外,rbf、bap、sarA、SigB和SasG等均可直接或间接调节BF的形成。
对于BF形成及BAGs分布多有报道,但对于BF形成和BAGs关系的研究却鲜有报道。为此,本研究以全国9个省(区)102株SA为研究对象,进行了BF及BAGs分布情况调查,旨在分析地域性差异,为SA性发乳房炎的进一步防治提供基础数据。
1 材料与方法
1.1 材料
1.1.1 菌株背景 102株SA均分离自亚临床性乳房炎乳样。菌株为本实验室鉴定、保存。鉴定程序包括溶血性观察、革兰氏染色、触酶试验、凝固酶试验、生化鉴定及SA特异性基因nuc的PCR检测等。鉴定后的菌株在含20%甘油的 Luria-Bertani(LB)肉汤中于-80 ℃超低温冰箱中保存。
菌株分离自全国9个省(市、区),共102株,其中河北省37株、北京市14株、内蒙古自治区7株、甘肃省7株、宁夏自治区11株、新疆维吾尔自治区7株、河南省6株、上海市5株、广西壮族自治区7株。
1.1.2 主要试剂与仪器 胰蛋白胨大豆胨肉汤(TSB)、胰蛋白胨大豆琼脂(TSA)、脑心侵液(BHI)琼脂/肉汤购自北京奥博星生物技术有限责任公司,细菌基因组DNA提取试剂盒购自北京索莱宝科技有限公司,刚果红购自天津科密欧试剂有限公司,蔗糖购自天津市致远化学试剂有限公司,磷酸二氢钠(NaH2PO4·2H2O)和磷酸氢二钠(Na2HPO4·12H2O)分别购自国药集团化学试剂有限公司和北京化学试剂有限公司,琼脂糖、Taq mix和Marker购自北京艾德莱生物科技有限公司,引物由北京三博远志生物技术有限公司合成。
台式微量高速离心机(TG-16S):四川蜀科仪器有限公司;气浴恒温振荡器(THZ-82A):金坛市医疗仪器厂;数显电热培养箱(HPX-9052MBE):上海博讯实业有限公司医疗设备厂;电泳仪(DYY-6D):北京市六一仪器厂;凝胶成像分析系统(Tanon-4100):上海天能科技有限公司;DNM-9602酶标分析仪:北京普朗新技术有限公司。
1.2 方法
1.2.1 BF检测 刚果红法(congo red agar,CRA):将36 g蔗糖和0.8 g刚果红溶于1 L脑心浸液培养基(BHI)中,121 ℃高压灭菌15 min,倾倒平板(CRA平板),备用。挑取复苏后的单菌落接种于CRA平板,于37 ℃恒温培养箱中培养24 h后观察菌落形态。凡粗糙、干燥、水晶样的黑色菌落均为生物被膜阳性株(biofilm-positive strains);而红色的光滑型菌落为生物被膜阴性株(biofim-negative strains)。
半定量黏附试验(semi-quantitative assay,SQAA):挑取复苏后的单菌落接种于BHI肉汤,37 ℃恒温振荡器中过夜培养。取过夜培养的BHI肉汤,用含20 g/L葡萄糖的BHI肉汤按1 ∶ 100的比例稀释。用微量移液器吸取200 μL稀释后的菌液转移到96孔板。每组设3个重复,以BHI肉汤作阴性对照。将96孔板置于37 ℃恒温培养箱中培养24 h后,将96孔板中的液体移除,用PBS液清洗2遍,以除去剩余的浮游菌。倒置自然干燥后,加入100 μL 95%乙醇固定 5 min,再用100 μL 1%结晶紫染色5 min。染色后,用灭菌蒸馏水清洗3遍,以除去剩余的染液。自然干燥后,用酶标仪测定570 nm下的D值。凡D570 nm≥0.1的为生物被膜阳性株,D570 nm<0.1的为生物被膜阴性株。D值取3组的平均值。
1.2.2 BAGs检测 按照索莱宝细菌基因组DNA提取试剂盒说明书提供的步骤进行。提取的DNA模板保存于-20 ℃冰箱中备用。8个生物被膜形成相关基因(icaA、icaD、icaR、sigB、sarA、bap、rbf、sasG)采用PCR法进行检测,引物序列、退火温度、产物大小及参考文献见表1。PCR反应体系(20 μL)分别含有1 μL上下游引物、7 μL ddH2O、10 μL Taq Mix和1 μL DNA模板。PCR反应条件如下:95 ℃ 预变性8 min;95 ℃ 变性30 s,相应的退火温度(表1)退火30 s,72 ℃ 延伸10 min,30个循环。含0.5 μg/mL溴乙锭(EB)的1.5%琼脂糖凝胶中电泳,PCR产物在凝胶成像系统中观察。
表1 引物设计
基因 引物序列(5′→3′) Tm
(℃) 目的片段长度
(bp) 参考文献
icaA CCTAACTAACGAAAGGTAG;AAGATATAGCGATAAGTGC 56 1 315 [4]
icaD ATGGTCAAGCCCAGACAGG;CGTGTTTTCAACATTTAATGCAA 56 198 [5]
bap CCCTATATCGAAGGTGTAGAATTG;GCTGTTGAAGTTAATACTGTACCTGC 60 971 [6]
icaR CAATAATCTAATACGCCTGAG;AGTAGCGAATACACTTCATCT 54 246 [5]
sarA TTTTTTTACGTTGTTGTGCATTAACA;CATTTAAACTACAAACAACCACAAGTTG 56 135 [7]
rbf ACGCGTTGCCAAGATGGCATAGTCTT;AGCCTAATTCCGCAAACCAATCGCTA 62 164 [8]
SasG CGGATCCGGTGTGACAATCAGTATGAC;CGGAATTCGCGACATTTATGTGGATACAC 55 937 [9]
2 结果与分析
2.1 BAGs的分布情况
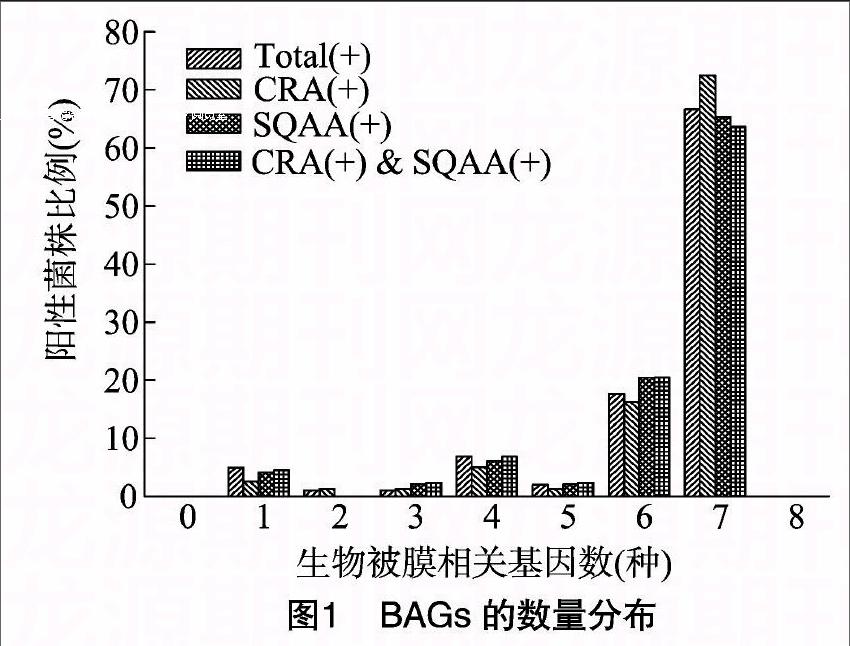
BF相关基因广泛分布于乳房炎性SA分离株中,所有的102株SA至少携带1种BAG。相比较而言,同时存在7种基因的菌株最多,所有菌种阳性菌株Total(t)、CRA检测BF阳性菌株CRA(+)、SQAA检测BF阳性菌株SQAA(+)、CRA和SQAA检测均为阳性的菌株CRA(+)& SQAA(+)比例分别为66.7%、725%、65.3%、63.6%。其次,同时携带6种基因的菌株较多,且SQAA(+)和CRA(+)& SQAA(+)比例最高。所有被测菌株均未扩增出bap基因,因此没有同时存在8种被测基因的菌株。
本研究共检测了8种BF相关基因,出现的组合形式共20种,其中比例最高的是7种基因的组合,最少的仅有1种基因存在。最流行的组合是SigB-icaR-icaA-icaD-sarA-rbf-SasG,比例高达66.7%;SigB-icaR-icaA-sarA-rbf-SasG、SigB-icaA-icaD-sarA-rbf-SasG、SigB-icaR-icaD-sarA-rbf-SasG、SigB、icaR-icaA-icaD-sarA-rbf-SasG、SigB-icaA-rbf-SasG的比例分别是6.9%、3.9%、2.9%、29%、2.0%、2.0%;其余组合均为1.0%,即组合形式仅出现1次(表2)。
表2 BF相关基因组合的流行情况
相关基因组合
SigB icaR icaA icaD sarA rbf SasG
比例
(%)
+ + + + + + + 66.7
+ + + - + + + 6.9
+ - + + + + + 3.9
+ + - + + + + 2.9
+ - - - - - - 2.9
- + + + + + + 2.0
+ - + - - + + 2.0
- + - - - - - 1.0
- - - - - + + 1.0
+ - - - - + - 1.0
+ - - + - + - 1.0
+ - - + - + + 1.0
+ + + - - + - 1.0
+ - - + + + - 1.0
- - + + - + + 1.0
+ - + - + + + 1.0
+ + + - + + - 1.0
- + + + - + - 1.0
+ + + + + - + 1.0
+ + + + + + - 1.0
2.2 BF的检测结果
由图2可以看出,河北省BF阳性株BAGs的比例均低于菌株总数。宁夏和甘肃BF阳性株BAGs的比例均高于或等于菌株总数,而且SQAA(+)和CRA(+)& SQAA(+)全部为100%,说明BAGs和SQAA+存在完全的一致性。除了北京市的icaD基因和内蒙古的icaR基因,这2个地区BAGs在SQAA(+) 和 CRA(+)& SQAA(+)中均高于或等于菌种总
数中的比例。新疆除SigB和rbf2个基因外,其他的变化趋势与河北相似。
由图3可以看出,河南BAGs在CRA(+)和菌株总数中的比例全部相同,BAGs在SQAA(+)和CRA(+)& SQAA(+)中的比例也全部相同。广西和上海BAGs在SQAA(+)和CRA(+)& SQAA(+)中均为100%,BAGs分布与BF形成表现出很好的一致性。就全国范围总体而言,CRA(+)中BAGs的比例均高于菌种总数和其他BF阳性株,说明CRA(+)在全国范围内与BAGs的符合度较高。
3 讨论
SA是引发临床型乳房炎和亚临床型乳房炎最主要的病原之一[10],可降低牛奶质量,造成严重的经济损失,是影响奶业发展的主要问题[11]。SA具有多种毒力因子,其中BF形成被认为是引发慢性感染的主要原因[12]。BF的形成与BAGs的分布密不可分,本研究结果显示,BF阳性株均存在较高比例的BAGs,其中同时存在7种和6种被测基因的占有绝对优势。在20种流行组合中,最流行的组合是SigB-icaR-icaA-icaD-sarA-rbf-SasG,比例高达66.7%,其次是SigB-icaR-icaA-sarA-rbf-SasG(6.9%)、SigB-icaA-icaD-sarA-rbf-SasG(3.9%)、SigB-icaR-icaD-sarA-rbf-SasG(29%)、SigB(2.9%)、icaR-icaA-icaD-sarA-rbf-SasG(2.0%)和SigB-icaA-rbf-SasG(2.0%)。以上结果表明,多种BAGs组合是我国乳房炎性SA流行的重要特征之一,同时这些基因可能在BF形成过程发挥重要作用。icaA和icaD共同表达增加N-乙酰葡糖胺转移酶活性,促进BF的形成[13],而icaR可通过限制ica表达抑制BF的形成。SigB、rbf与SasG的表达能够促进BF的形成[14-16],而SarA的表达能够限制BF的形成[17],迄今,尽管bap基因表达能够促进SA在乳房内的黏附和BF的形成[18],但是在本研究所有被测菌株中均未扩增出该基因,说明该基因在我国乳房炎性金黄色葡萄球菌BF形成和发病机制中居于次要地位。
不同地区BF形成与BAGs分布的一致性存在一定差别。广西、上海、北京、内蒙古、宁夏和甘肃7个省(市、区) BAGs分
布BF形成保持高度一致性,而河北、河南和新疆BAGs分布和BF形成的一致性相对降低,提示在BF形成和乳房炎发病机制中发挥重要作用的可能是本研究未检测的某些基因。具体到基因种类,rbf和SigB分布最广,在大多数省份均为100%,提示这2个基因在SA性乳房炎发病机制中可能发挥着重要作用。Rbf可抑制icaR的表达,能够间接激活icaADBC的表达,促进BF的形成,但是并不依赖于ica通路[16]。sigB能够促进不同毒力因子表达的调控,促进BF形成的同时能够调节抗生素耐药性[19]。因此,通过rbf和SigB基因功能调节入手,研究我国乳房炎性SA的致病机制,可能是一种新的思路。
综上所述,多种BAGs组合流行是我国乳房炎性SA流行的主要趋势,各地区金黄色葡萄球菌BF形成和BAGs分布存在一定的差异。
参考文献:
[1]Brady R A,Omay G A,Leid J G,et al. Resolution of staphylococcus aureus biofilm infection using vaccination and antibiotic treatment[J]. Infection and Immunity,2011,79(4):1797-1803.
[2]Vergara-Irigaray M,Valle J,Merino N,et al. Relevant role of fibronectin-binding proteins in staphylococcus aureus biofilm-associated foreign-body infections[J]. Infection and Immunity,2009,77(9):3978-3991.
[3]Manuela O F. Invasive potential of biofilm-forming staphylococci bovine subclinical mastitis isolates[J]. J Vet Sci,2011,12(1):95-97.
[4]Vasudevan P,Nair M K,Annamalai T,et al. Phenotypic and genotypic characterization of bovine mastitis isolates of Staphylococcus aureus for biofilm formation[J]. Veterinary Microbiology,2003,92(1/2):179-185.
[5]Chaieb K,Mahdouani K,Bakhrouf A. Detection of icaA and icaD loci by polymerase chain reaction and biofilm formation by Staphylococcus epidermidis isolated from dialysate and needles in a dialysis unit[J]. Journal of Hospital Infection,2005,61(3):225-230.
[6]Cucarella C,Tormo M A,Knecht E,et al. Expression of the biofilm-associated protein interferes with host protein receptors of Staphylococcus aureus and alters the infective process[J]. Infection and Immunity,2002,70(6):3180-3186.
[7]Rode T M,Langsrud S,Holck A,et al. Different patterns of biofilm formation in Staphylococcus aureus under food-related stress conditions[J]. International Journal of Food Microbiology,2007,116(3):372-383.
[8]Cue D,Lei M G,Luong T T,et al. Rbf promotes biofilm formation by Staphylococcus aureus via repression of icaR,a negative regulator of icaADBC[J]. Journal of Bacteriology,2009,191(20):6363-6373.
[9]李 丽,杨宏军,刘代成,等. 奶牛乳腺炎葡萄球菌生物被膜形成及相关基因分析[J]. 中国农业科学,2011,44(1):160-166.
[10]Demon D,Ludwig C,Breyne K,et al. The intramammary efficacy of first generation cephalosporins against Staphylococcus aureus mastitis in mice[J]. Veterinary Microbiology,2012,160(1/2):141-150.
[11]Graber H U,Pfister S,Burgener P,et al. Bovine Staphylococcus aureus:diagnostic properties of specific media[J]. Research in Veterinary Science,2013,95(1):38-44.
[12]Valle J,Solano C,Garcia B,et al. Biofilm switch and immune response determinants at early stages of infection[J]. Trends in Microbiology,2013,21(8):364-371.
[13]Atshan S S,Shamsudin M N,Karunanidhi A,et al. Quantitative PCR analysis of genes expressed during biofilm development of methicillin resistant Staphylococcus aureus (MRSA)[J]. Infection Genetics and Evolution,2013,18:106-112.
[14]Mitchell G,Brouillette E,Séguin D L,et al. A role for sigma factor B in the emergence of Staphylococcus aureus small-colony variants and elevated biofilm production resulting from an exposure to aminoglycosides[J]. Microbial Pathogenesis,2010,48(1):18-27.
[15]Geoghegan J A,Corrigan R M,Gruszka D T,et al. Role of surface protein SasG in biofilm formation by Staphylococcus aureus[J]. Journal of Bacteriology,2010,192(21):5663-5673.
[16]Lim Y,Jana M,Luong T T,et al. Control of glucose-and NaCl-induced biofilm formation by rbf in Staphylococcus aureus[J]. Journal of Bacteriology,2004,186(3):722-729.
[17]Reyes D,Andrey D O,Monod A,et al. Coordinated regulation by AgrA,SarA,and SarR to control agr expression in Staphylococcus aureus[J]. Journal of Bacteriology,2011,193(21):6020-6031.
[18]Latasa C,Solano C,Penadés J R,et al. Biofilm-associated proteins[J]. Comptes Rendus Biologies,2006,329(11):849-857.
[19]Pfrtnera H,Burian M S,Michalik S,et al. Activation of the alternative sigma factor SigB of Staphylococcus aureus following internalization by epithelial cells:an in vivo proteomics perspective[J]. International Journal of Medical Microbiology,2014,304(2):177-187.

