PRDX1通过上皮间质转化促进结肠癌SW480细胞侵袭转移
冯继红,冯冬冬,傅仲学
(1.重庆医科大学附属第一医院 胃肠外科,重庆 400016;2.安徽省六安市寿县中医院 心内科,安徽 六安 232200)
临床医学研究
PRDX1通过上皮间质转化促进结肠癌SW480细胞侵袭转移
冯继红1,冯冬冬2,傅仲学1
(1.重庆医科大学附属第一医院 胃肠外科,重庆 400016;2.安徽省六安市寿县中医院 心内科,安徽 六安 232200)
目的 探讨过氧化还原酶1 (Peroxiredoxin 1,PRDX1)在结肠癌上皮间质转化( epithelialmesenchymal transition,EMT) 发生中的作用及其参与结肠癌侵袭转移的可能机制。方法 通过慢病毒转染使结肠癌SW480细胞PRDX1过表达并通过Western blot检测验证;采用Transwell方法和细胞划痕实验检测细胞侵袭及转移能力的变化;免疫细胞荧光检测结肠癌SW480细胞EMT相关蛋白Twist1、E-cadherin及Vimentin的表达;Western blot方法检测EMT转录因子Twist1、EMT相关蛋白E-cadherin、N-cadherin及Vimentin及转移相关蛋白MMP-9的表达。结果 转染PRDX1组SW480细胞中PRDX1呈过表达;Transwell法和细胞划痕实验显示过表达PRDX1组细胞的侵袭及转移能力较对照组明显增强;免疫细胞荧光显示转染PRDX1组细胞其上皮细胞标记E-cadherin明显下调,间质标记Vimentin及EMT转录因子Twist1表达明显上调;Western blot结果表明过表达PRDX1组E-cadherin较对照组显著降低(P<0.01),而Twist1、MMP-9、N-cadherin及Vimentin较对照组显著升高(P<0.05)。结论 PRDX1可促进人结肠癌SW480细胞EMT的发生,从而增强结肠癌SW480细胞的侵袭、转移能力。
过氧化还原酶1;结肠癌;侵袭;转移;上皮间质转化
结肠癌是世界上最常见恶性肿瘤之一,其发生率和死亡率位居恶性肿瘤前列[1]。我国结肠癌发病率呈稳步上升趋势[2],近年以8.4%的速度上升,预计在2015年,我国结肠癌新发病例将达到31.2万例,其中男性17.3万例,女性13.9万例[3]。由于结肠癌手术效果不够理想,术后复发率及转移率均较高,因此,研究结肠癌迁移侵袭的机制和开发高效低毒的分子靶向药物,对结肠癌防治具有重要意义。上皮间质转化(Epithelial-mesenchymal transition, EMT)是上皮来源肿瘤细胞获得侵袭和转移能力的重要生物学过程,在这一过程中,上皮细胞获得间质细胞的特性,侵袭性增加,从而促进肿瘤转移[4]。
过氧化还原酶1(Peroxiredoxin 1,PRDX1)是过氧化还原蛋白酶超家族(PRDXs)中主要成员之一,又称为增殖相关蛋白(proliferation associated protein,PAG),在结肠癌、乳腺癌、肺癌等多种肿瘤组织细胞中高表达,与细胞的增殖和分化密切相关。PRDX1表达上调可增强肿瘤细胞的抗氧化能力,减少活性氧自由基产生,是肿瘤细胞抗凋亡和化疗耐药的重要原因[5]。近年有研究表明,PRDX1可调节TGF-β1诱导的肺腺癌A549细胞EMT,细胞过表达PRDX1后E-cadherin表达显著下调,而下调PRDX1表达后经TGF-β1诱导的EMT和细胞侵袭受到抑制[6]。本研究通过初步探讨PRDX1对人结肠癌SW480细胞侵袭、转移及EMT的作用,为临床寻求理想结肠癌治疗新靶点奠定理论基础。
1 材料与方法
1.1 主要试剂与材料 人结肠癌细胞株SW480购自中科院上海细胞库,胎牛血清(FBS)购自Hyclone公司,L-15培养基(Leibovitz’s L-15 Medium)和嘌呤霉素(Puromycin)购自Gibco公司,兔抗人GAPDH单抗、兔抗人PRDX1单抗购自Epitomics公司,E-cadherin、N-cadherin、Vimentin、Twist1及MMP-9抗体购自Santa cruz公司,“SYBR®PrimeSciptTMRT-PCR Kit”购自中国大连宝生物工程有限公司,Lipofectamine2000购自Invitrogen公司,Premix Taq酶、DNA marker均购自TaKaRa公司,ECL发光试剂盒购自Millipore公司。携带增强绿色荧光蛋白基因(EGFP) 和嘌呤霉素(Puromycin)抗性基因的PRDX1及空载对照组慢病毒载体 (Ubi-MCS-EGFP-IRES-Puromycin,GV218)由上海吉凯基因化学技术有限公司构建和包装。
1.2 方法
1.2.1 细胞培养 SW480细胞培养于含10%胎牛血清(FBS)的L-15培养基中,在5%的CO2饱和湿度、37 ℃恒温培养箱中常规培养。SW480细胞呈单层贴壁生长,每 2~3天用0.25%胰酶消化,以1∶2传代。SW480细胞生长状态稳定,呈对数生长期时用于实验。
1.2.2 细胞转染及抗性筛选 SW480细胞准确计数使其在6孔板均匀平铺,待细胞汇合率达60%左右,按细胞数及MOI值(MOI=50)计算所加的病毒量,病毒原液用增强剂Eni.S稀释,滴定浓度为标准浓度(1×108),加入终浓度为8 μg/mL Polybrene、Eni.S、L-15培养基及计算的标准浓度病毒液,总体积为1 mL。将含有PRDX1基因扩增片段的慢病毒(Ubi-Prdx1-EGFP-Puromycin)与空载对照慢病毒分组感染SW480细胞,命名为转染PRDX1组(PRDX1)及空载对照组(Vector),并留未转染的细胞作为空白对照,即未转染组(SW480)。空载对照组及转染PRDX1组细胞培养26~28 h后更换为含有3 μg/mL嘌呤霉素(Puromycin)的L-15培养液行抗性筛选,转染3 d后行荧光显微镜下观察绿色荧光,通过观察荧光计算转染率达95%以上可继续行抗性筛选培养数日,收获细胞行检测。
1.2.3 Transwell侵袭实验 选择孔径为8.0 μm的Transwell 小室,装置于24孔板中。取对数生长期各组SW480细胞(实验分组同上)。准备基质胶,将冻存于-80 ℃冰箱的matrigel 4 ℃过夜,变成液态; 无血清培养基以1∶9稀释,吸50 μL均匀铺到Transwell 上室, 37 ℃过夜,当出现“白色层”时在上室中加入100 μL 预温的无血清的L-15培养基,孵育30 min,使基质胶再水化,吸去剩余培养液,0.25%胰酶消化细胞,无血清培养基洗3 次,调整细胞为1×106个/mL;取细胞悬液100 μL加入上室,下室加500 μL 完全培养基;37 ℃、5% CO2孵育24 h,弃培养基,擦拭上室细胞;取出Transwell用PBS 洗2 次,4%多聚甲醛固定细胞10 min,倒置,风干;加0.1% 结晶紫染色10 min,PBS 洗3次,擦净上室细胞;倒置显微镜下随机计数10个视野的细胞,取均数。每组设3个复孔,实验重复3次。侵袭抑制率( %) = (对照组穿膜细胞-转染组穿膜细胞) /对照组穿膜细数×100%。
1.2.4 细胞划痕实验 取状态良好的3组细胞(未转染组、空载对照组及转染PRDX1组)制备成单细胞悬液,按1×105个细胞(500 μL)/孔将细胞加入6 孔板,5% CO2培养箱内于37℃孵育培养。采用划痕法用消毒过的枪头在70%汇合的单层细胞表面划出一无细胞的细痕,用PBS漂洗3次以除去划下的细胞,加入新鲜无血清培养液继续培养观察,24 h后在倒置显微镜下观察拍照。每组实验重复3次。
1.2.5 免疫细胞荧光检测 取24 孔板行细胞爬片,观察细胞在玻片上种植均匀、生长良好,吸去各孔内培养基,PBS清洗3次,4%多聚甲醛固定20 min后再次 PBS冲洗玻片3次,每次5 min;每孔中加入含 0.1% Triton X-100及3%山羊血清的PBS约0.5 mL,在室温下封闭约1 h;加入待测蛋白的一抗稀释液,Twist1、E-cadherin及Vimentin稀释比例均为1∶2000,4℃过夜孵育;过夜后取出24孔板,PBS 轻洗玻片2次,每次5 min;每孔玻片滴加50μL 稀释比例为1∶2000的DyLight 549荧光二抗,37℃条件下避光孵育1 h,PBS轻洗玻片3次,每次5 min;DAPI滴加玻片上染核10 min;PBS轻洗玻片3次,每次5 min;吸干PBS残液,室温下风干;勾取爬片,注意细胞爬片的一面朝下,放置载玻片上,少量中性树封片,荧光显微镜下观察拍照。
1.2.6 Western blot检测 收集各组细胞,采用PBS洗涤2次,离心弃上清,加入200 μL预冷的RIPA细胞裂解液,置冰上30 min,4 ℃、14 000 rpm离心16 min,取上清并进行蛋白定量(BCA法)。取30 μg蛋白加入上样缓冲液,经100 ℃、10 min变性后用100 g/L的SDS-PAGE分离。蛋白半干转移至PVDF膜,用含50 g/L脱脂奶粉的TBST缓冲液室温封闭1 h,待测蛋白一抗或抗人GAPDH的一抗,4℃过夜,TBST洗涤3次,加入HRP标记的山羊抗小鼠二抗室温孵育1 h,TBST洗涤3次,加入ECL显色剂后暗室内压片曝光。实验重复3次。

2 结果
2.1 转染慢病毒后SW480细胞PRDX1蛋白的表达 以GAPDH为内参,比较未转染组(SW480)、空载对照组(Vector)及转染PRDX1组(PRDX1)细胞中的PRDX1蛋白表达,经Western-blot检测,可见转染PRDX1组中PRDX1显著增加,差异具有统计学意义(P<0.05),说明转染PRDX1组SW480细胞其PRDX1蛋白过表达成功。
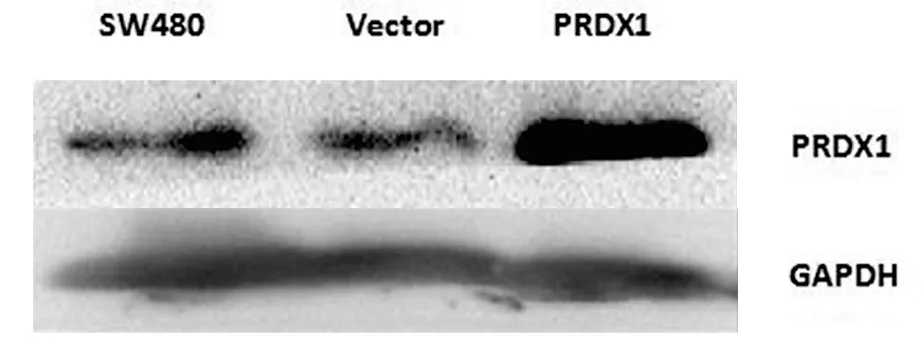
未转染组:SW480;空载对照组:Vector;转染PRDX1组:PRDX1。
2.2 Transwell细胞侵袭实验 未转染组(SW480)、空载对照组(Vector)及转染PRDX1组(PRDX1)细胞侵袭实验(见图2)。结果显示,稳定转染后的PRDX1组穿过Matrigel胶的侵袭细胞数较未转染组和空载对照组明显增多,统计学分析显示差异有统计学意义(P<0.01);而其余两组组间差异无统计学意义(P>0.05)。

A:SW480;B:Vector;C:PRD×1。
2.3 细胞迁移实验 在3组细胞内划出相同宽度的痕迹后,24 h后观察细胞划痕处的迁移情况,可见转染PRDX1组比未转染组和空载对照组细胞迁移速度快(见图3)。结果表明,转染PRDX1组细胞迁移能力明显高于未转染组和空载对照组。

图3 3组细胞24 h后侵袭转移能力的差异(×100)
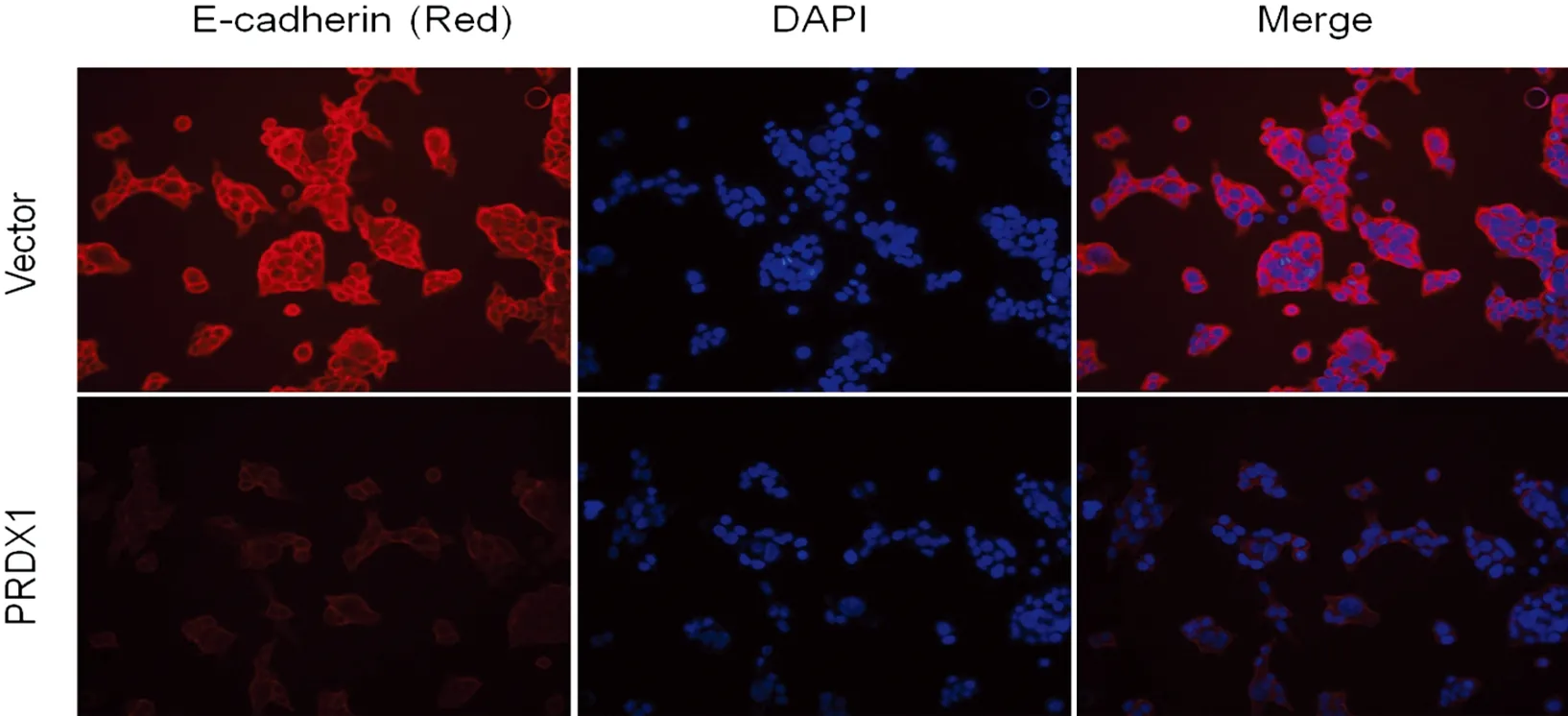
2.4 免疫细胞荧光检测过表达PRDX1后SW480细胞Twist1、E-cadherin及Vimentin的表达 通过免疫细胞荧光检测3组细胞中EMT标志物的表达,与空载对照组(Vector)比较,发现转染PRDX1组细胞中上皮细胞标记E-cadherin明显下调,而间质标记Vimentin及EMT转录因子Twist1的表达明显上调(见图4)。说明过表达PRDX1后其细胞EMT标志物发生了较明显变化。
A

B
C

A:Twist1;B:E-cadherin;C: Vimentin。
2.5 Western-blot法检测过表达PRDX1后细胞Twist1、E-cadherin、N-cadherin、Vimentin及MMP-9的表达 通过Western-blot法检测3组细胞中EMT标志物的表达,从图5中可发现,与未转染组(SW480)及空载对照组(Vector)比较,转染PRDX1组细胞中上皮细胞标记E-cadherin蛋白表达明显下调(P<0.01),间质标记N-cadherin、Vimentin、EMT转录因子Twist1以及转移相关蛋白MMP-9的表达均出现不同程度上调(P<0.05)。说明PRDX1过表达可促进细胞EMT的发生及其转移能力。

图5 Western-blot检测3组细胞Twist1、E-cadherin、N-cadherin、Vimentin及MMP-9的表达
3 讨论
目前我国结直肠癌的发病率仅次于肺癌和胃癌,位居第3位,且发病率每年仍以一定速度增长。大部分结肠癌患者早期没有症状,超过75%的患者确诊时已属于晚期[7],临床上虽采取包括手术、化疗、放疗为主的综合治疗方法,但预后仍不理想,其重要原因是结肠癌趋于局部侵袭和发生肝转移,进一步研究和探讨结肠癌侵袭转移的作用机制仍是结肠癌治疗研究的难点和热点。
过氧化还原蛋白(peroxiredoxins,PRDXs)是近年新发现的相对分子量在20~30 kDa过氧化物酶超家族,对氧化应激反应极为敏感,主要作用是通过硫氧还蛋白还原、清除过氧化物或超氧化物,在保持细胞内氧化还原稳态中发挥重要调节作用[8]。此外,PRDXs还在细胞多种分子传导信号中发挥重要枢纽作用[9]。PRDX1蛋白是PRDXs家族中最受关注的抗氧化因子之一,在多种肿瘤中呈高表达或低表达,与肿瘤发生、发展及侵袭转移密切相关[10-12]。Taniuchi K等[13]报道了PRDX1在胰腺导管腺癌组织中高表达,且与磷酸化的p38 MAPK相互作用,并发现PRDX1抑制后会导致膜波动和突起的改变,从而促进胰腺癌细胞的侵袭。Turner-Ivey B等[14]报道了乳腺癌中PRDX1通过其半胱氨酸Cys52位点与p38 MAPK磷酸化(MKP-1、MKP-5)相结合,在乳腺癌上皮细胞衰老过程中发挥重要调节作用。Riddell JR等[15]研究发现PRDX1通过TLR4和VEGF依赖的形式促进前列腺癌上皮细胞的增殖、迁移和分化。此外,PRDX1还作为一种增殖相关蛋白参与细胞增殖和分化[16],还可发挥分子伴侣及免疫调节功能[17]。由此可见,PRDX1作为促癌因子还是抑癌因子尚存在争议,PRDX1在不同的肿瘤中可能发挥不同的功能和作用,且在肿瘤的发生、发展和侵袭转移中的具体机理也不尽相同。
目前,PRDX1与结直肠癌关联研究少见报道,刘峰等[18]通过基因芯片技术检测到PRDX1在出现腹膜转移的结直肠癌原发肿瘤组织中表达上调。蒋尧等[19]检测到PRDX1在结直肠癌组织中高表达,且与III期结直肠癌患者或有淋巴结转移的患者之间有相关性。也有报道显示,PRDX1的表达与结直肠肿瘤发展转移及复发有关,作为一种促癌因子发挥作用[20],且与E-ca呈负相关,其高表达可促使EMT,从而促进肿瘤转移[6]。本研究采用慢病毒转染技术使结肠癌细胞株PRDX1表达上调,发现其侵袭和转移能力明显增强,同时EMT标志蛋白和转录因子也发生相应变化。结果显示,PRDX1可能通过调节转录因子Twist1的表达从而使EMT标志蛋白E-cadherin表达发生改变,PRDX1的表达上调导致了E-cadherin的表达明显降低,二者呈负相关。同时,PRDX1还会引起间质标记N-cadherin、Vimentin及转移相关蛋白MMP-9的表达上调。由此推断,PRDX1的表达上调可能通过某种机制促使EMT转录因子Twsit1的表达增加,从而推动了EMT进程,导致肿瘤细胞的侵袭和转移能力增强。结合文献报道,推测PRDX1可能通过与缺氧或氧化还原相关的核心调控网络来影响EMT进程,从而赋予了肿瘤细胞更强大适应环境的能力,在肿瘤细胞对抗活性氧(ROS)和清除H2O2有害刺激中发挥重要作用。至于PRDX1是否主要通过EMT来促进结肠癌细胞侵袭和转移,以及PRDX1在肿瘤细胞与其微环境交互网络调控中所扮演的角色究竟如何尚不得而知,仍亟待深入研究。鉴于此,课题组准备在后续实验中采用RNA干扰技术沉默PRDX1基因的表达及相关体内实验进一步探讨PRDX1与EMT关联的具体机制。由此相信,PRDX1与结肠癌EMT及侵袭转移的关系有望成为一个新的研究方向。
综上所述,对PRDX1在结肠癌EMT及侵袭转移中的作用和可能机制的探讨,可能对结肠癌局部浸润和肝脏转移的发生及具体机制有更深入的了解,并为结肠癌转移的治疗提供新的靶点和方向。
[1] Jemal A,Bray F,Center M M,et al. Global cancer statistics[J]. CA Cancer J Clin,2011,61(2):69-90.
[2] 陈万青,张思维,曾红梅,等.中国2010年恶性肿瘤发病与死亡[J].中国肿瘤,2014,23(1):1-10.
[3] 代珍,郑荣寿,邹小农.中国结直肠癌发病趋势分析和预测[J].中华预防医学杂志,2012, 46(7):598-603.
[4] Marie-Egyptienne D T, Lohse I, Hill R P. Cancer stem cells, the epithelial to mesenchymal transition (EMT) and radioresistance: Potential role of hypoxia[J]. Cancer Lett,2013, 341(1):63-72.
[5] Jarvis R M, Hughes S M, Ledgerwood E C. Peroxiredoxin 1 Functions as a Signal Peroxidase to Receive, Transduce, and Transmit Peroxide Signals in Mammalian Cells[J]. Free Radical Biology & Medicine,2012,53(7):1522-1530.
[6] Ha B, Kim E K, Kim J H, et al. Human peroxiredoxin 1 modulates TGF-β1-induced epithelial-mesenchymal transition through its peroxidase activity[J]. Biochem Biophys Res Commun,2012,421(1):33-37.
[7] Chalya P L, McHembe M D, Mabula J B, et al. Clinicopathological patterns and challenges of management of colorectal cancer in a resource-limited setting: a Tanzanian experience[J]. World J Surg Oncol, 2013 ,Apr 18,11:88. doi: 10.1186/1477-7819-11-88.
[8] Poynton R A, Hampton M B. Peroxiredoxins as biomarkers of oxidative stress[J].Biochim Biophys Acta, 2014,1840(2):906-912.
[9] Park J, Lee S, Lee S, et al. 2-cys peroxiredoxins: emerging hubs determining redox dependency of Mammalian signaling networks[J]. Int J Cell Biol, 2014,2014:715867.doi:10.10.1155/2014/715867.
[10] Nicolussi A, D'Inzeo S, Mincione G, et al. PRDX1 and PRDX6 are repressed in papillary thyroid carcinomas via BRAF V600E-dependent and -independent mechanisms[J]. Int J Oncol,2014,44(2):548-556.
[11] Sun Q K, Zhu J Y, Wang W, et al. Diagnostic and prognostic significance of peroxiredoxin 1 expression in human hepatocellular carcinoma[J]. Med Oncol, 2014, 31(1):786.
[12] Ren P, Ye H, Dai L,et al. Peroxiredoxin 1 is a tumor-associated antigen in esophageal squamous cell carcinoma[J]. Oncol Rep,2013,30(5):2297-2303.
[13] Taniuchi K, Furihata M, Hanazaki K, et al. Peroxiredoxin 1 Promotes Pancreatic Cancer Cell Invasion by Modulating p38 MAPK Activity [J]. Pancreas,2014.Dec 2.[Epub ahead of print]
[14] Turner-Ivey B, Manevich Y, Schulte J, et al. Role for Prdx1 as a specific sensor in redox-regulated senescence in breast cancer [J]. Oncogene,2013, 32(45):5302-5314.
[15] Riddell J R, Bshara W, Moser M T, et al. Peroxiredoxin 1 controls prostate cancer growth through Toll-like receptor 4-dependent regulation of tumor vasculature [J]. Cancer res,2011, 71(5):1637-1646.
[16] Mu Z M, Yin X Y, Prochownik E V, et al. Pag, a putative tumor suppressor, interacts with the Myc Box II domain of c-Myc and selectively alters its biological function and target gene expression[J]. J Biol Chem, 2002,277(45):43175-43184.
[17] O'Leary P C, Terrile M, Bajor M, et al. Peroxiredoxin-1 protects estrogen receptor α from oxidative stress-induced suppression and is a protein biomarker of favorable prognosis in breast cancer[J]. Breast Cancer Res,2014,16(4):79.
[18] 刘峰,郭久冰,沈智勇,等.基因芯片技术筛选结直肠癌腹膜转移相关基因[J].南方医科大学学报,2012,32 (3):400-403.
[19] 蒋尧,傅仲学,吴星烨.PRDX1在结直肠癌中的表达及其临床意义[J].重庆医学,2011,40(32):3276-3277.
[20] Wu X Y, Fu Z X, Wang X H. Peroxiredoxins in colorectal neoplasms[J]. Histol Histopathol, 2010,25(10):1297-1303.
[收稿2014-12-02;修回2014-12-30]
(编辑:王福军)
PRDX1 participates in invasion and metastasis of colon cancer through epithelial-mesenchymal transition
FengJihong1,FengDongdong2,FuZhongxue1
(1.Department of Gastroenterological Surgery, The First Affiliated Hospital of Chongqing Medical University, Chongqing 400016, China;2.Department of Cardiology, Shouxian Hospital of Traditional Chinese Medicine,Lu′an Anhui 232200, China)
Objective To study the role of Peroxiredoxin 1 (PRDX1) in epithelial-mesenchymal transition in colon cancer and the mechanism of PRDX1 participating in the invasion and metastasis of colon cancer.Methods SW480 cells were transfected with lentivirus vectors resulting in overexpression of PRDX1 protein, and the expression of PRDX1 were validated by western blot. Transwell migration assays and wound healing assays were performed to identify the differences and changes of invasive and metastatic ability in SW480 cell lines. The expression of Twist1, E-cadherin and Vimentin were analyzed by immunocytochemistry. The expression of Twist1 (EMT related transcription factor), E-cadherin、N-cadherin and Vimentin (EMT biomarker proteins), and MMP9 (metastasis associated protein) were detected by western blot.Results PRDX1 are over-expressed in the transfection groups, as compared to that in control groups (P<0.01). The transfected cells significantly have stronger capability for invasion and metastasis as compared to those in control groups. The immunofluorescence staining revealed that the expression of E-cadherin was decreased while the expression of Vimentin and Twist1 was increased in the transfected cells. Western blot showed that the expression of E-cadherin was decreased significantly in the transfection groups in compared with control group (P<0.01), while the expression of Twist1, MMP-9, N-cadherin and Vimentin was increased significantly (P<0.05).Conclusion PRDX1 can induce EMT process of colon carcinoma line SW480 cells, and promote its ability of invasion and metastasis.
Peroxiredoxin 1 (PRDX1);colon cancer;invasion;metastasis;Epithelial-Mesenchymal Transition (EMT)
国家自然科学基金面上项目(NO:81172295)。
傅仲学, 男,博士,教授,博士生导师,研究方向: 结直肠肿瘤,E-mail:fzx990521@sina.com。
R735.3
A
1000-2715(2015)01-0067-07

