3种辣椒超临界提取物的抑菌评价研究
刘佳等
摘 要 以红辣椒、青线椒和黄灯笼辣椒的超临界二氧化碳提取物为原料,进行体外抑菌试验,比较分析以上3种辣椒油树脂对鸡的大肠杆菌、沙门氏菌和金黄色葡萄球菌的抑菌作用。试验结果表明:海南黄灯笼辣椒提取物对大肠杆菌和沙门氏菌的抑菌效果均优于青辣椒和红辣椒;对金黄色葡萄球菌的抑菌作用与红辣椒相当,但低于青辣椒。青辣椒提取物的丙酮溶液对大肠杆菌、沙门氏菌和金黄色葡萄球菌的最低抑菌浓度分别为0.75、0.6和0.9 mg/mL,最低杀菌浓度分别为0.9、0.75和1.2 mg/mL;海南黄灯笼辣椒提取物的丙酮溶液对大肠杆菌、沙门氏菌和金黄色葡萄球菌的最低抑菌浓度分别为0.6、0.45和1.2 mg/mL,最低杀菌浓度分别为0.75、0.6和1.5 mg/mL;红辣椒提取物的丙酮溶液对大肠杆菌、沙门氏菌和金黄色葡萄球菌的最低抑菌浓度分别为0.9、0.9和1.2 mg/mL,最低杀菌浓度分别为1.2、1.2和1.5 mg/mL。
关键词 黄灯笼辣椒 ;超临界 ;抑菌
分类号 S641.3
Abstract The supercritical carbon dioxide method was used on red pepper,green pepper and Capsicum chinense for analyze the bacteriostatic action to E. coli, Salmonella and Staphylococcus aureus. Antibacterial test results show that: Capsicum extract inhibitory effect on E. coli and Salmonella are better than green peppers and red peppers; inhibitory effect on Staphylococcus aureus and red pepper equivalent, but less than green peppers. The acetone solution of green pepper extract minimum inhibitory concentration for E.coli, Salmonella, and Staphylococcus aureus were 0.75, 0.6 and 0.9 mg/ml, minimum bactericidal concentrations were 0.9, 0.75 and 1.2 mg/ml. The acetone solution of Capsicum extract minimum inhibitory concentrations for E. coli, Salmonella and Staphylococcus aureus were 0.6, 0.45 and 1.2 mg/ml, respectively, the minimum bactericidal concentration 0.75, 0.6 and 1.5 mg/ml. The acetone solution of red pepper extract minimum inhibitory concentration for E. coli, Salmonella, and Staphylococcus aureus were 0.9, 0.9 and 1.2 mg/ml, minimum bactericidal concentrations were 1.2, 1.2 and 1.5 mg/ml.
Keywords Capsicin chinese ; supercritical carbon dioxide method ; bacteriostatic action
黄灯笼辣椒,又名黄帝椒,中国辣椒,多年生草本植物,起源于亚马逊流域,是海南特有的特色品种之一[1]。味辣且有奇香,有巨大药用价值和开发潜力[2]。其主要药用有效成分为辣椒碱类物质,辣椒碱具有镇痛、抑菌、健胃消食、调节肠道菌群和提高免疫力的作用,并广泛应用于食品、医疗、美容等领域[3-5]。黄灯笼辣椒的超临界提取物黄灯笼辣椒油树脂,常温下为油状液体,是一种主要成分为辣椒碱的混合物[6]。以红辣椒、青线椒和黄灯笼辣椒的超临界二氧化碳提取物为原料,进行体外抑菌试验,本研究首次比较分析以上3种辣椒油树脂对鸡的大肠杆菌、沙门氏菌和金黄色葡萄球菌的抑菌作用。以期为后续在畜禽饲料添加方面的应用研究和开发利用提供参考。
1 材料与方法
1.1 材料
鲜黄灯笼辣椒,由中国热带农业科学院品种资源研究所蔬菜种质圃;鲜红辣椒,市售;鲜青线椒,市售;DHG-9246A型电热恒温鼓风干燥箱,上海精宏实验设备有限公司;HA221-40-11超临界CO2萃取装置,江苏南通华安超临界萃取有限公司;DT302A型电子天平,北京友仪四方科技发展有限公司;MH肉汤,北京奥博星生物技术有限公司;LB琼脂培养基,北京奥博星生物技术有限公司;麦康凯培养基,北京奥博星生物技术有限公司;营养琼脂,北京奥博星生物技术有限公司;Baird-Parker琼脂培养基,北京奥博星生物技术有限公司;SS琼脂培养基,北京奥博星生物技术有限公司;大肠杆菌、沙门氏菌、金黄色葡萄球菌,购自中国兽医微生物菌种保藏中心;HZ-9811K型双速恒温培养箱,上海百典仪器设备有限公司;SA-960-2型洁净工作台,上海上净净化设备有限公司;HVE-50型高压蒸汽灭菌器,日本Hirayama公司;培养皿、三角瓶、试管、培养基、过滤器、移液枪头、试管、稀释用蒸馏水等使用前均在 121℃下湿热高压灭菌20 min。每次开始试验前,开启超净工作台紫外灭菌灯,灭菌2 h。
1.2 方法
1.2.1 辣椒油树脂的提取
将鲜黄灯笼辣椒、红辣椒、青线椒洗净,剪开,55℃烘干48 h,磨粉,过40目筛,避光保存备用。应用超临界二氧化碳萃取装置,设定压力23 MPa,温度50℃,流量45 L/h,连续提取90 min,得到对应3种辣椒油树脂,4℃保存备用。
1.2.2 体外抑菌试验
1.2.2.1 培养基的制备
营养肉汤:称取营养肉汤干粉于锥形瓶中,加入蒸馏水,加热煮沸至完全溶解,121℃高压灭菌15 min,置于4℃冰箱冷藏备用;
营养琼脂培养基:称取培养基干粉于锥形瓶中,加入蒸馏水,加热煮沸至完全溶解,121℃高压灭菌15 min。冷却至50℃左右,倒入平皿中,待凝固后,置于4℃冰箱冷藏备用。
麦康凯培养基制备同营养琼脂。
Baird-parker琼脂基础培养基:称取Baird-parker琼脂基础培养基干粉于锥形瓶中,加入蒸馏水,加热煮沸至完全溶解,121℃高压灭菌15 min。冷却至50℃左右,加入亚碲酸盐卵黄增菌剂,摇匀,倒入平皿中,凝固后,置于4℃冰箱冷藏备用。
SS琼脂培养基:称取SS琼脂培养基干粉于锥形瓶中,加入蒸馏水,加热煮沸至完全溶解,不需要高压灭菌,冷却至50℃左右,倒入平皿中,凝固后,置于4 冰箱冷藏备用。
1.2.2.2 菌种的活化和菌种浓度确定
将大肠杆菌、沙门氏菌、金黄色葡萄球菌冷藏菌种分别接入装有2 mL营养肉汤的试管中,37℃培养48 h,得到活化菌悬液。活化后置于4℃冰箱中保存备用。
取6支试管,编号1~6,分别加入4.5 mL灭菌营养肉汤,取0.5 mL菌悬液加人到装有4.5 mL的1号试管中(此浓度为0.5 mL/5 mL=0.1,即为10-1),将10-1试管充分摇匀,吹吸菌液数次使其混匀。用移液枪吸取10-1试管中菌液0.5 mL,加入2号试管,吹吸菌液数次使其混匀(此浓度为10-2),重复操作以此类推,稀释到10-6。
分别吸取4、5、6号试管中的菌液0.2 mL置于营养琼脂培养基平皿上,用涂布器涂板,每一个稀释浓度菌液平行划板3个,置于37℃培养箱中培养48 h后,选取菌落数在30~300的同一稀释浓度梯度的培养基进行菌落计数,计算菌落平均数A。按公式:每毫升中菌落形成单位(cfu)=A×稀释倍数×5,计算出菌悬液浓度。取一定量的菌悬液,用灭菌营养肉汤稀释,配成浓度为10×105 cfu/mL的菌悬液待用。
1.2.2.3 最低抑菌浓度(MIC)和最低杀菌浓度(MBC)的确定
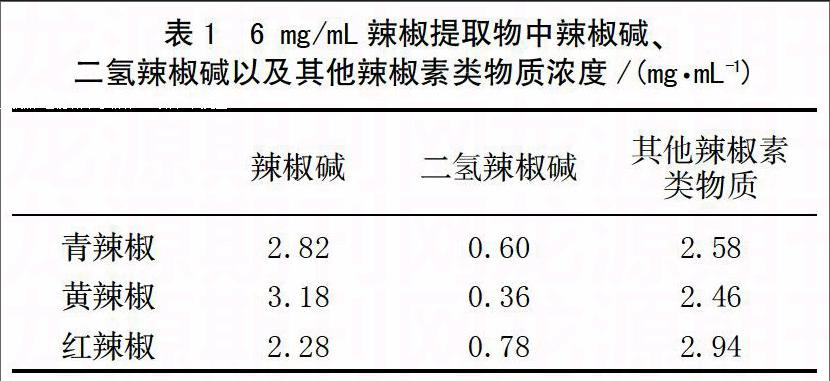
根据各辣椒提取物中辣椒素类物质的总含量,取辣椒提取物用0.22 μm微孔滤器过滤后,配成含辣椒素类物质浓度为6 mg/mL后备用,其中辣椒碱、二氢辣椒碱以及其他辣椒素类物质浓度见表1。
采用数据客观、便于操作的微量稀释法[7-9]对抑菌效果进行测定:在超净工作台上,取10支灭菌试管,分别标记为1~10,将辣椒提取物分别配制成3、1.5、1.2、0.9、0.75、0.6、0.45、0.375 mg/mL的营养肉汤稀释液,分别加入浓度为10×10-5 cfu/mL的大肠杆菌悬液,其中,9号试管为不加辣椒提取物贮备液的阳性对照,10号试管为阴性对照。每个浓度重复3次。将辣椒提取物分别配制成1.5、1.2、0.9、0.75、0.6、0.45、0.3、0.15 mg/mL的营养肉汤稀释液,分别加入浓度为10×10-5 cfu/mL的沙门氏菌悬液,其他步骤同上。1.5、1.2、0.9、0.75、0.6、0.45、0.375、0.3 mg/mL的营养肉汤稀释液,分别加入浓度为10×10-5 cfu/mL的金黄色葡萄球菌悬液,其他步骤同上。将所有试管置于37℃培养箱恒温培养24 h,在黑色背景下肉眼观察试验结果。判定MIC的方法参照李汉浠等的方法,试管内液体为混浊状即为有细菌生长,试管内液体呈澄清透明状即为无菌生长,根据浑浊与否用“+”、“-”表示。无菌生长的最低辣椒提取物溶液浓度即为最低抑菌浓度(MIC)[10]。
取最低抑菌浓度(MIC)以上各浓度的澄清状试管内液体0.2 mL,用涂布器均匀接种至无菌平皿琼脂培养基进行培养,将含有大肠杆菌的液体对应接种至麦康凯平皿培养基上,含有沙门氏菌的液体对应接种至SS琼脂平皿培养基上,含有金黄色葡萄球菌的液体对应接种至Baird-Parker 琼脂平皿培养基上,每个样品做3个重复,37℃恒温培育24 h,肉眼观察试验结果,琼脂培养基中菌落数少于5个的最低辣椒提取物浓度,即为该辣椒提取物的最低杀菌浓度(MBC)。
2 结果与分析
2.1 辣椒提取物对鸡大肠杆菌抑菌效果
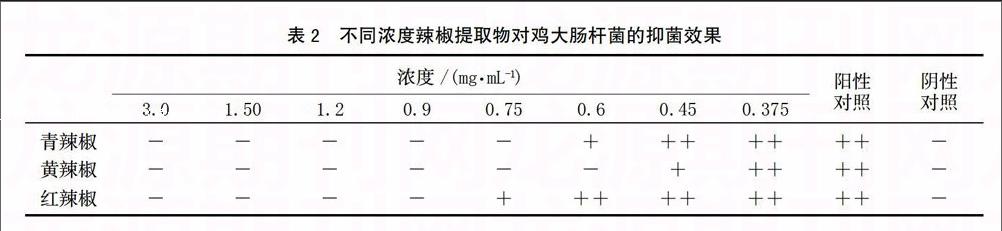
红、青、黄3种辣椒提取物对鸡的大肠杆菌均有抑菌效果,且抑菌效果随着浓度的升高呈增强趋势。黄灯笼辣椒提取物的抑菌效果优于青椒和红椒,最小抑菌浓度为0.6 mg/mL,辣椒提取物和红辣椒提取物的最低抑菌浓度分别为0.75和0.9 mg/mL。见表2。
2.2 辣椒提取物对鸡沙门氏菌抑菌效果
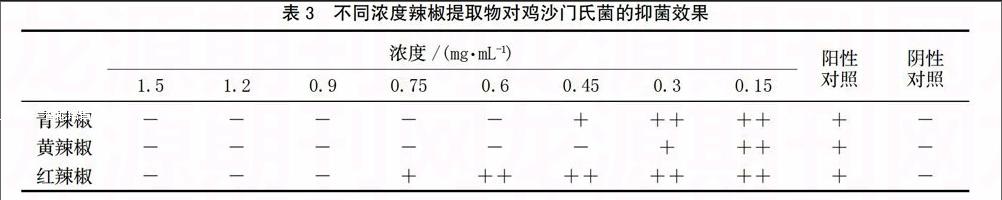
红、青、黄辣椒提取物对鸡沙门氏菌均有抑制效果,且抑菌效果不同,由强到弱依次为黄灯笼辣椒>青辣椒>红辣椒。其中,黄灯笼辣椒提取物的抑菌效果尤为显著,最低抑菌浓度仅为0.45 mg/mL,青辣椒和红辣椒提取物的最低抑菌浓度分别为0.6和0.9 mg/mL。见表3。
2.3 辣椒提取物对金黄色葡萄球菌抑菌效果
红、青、黄辣椒提取物对鸡沙门氏菌均有抑制效果,且抑菌效果存在差异,青辣椒提取物的抑菌效果优于红辣椒和黄灯笼辣椒,为0.9 mg/mL,红辣椒提取物和黄灯笼辣椒提取物的最低抑菌浓度分别为1.2 mg/mL。见表4。
2.4 最低抑菌浓度(MIC)和最低杀菌浓度(MBC)
红、青、黄3种辣椒提取物的最低抑菌浓度和最低杀菌浓度见表5。
3 讨论与结论
本试验研究表明,超临界二氧化碳萃取法所得的红、青、黄3种辣椒提取物都具有对金黄色葡萄球菌、沙门氏菌和大肠杆菌的抑制作用。其中,青辣椒提取物对大肠杆菌、沙门氏菌和金黄色葡萄球菌的最低抑菌浓度分别为0.75、0.6和0.9 mg/mL,最低杀菌浓度为0.9、0.75和1.2 mg/mL;黄灯笼辣椒提取物对大肠杆菌、沙门氏菌和金黄色葡萄球菌的最低抑菌浓度分别为0.6、0.45和1.2 mg/mL,最低杀菌浓度为0.75、0.6和1.5 mg/mL;红辣椒提取物对大肠杆菌、沙门氏菌和金黄色葡萄球菌的最低抑菌浓度分别为0.9、0.9和1.2 mg/mL,最低杀菌浓度为1.2、1.2和1.5 mg/mL。
Wahba等[11]的研究结果表明,辣椒可以有效抑制大肠杆菌、沙门氏菌和酵母菌的增长繁殖。吴影等[12]的研究表明,辣椒碱对金黄色葡萄球菌、枯草芽孢杆菌、大肠杆菌、啤酒酵母菌、黑曲霉和青霉菌等在酸碱条件下均有显著抑制效果,且对金黄色葡萄球菌的抑菌作用显著高于大肠杆菌。梁丽鹏等[13]的研究表明,辣椒碱浸取物对6种常见菌有抑制效果,尤其对金黄色葡萄球菌、大肠杆菌、啤酒酵母抑制作用明显,且抑菌效果与辣椒碱浸取物的浓度呈正相关,线性相关系数均在0.85以上。与本试验的结果一致。
刘锐等[14]的研究表明,辣椒的乙醇提取物对沙门氏菌等6种菌类有显著抑制作用。Dorantes等[15]证明,辣椒提取物对沙门氏菌和金黄色葡萄球菌等5种菌有抑制作用,其有效成分之一可能为肉桂酸类物质。这与本试验的研究结果一致。
曹晓等[16]的辣椒乙醇提取物试验证明,辣椒对金黄色葡萄球菌等12种常见菌有选择性抑制作用,其中对金黄色葡萄球菌的最低抑菌浓度为0.25 mg/mL。这与本试验的定量试验结果存在偏差,可能与所用提取溶剂不同有关,也可能与乙醇溶液本身存在抑菌效果有关。
综上所述:黄灯笼辣椒提取物对鸡大肠杆菌和沙门氏菌的抑菌效果均优于青辣椒和红辣椒;对金黄色葡萄球菌的抑菌作用与红辣椒相当,但低于青辣椒。
参考文献
[1] 李建国. 海南岛辣椒属(Capsicum)种质资源. 见:马 阳. 中国跨世纪菜蓝子工程建设. 海南:南海出版公司,1998:330-332.
[2] 李海龙,张俊清,赖伟勇. 海南黄灯笼椒与不同品种辣椒的辣椒素含量测定[J]. 中国野生植物资源,2012,31(4):32-34.
[3] 高 艳. 辣椒素的提取及其应用研究进展[J]. 食品与机械,2011,27(1):162-165.
[4] 马昭朝,王孝蓉,赵志刚. 辣椒碱软膏[J]. 中国新药杂志,2005,14(2):235-236.
[5] 魏玉西. 辣椒碱的抑菌活性研究[J]. 食品科学,2006,27(8):76-78.
[6] 黄启强. 高辣度辣椒油树脂(辣椒精)的提取研究[J]. 食品工业科技,2005,26(6):58-65.
[7] Clinial and Laboratory Standards Institute(CLSI)/NCCLS.Performance standards for antimocr-obial susceptibity testing standards: Fifteenth informational supplement[S]. 2005. 100-115.
[8] 李仪奎. 中药药理实验方法学[M]. 上海:上海科技出版社,1991:291.
[9] 杨 素,何建群. K-B琼脂扩散法与微量稀释法两种药敏试验方法的比较[J]. 衡阳医学院学报,1998,26(2):207-208.
[10] 李汉浠,任赛赛,李 勇,等. 枫杨萘醌对常见菌的抗菌谱、最低抑菌浓度和最低杀菌浓度研究[J]. 时珍国医国药,2012(6):1 422-1 424.
[11] Wahba N M, Ahmed A S, Ebraheim Z Z. Antimicrobial effects ofpepper,parsley,and dill and their roles in the microbiological qual-ity enhancement of traditional Egyptian Kareish cheese[J]. Food-borne Pathog Dis, 2010, 7(4): 411-418.
[12] 吴 影,古绍彬,张永杰. 辣椒中辣椒碱抑菌作用的研究[J]. 安徽农业科学,2007,29:9 130-9 131.
[13] 梁丽鹏. 辣椒果实中辣椒碱的含量、动态变化及其浸取物的抑菌效果研究[D]. 扬凌: 西北农林科技大学,2008.
[14] 刘 锐,张 敏. 辣椒乙醇提取液的抑菌活性研究[J]. 安徽农业科学,2010,38(6):3 135-3 136.
[15] Dorantes L, Araujo J, Carmona A. Effect of Capsicum Extracts and Cinnamic Acid on the Growth of Some Important Bacteria in DairyProducts[M]. Food Engineering: Integrated Approaches, 2008: 337-344.
[16] 曹 晓,朱显峰. 辣椒提取液的抑菌活性分析[J]. 食品科技,2007(11):110-112.

