朱砂七多糖对雏鸡十二指肠组织形态的影响
安 乐,王 娜,刘美琴,高红霞,牟素菁,郭浩杰,刘建新,张为民,卿素珠
(西北农林科技大学动物医学院,陕西杨凌712100)
近年来,针对中药多糖的免疫药理学研究成为热点,已经证实,其具有促进免疫调节、抗肿瘤、抗病毒、抗菌、抗辐射、抗衰老及抗寄生虫等多种生物活性,对促进机体特异性免疫与非特异性免疫都有广泛的影响;同时,多糖为天然产物,具有毒副作用小、无残留、不产生耐药性等优点,因而应用前景广阔。中药多糖作为生物反应调节剂,可以激活T/B 淋巴细胞、巨噬细胞、自然杀伤(NK)细胞等免疫细胞,促进多种细胞因子的释放,促进抗体的生成,激活补体系统等[1]。多糖除了具有上述生物活性外,研究表明,有些植物多糖如芦荟多糖、大枣多糖及人参茎叶多糖等还可促进动物肠道的发育[2-4]。
朱砂七为蓼科植物Polygonum cillinerve(Nakai)Ohwl的块根,属于“太白七药”之一,因其具有显著的止血止泻、清热解毒和去风湿等功效而为民间常用。现代药理学研究证实其含有大黄素、大黄素葡萄糖苷和大黄素甲醚等蒽醌类物质。研究表明,朱砂七水浸液对多种肠道及呼吸道病毒有较好的广谱抗病毒功能;通过直接杀灭和抑制单纯疱疹病毒对细胞的吸附、侵入而发挥体外抗该病毒的作用[5];朱砂七中的总蒽醌对流感病毒有一定的抑制作用[6]。近年来的研究发现蒽醌类化合物具有抑制肿瘤的发生、促进肿瘤凋亡的作用[7]。而有关朱砂七多糖的研究则报道较少,Cui J J等[8]的研究表明,给小鼠饲喂朱砂七粗多糖能显著克服环磷酰胺诱导的免疫抑制,通过提高免疫抑制模型小鼠的过氧化酶、谷胱甘肽过氧化物酶、总氧化能力及过氧化氢酶水平来预防免疫系统的氧化损伤。王晓梅等的研究显示,朱砂七多糖在浓度为5 mg/mL 时,对O-2和·OH自由基清除率最高,分别为63%和48%,在浓度为0.09 mg/mL 时对亚硝酸盐的清除率最高(67.03%),表明朱砂七多糖具有较强的抗氧化活性[9]。本课题组的前期研究初步证实,PCP 具有体外抗猪传染性胃肠炎病毒(TGEV)的作用[10]。有关朱砂七多糖对动物肠道组织发育及在疫病防治方面的研究至今尚无报道,因此本试验就朱砂七多糖对雏鸡十二指肠的组织发育及黏膜免疫相关细胞分布的影响进行研究,为朱砂七资源的开发和综合利用提供依据。
1 材料与方法
1.1 材料
1.1.1 供试多糖 朱砂七多糖,由本校动物医学院中兽医学研究室制备并提供[13]。
1.1.2 试验动物与饲养管理 1 日龄非免疫罗曼公鸡160只,购自陕西省武功镇某孵化场,饲喂日粮采用华秦911A 蛋小鸡配合饲料为陕西华秦饲料有限公司生产。采用立体笼养,自由采食和饮水。
1.1.3 主要试剂与仪器 苏木色精、甲苯胺蓝为上海蓝季科技发展有限公司产品;碱性品红和伊红为Solarbio公司产品;LEICA RM 2126型旋转石蜡切片机为徕卡仪器有限公司生产;Motic数码显微镜为厦门麦克奥迪实业有限公司生产;电热恒温水浴锅为北京市长风仪器仪表公司生产;GTK-2002 自动摊片烤片机为西安瑞丰仪器设备有限公司产品。
1.2 方法
1.2.1 动物分组及处理 1 日龄罗曼公鸡常规饲养1周后,随机分为4组,每组40只,第Ⅰ、Ⅱ、Ⅲ组为朱砂七多糖试验组,第Ⅳ组为空白对照组。每天清晨在鸡空腹时,分别在第Ⅰ、Ⅱ、Ⅲ组的饮水中每天加 入 生 药 含 量 分 别 为 低(0.3 g/kg)、中(0.5 g/kg)、高(0.7g/kg)剂量的朱砂七多糖,让鸡自由饮用。空白对照组(IV 组)不加药液,让鸡自由饮水。
1.2.2 样品采集 分别于给药后的7、14、21d,每组随机选取6只雏鸡,颅面动脉放血致死,迅速取十二指肠,用新配制的生理盐水冲洗,放入Bouin′s液中固定48h以上。
1.2.3 十二指肠组织形态观察 固定好的十二指肠组织按常规组织学方法制备石蜡切片,肠管连续横切,制得3套切片,分别行HE 染色、PAS染色和肥大细胞甲苯胺蓝染色。肠道形态观察参照Fleming等[11]的方法进行,具体步骤:挑选五张染色清晰的切片,每张切片选取10根最长且走向平直、伸展良好的绒毛,通过Motic数码显微图像处理系统进行定量分析,测量其绒毛高度(villum heigh,VH)及与之相连的隐窝深度(crypt depth,CD),并计算绒毛高度与隐窝深度之比值(VH/CD)。十二指肠黏膜上皮内淋巴细胞(intraepithelial lymphocyte,IEL)、杯状细胞(goblet cell,GC)和肥大细胞(mast cell,MC)数量的统计参考文献[12]介绍的方法进行。
2 结果
2.1 朱砂七多糖对雏鸡十二指肠发育的影响
镜下可见,雏鸡十二指肠组织结构清晰、分层明显,黏膜上皮和固有层向肠腔突出形成指状的肠绒毛(图1)。给药后7d,各剂量PCP组和对照组雏鸡十二指肠绒毛分布均匀、排列整齐,隐窝较浅;给药后14d,各剂量的PCP组雏鸡十二指肠绒毛高度明显增大,其隐窝深度均小于对照组(图1);给药后21d,各组雏鸡的肠壁进一步变粗,管径增大,其组织学结构与14d 时的相近。
经Motic数码显微图像处理系统测量各组雏鸡的绒毛高度(VH)及与之相连的隐窝深度(CD),并计算绒毛高度与隐窝深度的比值(VH/CD),统计结果见表1。7d时低、中、高剂量PCP 组绒毛高度均显著高于对照组(P<0.05),仅高剂量PCP 组隐窝深度显著低于对照组(P<0.05),低、中剂量PCP组绒毛高度与隐窝深度比值分别显著(P<0.05)和极显著高于对照组(P<0.01);14d时低、中剂量PCP组绒毛高度显著高于对照组(P<0.05),高剂量PCP组绒毛高度极显著高于对照组(P<0.01);低、中剂量PCP组隐窝深度分别显著(P<0.05)和极显著低于对照组(P<0.01),而中、高剂量PCP绒毛高度与隐窝深度比值均极显著高于对照组(P <0.01);21d时低、中、高剂量PCP 组绒毛高度均极显著高于对照组(P<0.01),低、中剂量PCP组隐窝深度分别显著(P<0.05)和极显著低于对照组(P<0.01),中、高剂量PCP组绒毛高度与隐窝深度比值均显著高于对照组(P<0.05)。
2.2 朱砂七多糖对雏鸡十二指肠黏膜上皮内淋巴细胞和杯状细胞数量的影响
通过HE染色切片的观察,黏膜上皮内杯状细胞呈高脚玻璃杯状、核位于细胞基部,胞质呈空泡状;黏膜上皮内淋巴细胞则散布于柱状细胞之间,细胞核圆形、大而深染;PAS染色后,杯状细胞胞质呈紫红色,结合两种染色观察结果,统计各组雏鸡十二指肠黏膜上皮内淋巴细胞和杯状细胞的数量(表2)。7d时低、中、高剂量PCP组黏膜上皮内淋巴细胞数量均显著高于对照组(P<0.01);14d时中、高剂量PCP组黏膜上皮内淋巴细胞数量分别显著(P<0.05)和极显著(P<0.01)高于对照组;21d 时低、中、高剂量PCP 组黏膜上皮内淋巴细胞数量均极显著高于对照组(P<0.01)。7d 时中、高剂量PCP组黏膜上皮内杯状细胞数量分别是极显著(P<0.01)和显著(P<0.05)高于对照组;14d时中剂量PCP组黏膜上皮杯状细胞数量显著(P<0.05)高于对照组;21d时中、高剂量PCP 组黏膜上皮内杯状细胞数量分别显著(P<0.05)和极显著(P<0.01)高于对照组。
2.3 朱砂七多糖对雏鸡十二指肠肠壁肥大细胞数量的影响
经甲苯胺蓝染色后,肥大细胞呈圆形或卵圆形,核呈空泡状或淡蓝色,胞质内充满蓝紫色颗粒。十二指肠壁中肥大细胞主要位于黏膜固有层和黏膜下层,肌层之间有零星分布。对各组雏鸡十二指肠壁中肥大细胞分布进行计数(表3)。7d时低、中、高剂量PCP组肠壁肥大细胞数量与对照组差异不显著;14d时中、高剂量PCP 组肠壁肥大细胞数量均显著高于对照组(P<0.05);21d时低剂量PCP 组肠壁肥大细胞数量显著高于对照组(P<0.05),而中、高剂量PCP组肠壁肥大细胞数量则均极显著高于对照组(P<0.01)。
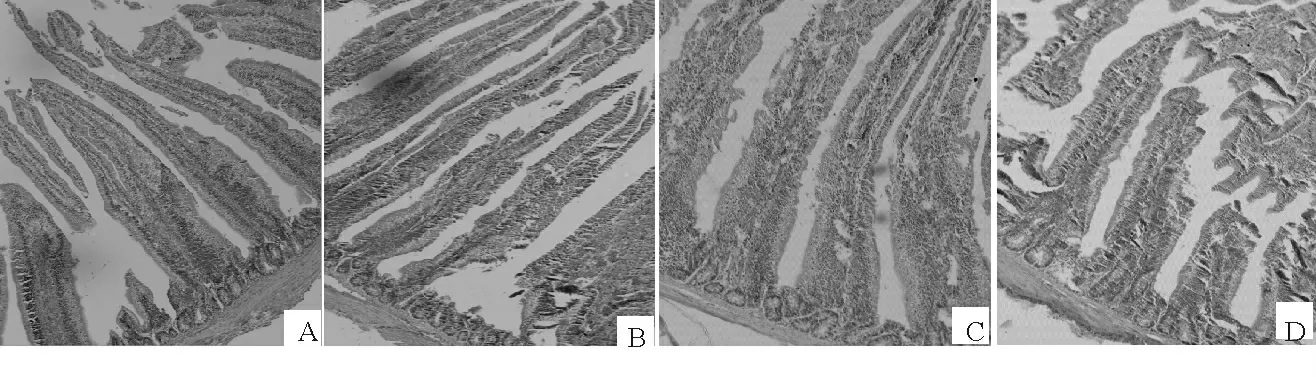
图1 给药后14d 各组雏鸡十二指肠组织学结构(100×)Fig.1 The histological structure of chicken duodenum on days 14after the PCP treatment(100×)
表1 朱砂七多糖对雏鸡十二指肠绒毛高度、隐窝深度及二者比值的影响Table 1 Effects of PCP on the villum height(VH),the crypt depth(CD)and the ratio of villum height to crypt depth(VH/CD)in chicken duodenum
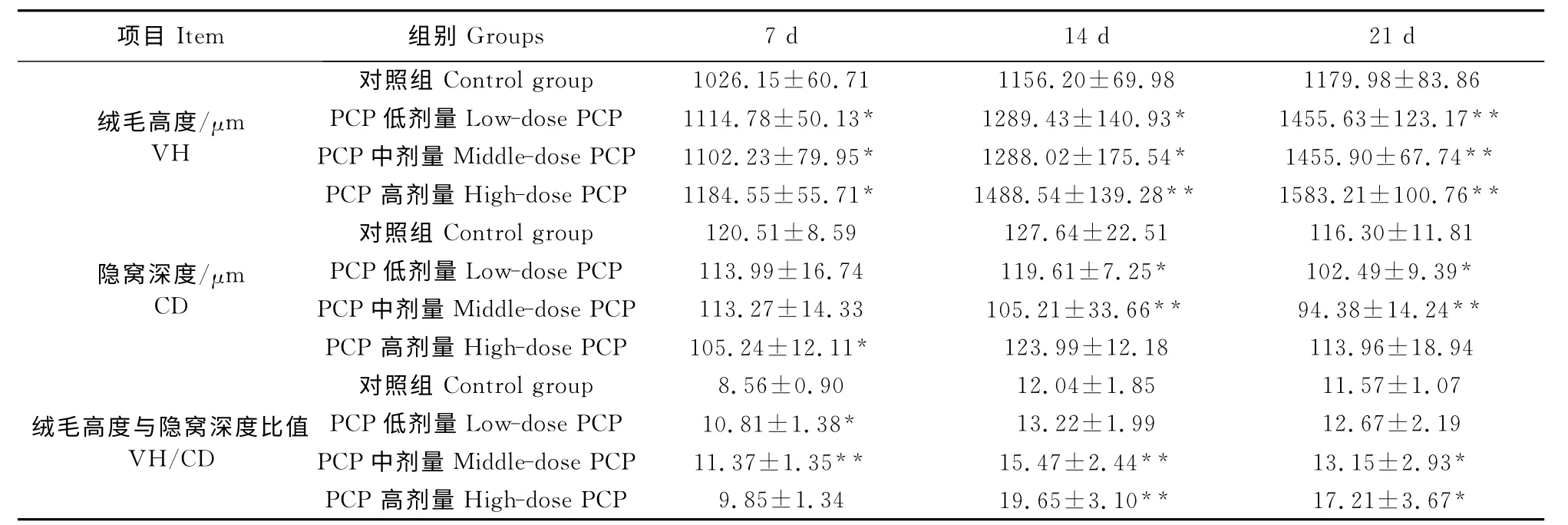
表1 朱砂七多糖对雏鸡十二指肠绒毛高度、隐窝深度及二者比值的影响Table 1 Effects of PCP on the villum height(VH),the crypt depth(CD)and the ratio of villum height to crypt depth(VH/CD)in chicken duodenum
注:“*”表示与对照组相比差异显著(P<0.05);“**”表示与对照组相比差异极显著(P<0.01)。Note:Compared with the control group,“*”means significant difference(P<0.05);and“**”means extremely significant difference(P<0.01).
项目Item 组别Groups 7d 14d 21d对照组Control group1026.15±60.71 1156.20±69.98 1179.98±83.86绒毛高度/μmPCP低剂量Low-dose PCP 1114.78±50.13* 1289.43±140.93* 1455.63±123.17**VHPCP中剂量Middle-dose PCP 1102.23±79.95* 1288.02±175.54* 1455.90±67.74**PCP 高剂量High-dose PCP 1184.55±55.71* 1488.54±139.28** 1583.21±100.76**对照组Control group 120.51±8.59 127.64±22.51 116.30±11.81隐窝深度/μmPCP低剂量Low-dose PCP 113.99±16.74 119.61±7.25* 102.49±9.39*CDPCP中剂量Middle-dose PCP 113.27±14.33 105.21±33.66** 94.38±14.24**PCP 高剂量High-dose PCP 105.24±12.11* 123.99±12.18 113.96±18.94对照组Control group 8.56±0.90 12.04±1.85 11.57±1.07绒毛高度与隐窝深度比值PCP低剂量Low-dose PCP 10.81±1.38* 13.22±1.99 12.67±2.19 VH/CDPCP中剂量Middle-dose PCP 11.37±1.35** 15.47±2.44** 13.15±2.93*PCP 高剂量High-dose PCP 9.85±1.34 19.65±3.10** 17.21±3.67*
表2 朱砂七多糖对雏鸡十二指肠黏膜上皮内淋巴细胞和杯状细胞数量的影响Table 2 Effects of PCP on number of intraepithelial lymphocytes(IEL)and goblet cells(GC)in duodenum epithelium mucosa of chickens

表2 朱砂七多糖对雏鸡十二指肠黏膜上皮内淋巴细胞和杯状细胞数量的影响Table 2 Effects of PCP on number of intraepithelial lymphocytes(IEL)and goblet cells(GC)in duodenum epithelium mucosa of chickens
注:细胞计数方法:以统计100个黏膜上皮柱状细胞间IEL和GC的数量为准。“*”表示与对照组相比差异显著(P<0.05);“**”表示与对照组相比差异极显著(P<0.01)。Note:Cell counting method:the number of GC and IEL were counted between 100columnar cells in epithelium mucosa.Compared with control group,“*”means significant difference(P<0.05),and“**”means extremely significant difference(P<0.01).
项目Item 组别Groups 7d 14d 21d对照组Control group12.80±1.64 19.00±1.58 24.80±1.92上皮内淋巴细胞PCP低剂量Low-dose PCP 15.00±1.58* 20.00±1.58 27.40±1.14**IELPCP中剂量Middle-dose PCP 16.40±1.14* 21.00±1.58* 28.20±1.30**PCP 高剂量High-dose PCP 17.20±1.30* 22.00±1.58** 30.00±1.58**对照组Control group 19.00±1.58 20.00±1.58 23.00±1.22杯状细胞PCP低剂量low-dose PCP 20.00±1.58 21.00±2.92 25.00±1.58 GCPCP中剂量Middle-dose PCP 22.80±1.92** 23.80±2.39* 27.00±2.55*PCP 高剂量High-dose PCP 21.80±1.92* 21.20±2.49 28.00±1.58**
表3 朱砂七多糖对雏鸡十二指肠肠壁肥大细胞数量的影响Table 3 Effect of PCP on number of mast cells in chicken duodenum walls
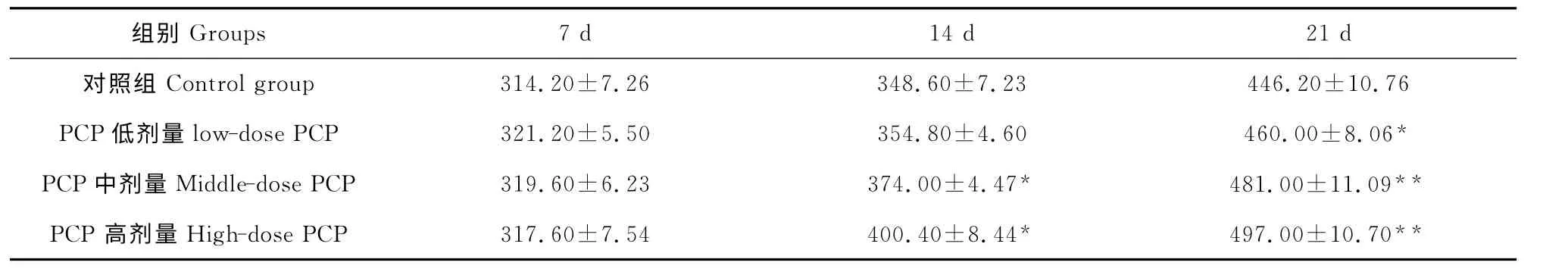
表3 朱砂七多糖对雏鸡十二指肠肠壁肥大细胞数量的影响Table 3 Effect of PCP on number of mast cells in chicken duodenum walls
注:“*”表示与对照组相比差异显著(P<0.05);“**”表示与对照组相比差异极显著(P<0.01)。Note:Compared with the control group,“*”means significant difference(P<0.05),and“**”means extremely significant difference(P<0.01).
组别Groups 7d 14d 21d对照组Control group314.20±7.26 348.60±7.23 446.20±10.76 PCP低剂量low-dose PCP 321.20±5.50 354.80±4.60 460.00±8.06*PCP中剂量Middle-dose PCP 319.60±6.23 374.00±4.47* 481.00±11.09**PCP 高剂量High-dose PCP 317.60±7.54 400.40±8.44* 497.00±10.70**
3 讨论
3.1 朱砂七多糖对雏鸡十二指肠黏膜形态的影响
动物小肠肠壁的黏膜及黏膜下层共同向管腔突出形成环形的褶皱、皱襞上有许多根指状突起-小肠绒毛,而肠绒毛的表面是密集微绒毛组成的纹状缘,这些结构极大地增大了小肠黏膜的吸收表面积。因此,小肠组织结构的完整性是其消化吸收功能的生理学基础,其中小肠的绒毛高度、隐窝深度、肠壁厚度及绒毛表面积已成为衡量小肠消化吸收功能的重要指标。绒毛变短,说明肠黏膜上皮吸收细胞数量减少,其对营养物质的消化和吸收能力降低;肠隐窝是由肠绒毛基部上皮下陷至固有层内形成的管状结构,其深度的变化提示隐窝细胞生长速度的快慢,在一定程度上影响消化和吸收机能[13]。而绒毛高度与隐窝深度的比值可综合反映小肠黏膜的吸收功能状况,比值下降表示黏膜受损,提示机体消化吸收功能降低,影响动物的生长发育;比值上升则表明黏膜状态有所改善,机体消化吸收功能增强,促进机体生长发育[14]。
研究表明,有些植物多糖可促进动物肠道组织的发育。乔家运等人研究了仔猪日粮中添加芦荟多糖(aloe vera polysaccharide,AVP)后对肠道形态的影响,结果表明,日粮中添加芦荟多糖后可提高十二指肠段、空肠前段和空肠后段的绒毛高度[2]。王留等研究大枣多糖对保育猪肠道微生物菌群及肠道组织形态的影响,结果表明,饲料中添加大枣多糖1 000mg/kg和1 500mg/kg时能够促进肠道内双歧杆菌和乳酸杆菌的繁殖,并可通过显著增加仔猪小肠各段的绒毛长度和降低肠道的隐窝深度提高肠道的消化吸收能力[3]。张勇等[15]报道证实在雏鸡饲料中添加不同剂量的黄芪多糖能增加肉鸡十二指肠绒毛高度、降低隐窝深度。本研究结果表明,饮水中添加朱砂七多糖7d后,各试验组雏鸡十二指肠的绒毛高度均显著高于对照组,高剂量PCP组隐窝深度显著低于对照组,低、中剂量PCP 组绒毛高度与隐窝深度比值显著高于对照组;给药14d和21d后,各试验组雏鸡十二指肠的绒毛高度显著提高,隐窝深度则显著降低,绒毛高度与隐窝深度比值显著增大,表明添加PCP在一定程度上能促进雏鸡十二指肠对营养物质的吸收,有利于雏鸡的生长发育。
3.2 朱砂七多糖对雏鸡十二指肠壁组织内黏膜免疫相关细胞分布的影响
肠道黏膜及黏膜下层有大量的淋巴细胞和肥大细胞存在,它们与黏膜上皮内杯状细胞一起发挥重要的黏膜免疫功能,其中肠黏膜柱状上皮内淋巴细胞作为最早接触外来抗原的免疫活性细胞,承担关键的黏膜免疫屏障的角色[16],该种细胞数量的增加提示机体的肠道黏膜免疫功能状态有所提高;杯状细胞的主要功能是分泌黏液(成分主要为黏蛋白),对小肠黏膜上皮具有保护和润滑作用,此外,黏液成分中的黏蛋白以及柱状细胞分泌的复合糖蛋白结合形成黏膜表面的细胞衣(糖衣),后者与膜分子构型中的蛋白质、脂质牢固嵌合,形成黏膜表面一道重要的物理屏障。肥大细胞广泛存在于机体各处的结缔组织中,除了参与机体的过敏和炎症反应外,在先天性免疫和获得性免疫中也发挥着重要作用,因此肥大细胞也是机体中一种重要的免疫活性细胞[17]。有研究显示,日粮中添加黄芪多糖可显著增加罗非鱼肠道黏液细胞和上皮内淋巴细胞的数量,表明饲料中添加黄芪多糖可以提高罗非鱼机体的特异性免疫功能[18]。黄其春等的研究显示,日粮中添加2g/L和2.5g/L 的银杏叶提取物可显著提高十二指肠上皮内淋巴细胞、肥大细胞以及杯状细胞的数量而有助于增强肉仔鸡十二指肠的黏膜免疫功能[19]。本试验结果显示,添加低、中、高剂量的朱砂七多糖7、14、21d后,可显著增加雏鸡十二指肠黏膜上皮内淋巴细胞数量;添加PCP 7d后,中、高剂量组雏鸡十二指肠黏膜上皮内杯状细胞数量显著高于对照组,添加14d后,各剂量PCP组黏膜上皮杯状细胞数量均显著高于对照组,添加21d后,中、高剂量PCP组黏膜上皮内杯状细胞数量显著增高。添加PCP 14d时,中、高剂量PCP组肠壁肥大细胞数量均显著高于对照组,而添加21d后各剂量PCP组肠壁肥大细胞数量均显著高于对照组。说明PCP 可通过增加雏鸡十二指肠壁组织黏膜免疫相关细胞(IEL、GC和MC)数量提高其黏膜免疫屏障功能。
[1] 尚庆辉,解玉怀,张桂国,等.植物多糖的免疫调节作用及其机制研究进展[J].动物营养学报,2015,27(1):49-58.
[2] 乔家运,高 欣,王文杰.日粮添加芦荟多糖对断奶仔猪肠道形态和血清激素水平的影响[J].饲料工业,2014,35(1):44-46.
[3] 王 留,王向国.大枣多糖对保育猪肠道微生物菌群及肠道组织形态的影响[J].养猪,2014(6):7-8.
[4] 闫晓刚,张芳毓,郎洪彦,等.人参茎叶多糖对雏鸡小肠黏膜组织发育和免疫细胞的影响[J].畜牧兽医学报,2015,46(1):144-155.
[5] 王育良,陆绵绵.中药抗单纯疱疹病毒的实验研究[J].中国眼科杂志,1995,5(2):78-82.
[6] 郭惠玲,赵 琦.朱砂七抑制流感病毒A 的试验研究[J].陕西中医,2006,27(3):351-353.
[7] 赵 勤,卫 昊,胡 锐,等.朱砂七总蒽醌对S180荷瘤小鼠凋亡基因表达的影响[J].天津中医药志,2013,30(10):609-611.
[8] Cui J J,Yuan J F,Zhang Z Q.Anti-oxidation activity of the crude polysaccharides isolated fromPolygonum cillinerve(Nakai)Ohwi in immunosuppressed mice[J].J Ethnopharmaco,2010,132(2):512-517.
[9] 王晓梅,李宗孝,任莉君.朱砂七多糖的抗氧化作用研究[J].安徽农业科学,2010,38(34):19346-19347.
[10] 胡 蓉,郭浩杰,曹 志,等.朱砂七多糖体外抗猪传染性胃肠炎病毒作用研究[J].农业生物技术学报,2015,23(2):253-261.
[11] Fleming S E,Zambell K L,Fitch M D.Glucose and glutamine provide similar proportions of energy to mucosal cells of rat small intestine[J].Am J Physiol:Gastrointest Liver Physiol,1997,4(36):G968-G978.
[12] 中华医学会.临床技术操作规范病理学会分册(M).北京:人民军医出版社,2008.
[13] 张吉鹍.粗饲料分级指数参数的模型化及粗饲料科学搭配的组合效应研究[D].内蒙古呼和浩特:内蒙古农业大学,2004.
[14] 肖 曼,高振华,李兴华,等.酵母培养物对肉仔鸡生长性能、肠黏膜结构及肠道菌群的影响[J].动物营养学报,2013,25(7):1624-1631.
[15] 张 勇,李 冰,朱宇旌,等.黄芪多糖对肉鸡生长性能和小肠黏膜形态的影响[J].沈阳农业大学学报,2009,40(4):453-457.
[16] 马 岩,李运曼.中药对肠道黏膜免疫系统调节作用的研究进展[J].临床合理用药,2013,6(6):168-169.
[17] Stenton G R,Vliagoftis H,Befus A D.Role of intestinal mast cells in modulating gastrointestinal pathophysiology[J].Ann Allergy Asthma Immunol,1998,81(1):1-11.
[18] 黄玉章,林 旋,王全溪,等.黄芪多糖对罗非鱼肠绒毛形态结构及肠道免疫细胞的影响.动物营养学报[J],2010,22(1):108-116.
[19] 黄其春,陈 彤,郑新添,等.银杏叶提取物对肉仔鸡十二指肠黏膜免疫的调节作用[J].西北农林科技大学学报,2011,39(11):25-30.

