可视化核酸恒温扩增技术在日本血吸虫病筛查和诊断中的应用
宋旭日,冯惊涛,2,邢微微,喻鑫玲
(1.岳阳职业技术学院医学基础部,湖南岳阳414000;2.湖南康润药业有限公司,湖南岳阳414000;3.军事医学科学院基础医学研究所基因组工程研究室,北京100850;4.湖南省血吸虫病防治所免疫诊断研究室,湖南岳阳414000)
日本血吸虫病是一种对人体健康危害严重、防治难度大、且影响范围广的寄生虫病,流行于我国、日本和菲律宾等地,其病原体是日本血吸虫(Schistosoma japonicum)。目前,由于缺乏对日本血吸虫病的简单且有效的诊断方法,我国基层血防单位仍主要采用Kato-Katz涂片粪检法、毛蚴孵育法(MHT)等传统病原学方法对日本血吸虫病进行诊断[1],这些方法不但费时、费力,而且疫区群众依从性低;更为重要的是,随着吡喹酮的应用,疫区群众的感染率和感染度明显下降,这些方法的敏感性也随之下降,极易造成漏检[1-2],不利于日本血吸虫病的防治。
日本血吸虫的免疫类检测方法有皮试、尾蚴膜试验、环卵沉淀试验(COPT)、间接血凝试验(IHA)、多种酶联免疫吸附试验(ELISA)和直接免疫检测等许多方法,这些方法或特异性不强、或敏感性不高等,限制了它们的应用[1,3-4]。血吸虫核酸检测是诊断血吸虫病潜在的优良检测方法,该类方法不仅用时少、成本低,而且具有确诊血吸虫病患者的意义。目前,以PCR 法或荧光定量PCR法为基础的核酸扩增技术已被引入血吸虫诊断领域,国内外均有相关报道。但是,PCR或荧光定量PCR 等方法对仪器设备和技术人员的要求相对都比较高,且结果判定也较为复杂,在基层血防单位难以推广。而核酸恒温扩增技术对仪器设备要求相对比较低、操作也比较简单[5-6],为解决这一问题提供了潜在的可能性。环介导核酸恒温扩增(LAMP)技术是目前应用比较广泛的核酸恒温扩增技术之一,本课题组开发的“可视化日本血吸虫核酸恒温扩增检测试剂”便是依托该技术的检测体系,已经在日本血吸虫感染性钉螺的检测中获得了良好的应用。通过建立类似的检测体系,检测经日本血吸虫尾蚴感染的新西兰大白兔等试验,探索可视化核酸恒温扩增检测技术在日本血吸虫病筛查和诊断中应用的可能性。
1 材料与方法
1.1 材料
日本血吸虫感染性钉螺、新西兰大白兔由湖南省血吸虫病防治所提供。
1.2 方法
1.2.1 日本血吸虫感染兔模型建立和样本采集
1.2.1.1 获得日本血吸虫尾蚴 将30只感染性钉螺置于三角烧瓶里加水至瓶口1cm~2cm 处,瓶口放尼龙筛网防止钉螺爬出。等到尾蚴逸出至肉眼可见乳白一层后,用解剖针小心挑取尾蚴至盖玻片上,解剖镜下计数。
1.2.1.2 用日本血吸虫尾蚴感染新西兰大白兔 取2 kg左右的清洁级新西兰大白兔21只,随机分为7组,每组3只。第1组作为对照组,第2组~第7组用腹壁拔毛贴片法[7]分别感染日本血吸虫尾蚴50、100、200、500、1 000、2 000 条。于 感 染 后 第7 天 和 第7周[8],每只兔子各取血清1.5mL~2mL,于-20℃冻存备用。
1.2.2 兔血清或血浆中的基因组DNA 提取
1.2.2.1 NaOH 煮沸法 取兔血清或血浆50μL,加入等体积的100mmol/L NaOH,充分混匀,沸水浴30 min,水浴过程中,颠倒混匀混合液3~5次;水浴后,将样本静置冷却,取上清10μL,用等体积的1mmol/L Tris-HCl(pH 8.0)中和,置-20℃冰箱保存备用。
1.2.2.2 Qiagen试剂盒法 取兔血清或血浆500 μL,用试剂盒QIAamp DNA Blood Mini Kit抽提基因组DNA,操作步骤按照说明书进行,提取的基因组DNA于-20℃冰箱保存备用。
1.2.2.3 酚氯仿抽提法 取兔血清或血浆500μL,加 入1 000μL 提 取 缓 冲 液(0.15 mol/L NaCl、10 mmol/L EDTA、10 mmol/L Tris-HCl、2%的SDS、5μg/mL鲑鱼精DNA、250μg/mL蛋白酶K,pH7.6),55℃下消化10min,等体积酚氯仿异戊醇(25∶24∶1)抽提2次,12 000r/min离心5min,弃上清,再用氯仿异戊醇(24∶1)抽提,12 000r/min离心5min,弃上清,加入1/10体积NaAc(3mol/L)和2倍体积冷无水乙醇,在-20℃下沉淀30min,12 000r/min离心10min,弃上清,常温下750mL/L乙醇洗沉淀2次,第1次浸泡2h,第2 次浸泡30 min,并不时振荡。12 000r/min离心5 min,弃上清,60℃温箱干燥10 min,加20μL TE缓冲液溶解沉淀,于-20℃冰箱保存备用[8]。
1.2.2.4 TaKaRa 通用型快速试剂盒法 取兔血清或血浆500μL,用试剂盒TaKaRa MiniBEST Universal Genomic DNA Extraction Kit Ver.3.0抽提基因组DNA,操作步骤按照说明书进行,提取的基因组DNA于-20℃冰箱保存备用。
1.2.3 可视化核酸恒温扩增反应体系的建立 引物设计:选定日本血吸虫特异性基因片段SJR2(AY027869),用软件PrimerExplorer V4设计该基因的LAMP技术引物(内引物F1P:GAT CAA TAG AGT CAA ACG CCG CCT TTC AGA CGC CCA ACA A,B1P:TTG AAA GGT GTA CCG GAG AAG TCC ATA AGC TCT AAC ACG ACA;外引物F3:GAC AGG TTC TGG AAC ATA GG,B3:GGT CAA TTC CGA AGA CAA TC),交由上海生工生物工程(上海)股份有限公司合成。
反应体系建立:根据LAMP技术的特点,在PCR反应管中加入10×ThermoPol Reaction buffer 2.5 μL,100mmol/L MgC21.5μL,dATP、dCTP和dGTP各1.4 mmol/L,dUTP 2.8 mmol/L,Betaine 0.8 mol/L,Calcein 0.05mmol/L,MnCl20.6mmol/L,引物F3和B3各0.4μmol/L,引物FIP 和BIP 各1.6 μmol/L,Uracil-DNA Glycosylase(1u/μL)0.5μL,Bst DNA Polymerase(8u/μL)1μL,待测样本1μL,然后用双蒸水补足至25μL/反应体系。将上述反应体系于37℃水浴2 min~15 min(根据产物污染情况而定),65℃水浴60min~90min(根据对试剂灵敏度要求而定),85℃灭活5min。阴、阳性结果根据反应体系的颜色变化判定。正常情况下,阴性结果的反应体系显示为棕黄色,阳性结果的反应体系显示为荧光绿色。
1.2.4 主要试剂 Bst DNA Polymerase(Large fragment)、10×Thermo Pol reaction buffer和Magnesium sulfate solution(100mmol/L)购自New England Biolabs公司;Tris-base、十二烷基磺酸钠(Sodium dodecyl sulfate,SDS)、Betaine和Calcein 购 自Sigma 公 司;dATP、dCTP、dGTP、dUTP 和Uracil-DNA Glycosylase购自Thermoscientific公司;蛋白酶K购自Sigma公司;TaKaRa MiniBEST Universal Genomic DNA Extraction Kit Ver.3.0购自宝生物工程(大连)有限公司;QIAamp DNA Blood Mini Kit购自Qiagen(德国);引物购自生工生物工程(上海)股份有限公司;其他试剂均为国产分析纯。
2 结果
2.1 NaOH 煮沸法抽提的兔血清或血浆中基因组DNA检测结果
NaOH 煮沸法抽提的兔血清或血浆中基因组DNA经可视化日本血吸虫核酸恒温扩增检测试剂检测,均为阴性结果,即便是500条以上血吸虫尾蚴感染组的新西兰大白兔血清或血浆提取物也均未观察到阳性结果(图1)。
2.2 Qigen试剂盒法抽提的兔血清或血浆中基因组DNA检测结果
Qigen试剂盒法抽提的兔血清或血浆(第7天)中基因组DNA经可视化日本血吸虫核酸恒温扩增检测试剂检测,阴性对照组和50条血吸虫尾蚴感染组为阴性结果,100条以上血吸虫尾蚴感染组为阳性结果(图2)。
2.3 酚氯仿法抽提的兔血清或血浆中基因组DNA检测结果
酚氯仿法抽提的兔血清或血浆(第7天)中基因组DNA经可视化日本血吸虫核酸恒温扩增检测试剂检测,阴性对照组和50条血吸虫尾蚴感染组为阴性结果,200条以上血吸虫尾蚴感染组为阳性结果,100条血吸虫尾蚴感染组均为可疑阳性结果(图3)。
2.4 TaKaRa通用型快速试剂盒法抽提的兔血清或血浆中基因组DNA检测结果
TaKaRa通用型快速试剂盒法抽提的兔血清或血浆(第7天)中基因组DNA 经可视化日本血吸虫核酸检测试剂检测,阴性对照组、50、100和200条血吸虫尾蚴感染组为阴性结果,500条以上血吸虫尾蚴感染组为阳性结果(图4)。
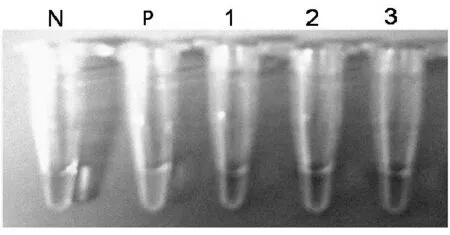
图1 可视化日本血吸虫核酸恒温扩增检测试剂检测NaOH煮沸法抽提的兔血清中基因组DNA 结果Fig.1 The detecting results of rabbit serum genomic DNA extracted by boiling method

图2 可视化日本血吸虫核酸恒温扩增检测试剂检测Qiagen试剂盒法抽提的兔血清中基因组DNAFig.2 The detecting results of rabbit serum genomic DNA extracted by QIAamp DNA Blood Mini Kit(Qiagen)

图3 可视化日本血吸虫核酸恒温扩增检测试剂检测酚氯仿法抽提的兔血清中基因组DNAFig.3 The detecting results of rabbit serum genomic DNA extracted by phenol chloroform method

图4 可视化日本血吸虫核酸检测试剂检测TaKaRa通用型快速试剂盒法抽提的兔血清中基因组DNAFig.4 The detecting results of rabbit serum genomic DNA extracted by TaKaRa MiniBEST Universal Genomic DNA Extraction Kit Ver.3.0
3 讨论
在我国基层血防单位对日本血吸虫病的诊断仍主要采用传统的病原学诊断方法,不但费时费力,而且敏感度有限,容易造成漏检,并且对于早期日本血吸虫病无效。随着近年来吡喹酮的广泛使用,血吸虫病呈现低感染度的流行趋势,为敏感度有限的传统病原学诊断提出了更为严厉的挑战。其他的诊断方法包括免疫学诊断方法和核酸诊断方法等,免疫学诊断方法大多敏感性/特异性不够强,核酸诊断方法大多仪器设备要求较高,且操作复杂,无法推广使用。
本课题组 根 据LAMP 技 术 的 特 点[9-10],开 发 的可视化日本血吸虫核酸恒温扩增检测试剂是一种仪器设备要求简单、操作容易、结果判定方便的检测试剂,且特异性强,敏感性高(相对病原学诊断方法),已经在日本血吸虫感染性钉螺的检测中获得了良好的应用。本研究应用该试剂对不同感染度的日本血吸虫感染兔进行检测,评价该试剂在日本血吸虫病的筛查和诊断等工作中应用的可能性。该试剂的优点是仪器设备要求简单、操作容易、结果判定方便等,但它必须结合良好的核酸提取方法组成完整的检测试剂。目前,核酸提取工作多比较复杂,这将抵消该试剂的优点,使该试剂无法在基层血防单位推广使用。根据报道,将日本血吸虫感染性钉螺用NaOH 煮沸即可作为LAMP试剂的DNA 模板[11],因此本研究设计了NaOH 煮沸法提取血清中核酸。然而,即便是使用高感染度(500条以上血吸虫尾蚴感染)或感染后期(感染7周后)的新西兰大白兔血清或者血浆,该检测试剂也均未能检测到阳性结果。究其原因,可能是血清或血浆中的血吸虫核酸片段数量非常有限,简单的NaOH 煮沸无法像煮沸钉螺那样释放足够量的日本血吸虫DNA 模板。
为了进一步观察血清作为“可视化日本血吸虫核酸恒温扩增检测试剂”的样本的可能性,本研究分别用Qiagen试剂盒法和传统的酚氯仿法[8]再次提取兔血清样本中的基因组DNA 作为该试剂的模板。结果显示,对100条以上日本血吸虫尾蚴感染的新西兰大白兔血清,该试剂均可以检测到阳性结果。然而,这两种血清基因组DNA 提取方法操作都相对比较复杂,不适合在基层血防单位推广使用。因此,本研究又选取了宝生物工程(大连)有限公司生产的通用型基因组DNA 提取试剂盒(TaKaRa MiniBEST Universal Genomic DNA Extraction Kit Ver.3.0)。该试剂盒操作相对简便、快速,但对200条以下日本血吸虫尾蚴感染的新西兰大白兔,却未能检测到阳性结果。本课题组还将继续对此进行研究。
总之,本研究初步探索了可视化核酸恒温扩增技术在日本血吸虫病的筛查和诊断中的应用可能性。尽管本研究设计的检测方法(包括核酸提取和核酸扩增检测)暂未能检测到低感染度新西兰兔血清或者血浆中的日本血吸虫核酸片段,但随着LAMP技术的进步和核酸提取方法的不断改进,可视化核酸恒温扩增技术凭借其仪器设备要求简单、操作容易、结果判定方便的优势,完全有可能在基层血防单位的日本血吸虫病筛查和诊断等工作中推广应用。
[1] Gomes L,Enk M J,Rabello A.Diagnosing schistosomiasis:where are we[J].Rev Soc Bras Med Trop,2014,47(1):3-11.
[2] 周帅锋,余路新,汪世平.血吸虫病的诊断检测技术及研究进展[J].热带医学杂志,2009,9(3):335-340.
[3] Xu X,Zhang Y,Lin D,et al.Serodiagnosis of Schistosoma japonicum infection:genome-wide identification of a protein marker,and assessment of its diagnostic validity in a field study in China[J].Lancet Infect Dis,2014,14(6):489-497.
[4] 阳爱国,周 煜,郭 莉,等.牛羊日本血吸虫抗体检测试纸条的研制[J].动物医学进展,2015,36(5):73-80.
[5] Craw P,Balachandran W.Isothermal nucleic acid amplification technologies for point-of-care diagnostics:a critical review[J].Lab Chip,2012,12(14):2469-2486.
[6] 李秀梅,郭 恋,梁智选,等.布鲁菌环介导等温扩增检测试剂盒的研制[J].动物医学进展,2014,35(7):6-10.
[7] 欧晓霞,刘丽妮,刘 浪,等.日本血吸虫尾蚴不同途径下感染实验动物效果的观察[J].实用预防医学,2010,17(9):1737-1738.
[8] 官 威,许 静,孙 缓,等.Real-time PCR 法用于日本血吸虫感染宿主血清DNA 的定量检测及其感染度的评价[J].中国人兽共患病学报,2014,30(3):263-267.
[9] Njiru Z K.Loop-mediated isothermal amplification technology:towards point of care diagnostics[J].PLoS Negl Trop Dis,2012,6(6):e1572.
[10] Mori Y,Kanda H,Notomi T.Loop-mediated isothermal amplification(LAMP):recent progress in research and development[J].J Infect Chemother,2013,19(3):404-411.
[11] Kumagai T,Furushima-Shimogawara R,Ohmae H,et al.Detection of early and single infections of Schistosoma japonicumin the intermediate host snail,Oncomelania hupensis,by PCR and loop-mediated isothermal amplification(LAMP)assay[J].Am J Trop Med Hyg,2010,83(3):542-548.

