猪呼吸道病相关的常见病毒PCR/RT-PCR 检测方法的建立
韦冠东,王洪光,马 萍,汤德元*,张元鑫,曾智勇,刘 霞,唐 宇,李 达
(1.贵州大学动物科学学院,贵州贵阳550025;2.贵州省动物疫病预防控制中心,贵州贵阳550008)
随着养猪业规模化、集约化的不断发展及治疗猪病手段的不断进步,随之而来的疾病的种类也产生了变化,由以往的单一病原致病发展到多种病原混合感染和继发感染。虽然药物治疗手段和效果越来越好,但随之猪病的复杂程度及其危害也与日俱增。近年来,与猪呼吸道相关的疾病是我国猪群的常发病,给我国养猪业带来巨大的经济损失,严重影响养猪业发展,已经受到广泛重视。研究表明,PRV、PCV-2、CSFV、PRRSV、PPV 与SIV 等 病 毒是猪场发生的各类病毒性呼吸道相关疾病中最为常见的病原[1]。断奶前后的仔猪和早期育肥猪是猪呼吸道相关疫病的主要侵害对象,尤其是刚断奶的仔猪,由于失去母源抗体保护,自身免疫系统未发育完全、没有健全消化和呼吸系统功能,在断奶、混群和饲料刺激等应激下,猪群极易发病[2-3]。猪群发生呼吸道相关疫病的主要临床症状有采食量下降、日渐消瘦;有明显的呼吸道症状如咳嗽、喘气、呼吸困难;眼部及鼻端分泌物增多、发热等特征[4]。自1983年Mullis成功建立PCR 技术,随着该方法应用领域及方法的不断进步与发展,现成为动物疫病诊断的重要方法之一,并广泛应用于分子生物学及其相关领域[5]。随着PCR 技术的不断发展,不同动物疫病病原的多重PCR 方法建立也越来越普遍,王洪光[6]等建立了PRRSV 与SIV 二重RT-PCR 检测方法,能同时检测PRRSV 与SIV。刘志杰[7]等建立了六重PCR 检测方法,可以同时检测PCV-2、PRV、PPV、CSFV、PRRSV 和JEV 6 种猪繁殖障碍病毒性疫病。本试验拟建立能够快速、准确检测PRV、PCV-2、PPV、CSFV、PRRSV 与SIV6 种 病 原 的PCR 或RT-PCR 方法,以期对临床病料进行准确诊断。
1 材料与方法
1.1 材料
1.1.1 病毒、细胞、质粒及菌株 本研究中使用的PRV、PCV-2、PRRSV、CSFV、PPV 和SIV 系 病 猪组织中获得,由贵州省动物疫病研究室分离并保存提 供;;pMD19-T Vector 和 大 肠 埃 希 菌 感 受 态Top10购自宝生物工程(大连)有限公司。
1.1.2 主要试剂及仪器 TaKaRa MiniBEST Viral RNA/DNA Extraction Kit Ver.4.0RNA/DNA核酸提取试剂盒、DL Marker 2 000,宝生物工程(大连)有限公司产品;EZNA TM Gel Extraction Kit(50)胶回收试剂盒,Omega公司产品;普通质粒小提试剂盒,Tiangen 公司产品;异丙醇、无水乙醇等为国产分析纯试剂;Icycler Thermal cycler型PCR仪,Bio-Rad公司产品。
1.2 方法
1.2.1 引物设计 试验根据GenBank 登录的PRV gB(AF257079)、PCV-2 ORF2(NC-005148)、PRRSV ORF6(NC-001961)、CSFV C(AY805221)、PPV NS1(NC-001718)、SIV M(GU086140)等基因序列,应用DNAStar、Oligo、MPprimer设计PCR/RT-PCR 引物,用于扩增目的基因片段[8](表1)。
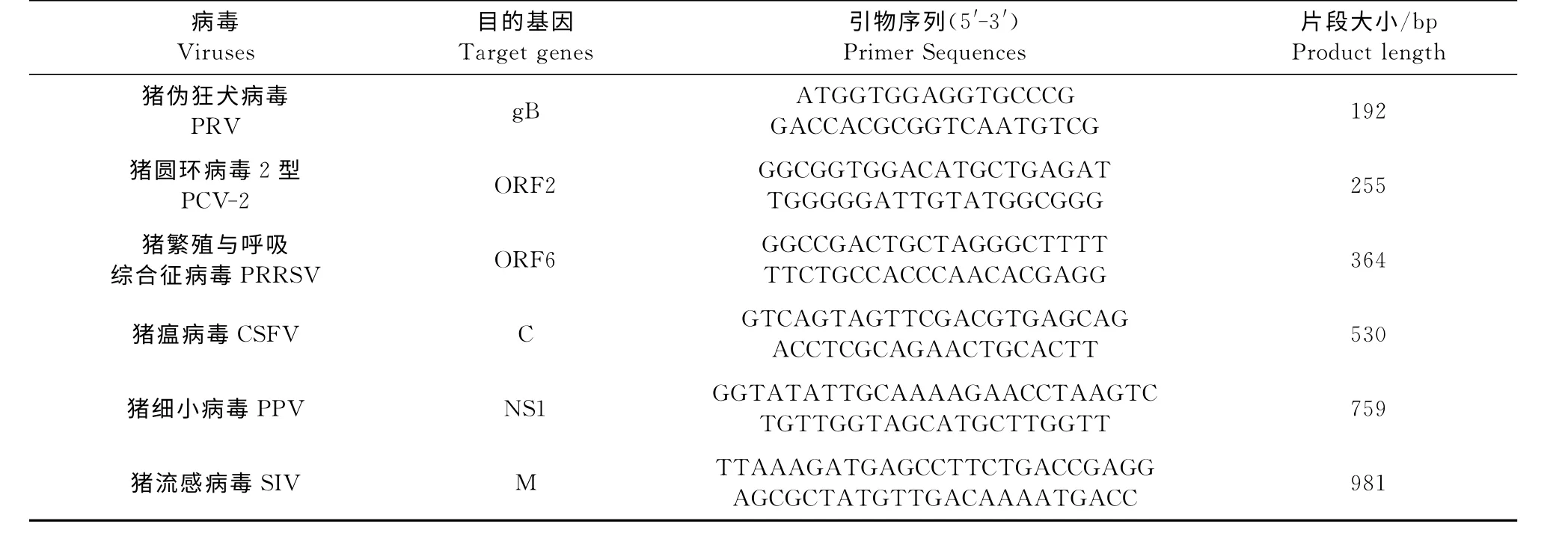
表1 扩增目的片段的引物Table 1 Specific primers used to amplify target genes
1.2.2 病毒核酸提取 分别取病毒液200μL,参照核酸提取试剂盒说明书,严格按步骤提取病毒RNA/DNA,利用蛋白质核酸仪测定其浓度,置-20℃保存备用。
1.2.3 PCR/RT-PCR 反 应体系 PRV、PCV-2、PPV 反应体系为50μL,10×Taq PCR buffer 5 μL、dNTP(10 mmol/L)1 μL,上、下 游 引 物 各1μL,模板各1μL,r Taq 聚合酶1μL,灭菌超纯水补足至50μL。反应程序为:95 ℃5min;95 ℃30 s,57℃30s,72 ℃30s,35 个循环;72℃延伸10 min。PRRSV、CSFV、SIV 反应体系为25μL,2×1step buffer 12.5μL,上、下游引物各1μL,模板各1μL,Prime Script One Step Enzyme Mix 1μL,RNase free H2O 8.5μL。反应程序:50℃40min,95 ℃5min,95 ℃30s,57℃30s,72 ℃30s,35个循环;72℃10min。分别取5.0μL PCR/RT-PCR产物于10g/L琼脂糖凝胶上进行电泳测定。
1.2.4 PCR/RT-PCR 产物的鉴定 使用EZNA TM Gel Extraction Kit胶回收试剂盒,严格按照说明书步骤回收上述6种病毒的PCR/RT-PCR 扩增片段,将胶回收产物与pMD19-T 载体连接于16 ℃过夜,随后将连接产物转化至感受态细胞(Top10),经Amp、IPTG、X-gal筛选,挑取单个白色菌落纯培养后将阳性菌液送至上海英骏生物技术有限公司测序。
1.2.5 PCR/RT-PCR 方法反应条件的优化 对PCR/RT-PCR 反应退火温度(51℃~60 ℃)进行优化,以 确 定 最 佳Tm。PCR 反 应 条 件:95 ℃5min;95 ℃30s,(51℃~60 ℃)30s,72 ℃30s,35个循环;72℃10 min。RT-PCR 反应条件:50℃40min;95℃5min,94℃30s,(51℃~60℃)30 s,72 ℃30s,35 个循环;72 ℃延伸10min。取5.0 μL PCR/RT-PCR 产物于10g/L 琼脂糖进行凝胶电泳测定。
1.2.6 PCR/RT-PCR 特异性检测 利用建立的PRV、PCV-2、PRRSV、CSFV、PPV、SIV PCR/RTPCR 方法分别对彼此进行扩增,检测该方法是否具有特异性。
1.2.7 PCR/RT-PCR 敏感性检测 用蛋白质核酸仪测定提取的6 种病毒的核酸浓度,并用RNase free H2O 进行101、102、103、104、105倍稀释,分别取1μL 相应倍比稀释物进行PCR/RT-PCR 反应,进行敏感性检测。
2 结果
2.1 PCR/RT-PCR 产物的鉴定
将PRV、PCV-2、PRRSV、CSFV、PPV、SIV PCR/RT-PCR 产 物 连 接pMD19-T 载 体 后,转 化TOP10 感受态细胞,送上海英骏生物技术有限公司测序。测序结果表明,扩增片段为6种病毒的特异性基因片段。
2.2 PCR/RT-PCR 扩增结果
六种病毒PCR/RT-PCR 方法最佳退火温度范围均较广,53℃~58℃检测效果基本无差别,对PRV、PCV-2、PRRSV、CSFV、PPV、SIV 的 核 酸 模板进行PCR/RT-PCR 反应,分别扩增出了192、255、364、530、759、981bp的特异性片段,各扩增片段的克隆测序结果表明,所扩增片段与预期结果大小一致,系目的基因序列(图1)。
2.3 特异性检测
利 用 建 立 的PRV、PCV-2、PRRSV、CSFV、PPV、SIV PCR/RT-PCR 方法进行扩增,结果均为阴性,表明建立的方法特异性较好(图2)。
2.4 PCR/RT-PCR敏感性检测
对病毒核酸进行101~105倍稀释,用建立的PRV、PCV-2、CSFV、PRRSV、PPV、SIV PCR/RTPCR 方法进行扩增,观察其敏感性。发现该6种病毒核酸的检测最低浓度依次为2.5×10-3、2.2×10-4、3.2×10-3、8.3×10-3、3.7×10-3、3.7×10-3ng(图3)。
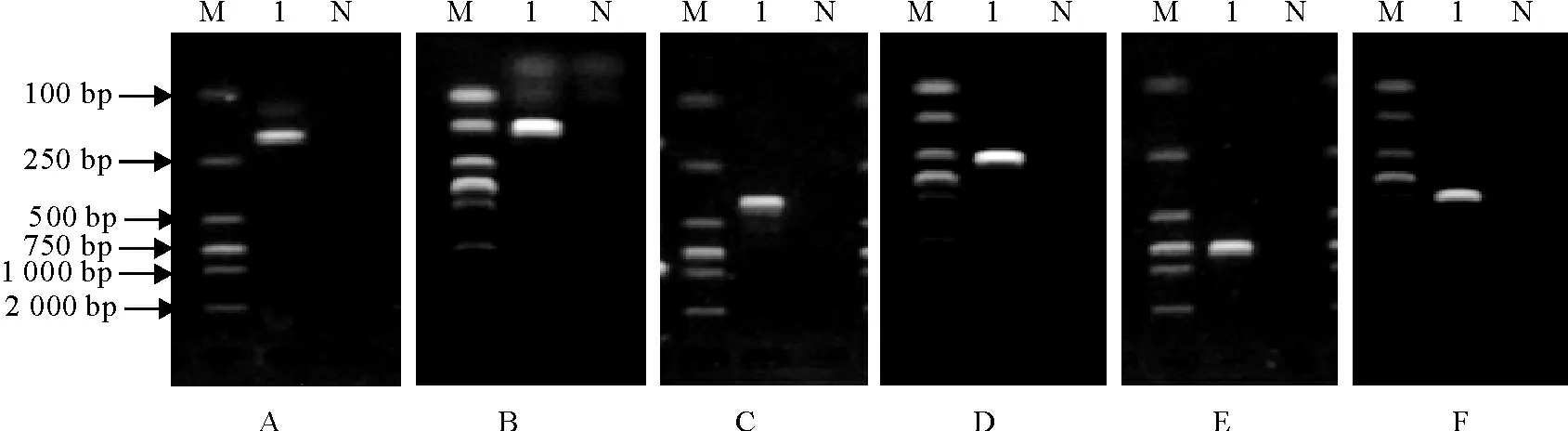
图1 PRV、PCV-2、PRRSV、CSFV、PPV、SIV PCR/RT-PCR检测结果Fig.1 Detection results of PRV,PCV-2,PRRSV,CSFV,PPV,SIV by PCR/RT-PCR
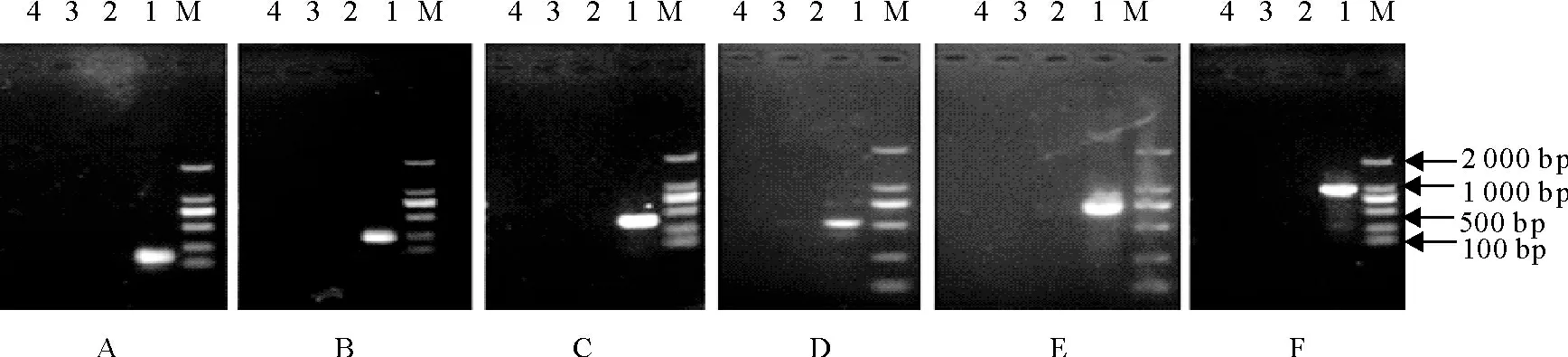
图2 PRV、PCV-2、PRRSV、CSFV、PPV、SIV PCR/RT-PCR特异性试验Fig.2 Specificity test of PCR or RT-PCR for detecting PRV,PCV-2,PRRSV,CSFV,PPV,SIV

图3 PRV、PCV-2、PRRSV、CSFV、PPV、SIV PCR/RT-PCR敏感性试验结果Fig.3 Sensitivity test of PCR/RT-PCR for detecting PRV,PCV-2,PRRSV,CSFV,PPV,SIV
3 讨论
建立PCR 检测方法时,引物的设计是首要条件,试验表明建立PRV、PCV-2、PRRSV、CSFV、PPV、SIV PCR/RT-PCR 的 最 佳 退 火 温 度 范 围 较广,53℃~58℃检测效果均较好。在敏感性试验中,6种病毒的核酸检测最低浓度依次为2.5×10-3、2.2×10-4、3.2×10-3、8.3×10-3、3.7×10-3、3.7×10-3ng。近几年来,猪病毒性疾病发生对我国规模化养猪业造成了巨大的经济损失,我国规模化猪场绝大多数都受到猪病毒性呼吸道疾病的威胁。PRV、PCV-2、PRRSV、CSFV、PPV、SIV 是 呼 吸 道病毒性疫病的重要病原,该类病原侵入呼吸道后,会造成呼吸道的防御屏障的破坏及呼吸道抗病毒能力的下降,继而引起混合感染和继发感染,由于导致呼吸道抵抗力的下降,使呼吸道类的疾病发病率变高,导致多种疫病同时发生,使疫病复杂化,病症加重;同时PRRSV、PCV-2、CSFV、PPV、PRV 能够损伤机体的免疫系统,降低猪群对外界环境的抵抗力,使得猪群发生疾病时多种病原混合感染和继发感染的情况越来越普遍,由于这些病毒给机体造成相似临床症状,导致疾病的诊断十分困难,难以及时给与相应防治[9]。因此快速、准确地诊断发病原因,从而及时有效的针对发病猪群采取相应的药物治疗或免疫预防措施,降低疾病造成的经济损失具有重要的现实意义。
本 试 验 针 对PRV、PCV-2、PRRSV、CSFV、PPV、SIV 等6种常见病毒的相关保守基因分别设计一对特异性引物,以扩增PRV gB、PCV-2ORF2、PRRSV ORF6、CSFV C、PPV NS1、SIV M 部分基因片段,应用Primer Premier 5.0、Oligo 7.4、MFE primer和MP primer软件进行综合分析,充分考虑PRVG+C 含量较高,PPVG+C 含量较低的问题,Tm 值应该控制在50℃~60℃,确保某一温度都能进行很好的PCR 反应,尽量避免引物间的非特异性扩增,为以后多重PCR 反应奠定基础。建立的6种呼吸道相关病毒性疫病的PCR/RT-PCR 检测方法,较理想的实现了上述6种病毒临床病料的快速、准确的检测,该方法的建立为检测以上6种病毒提供了有参考价值的方法。
[1] 张家恭.猪呼吸道疾病综合症的发病机理与防控措施[J].养殖与饲料,2008(9):41-42.
[2] Salichs M,SabatéD,Homedes J.Efficacy of ketoprofen administered in drinking water at a low dose for the treatment of porcine respiratory disease complex[J].J Anim Sci,2013,91(9):4469-4475.
[3] TicóG,Segalés J,Martínez J.The blurred border between porcine circovirus type 2-systemic disease and porcine respiratory disease complex[J].Vet Microbiol,2013,163(3-4):242-247.
[4] 刘翠权.广西395个规模猪场猪呼吸道疾病综合征的病原学调查及防控措施[D].江苏南京:南京农业大学,2011.
[5] 陶生策,张治平,张先恩.PCR 技术研究进展[J].生物工程进展,2001,21(4):26-29.
[6] 王洪光,汤德元,曾智勇,等.猪繁殖与呼吸综合征病毒与猪流感病毒二重RT-PCR 检测方法的建立[J].猪业科学,2014(8):98-100.
[7] 刘志杰,曾智勇,汤德元,等.猪繁殖障碍病毒性疫病六重PCR检测方法的建立及应用[J].畜牧兽医学报,2012,4(39):1429-1436.
[8] 王 稳,屈武斌,申志勇,等.利用MPprimer设计引物并优化扩增条件以提高多重PCR 效率的试验研究[J].生物化学与生物物理进展,2010,37(3):342-346.
[9] Darwicha L,Mateua E.Immunology of porcine circovirus type 2(PCV-2)[J].Virus Res,2012,164:61-67.

