含查尔酮结构(E)-4-[3-(取代苯基)丙烯酰基]苯甲酸钠的制备及抑菌活性研究
郭沂涛,刘希望,杨亚军,许春燕,李剑勇
(甘肃省新兽药工程重点实验室,农业部兽用药物创制重点实验室,中国农业科学院兰州畜牧与兽药研究所,甘肃兰州730050)
查尔酮类化合物广泛存在于自然界中,是一类广泛存在于药用植物中的天然有机化合物,其基本骨架结构为1,3-二苯基丙烯酮[1]。由于查尔酮类化合物分子具有较大的柔性,能与不同的受体结合,显示出广泛的生物学活性,如抗炎、抗肿瘤、抗菌等[2-4]。研究显示,查尔酮是一类具有显著抗寄生虫活性的化合物,如甘草查尔酮A,最早从中药甘草的根中提取得到,对对氯喹有耐药性的疟原虫有较好的抑制作用[5]。此后,国内外学者不断报道了查尔酮类衍生物的合成及其抗寄生虫活性研究,许多化合物显示出较高的抗利士曼原虫、疟原虫活性[6-9]。与此同时,不断有新的查尔酮类化合物被合成出来,并表现出显著的抑菌活性[10-12]。
艰难梭菌是一种厌氧菌,是动物和人肠道中的正常菌群,与大部分畜禽体内寄生虫一样,属于专性厌氧微生物。艰难梭菌是马、牛、猪肠道中的病原菌,在仔猪疾病中,艰难梭菌的感染率高达90%[13]。考虑到许多查尔酮类化合物对艰难梭菌有较强抑制作用[14],同时对寄生虫也具有具有生物活性,可以通过体外试验初步筛选具有潜在抗寄生虫活性的化合物,从而提高筛选效率,降低筛选难度。本文合成了一系列具有(E)-4-[3-(取代苯基)丙烯酰基]苯甲酸钠结构的查尔酮类化合物,运用核磁共振氢谱及高分辨质谱进行了结构表征,考察了目标的化合物体外抑菌活性,尤其是对艰难梭菌的抑菌活性,为寻找新的抗菌化合物提供依据。
1 材料与方法
1.1 材料
1.1.1 试剂及仪器 取代苯甲醛、4-乙酰基苯甲酸(分析纯),百灵威试剂公司产品;氨苄西林、环丙沙星及甲硝唑,Sigma 公司产品;甲醇、二甲基亚砜(DMSO)(分析纯),国药集团上海化学试剂公司产品;MH 肉汤培养基、磷酸盐缓冲盐(PBS),英国OXOID 公司产品;厌氧培养基,北京路桥技术股份有限公司产品;琼脂,郑州蓝宇精细化工有限公司产品;6cm 培养皿、针头式滤器,上海生工生物工程技术服务有限公司产品;U 型底96孔板,美国Corning公司产品。
1.1.2 菌株 艰难梭菌(Clostridium difficile,ATCC 43593)、产气荚膜梭菌(Clostridium perfringens,CICC22949)、大肠埃希菌(Escherichia coli,CICC10899)、金黄色葡萄球菌(Staphylococcus aureus,ATCC27217),中国工业微生物菌种保藏管理中心提供。
1.1.3 仪器 Aglient 600 MHz DD2 核磁共振仪、Aglient 6530型液相色谱飞行时间质谱串联仪,美国安捷伦公司产品;SW-CJ-2PD 型超净工作台,苏州净化设备有限公司产品;LDIX-30KBS型高压灭菌锅,上海申安医疗器械厂产品;DNP-9082 型电热恒温培养箱,上海精宏实验设备有限公司产品;Forma 厌氧培养箱,美国赛默飞世尔公司产品;CPA224S 型电子分析天平,德国赛多利斯公司产品;Vortex 涡旋振荡仪,美国Scientific Industries公司产品;Speceramax M2多功能酶标仪,美国Molecular Devices公司产品;CO 8000型细胞密度计,英国Biochrom 公司产品;移液器,德国艾本德公司产品;Direct-Q 3 超纯水系统,美国密理博公司产品。
1.2 方法
1.2.1 (E)-4-[3-(取代苯基)丙烯酰基]苯甲酸钠的合成 参照文献[15],将6 mmol的4-乙酰基苯甲酸、6.6mmoL的取代苯甲醛溶于30mL甲醇,加0.04g/mL的氢氧化钠水溶液15 mL,室温搅拌反应8h,有固体沉淀生成,抽滤,用大量水洗、甲醇淋洗得微黄色固体产物,合成路线图见图1。
1.2.2 目标化合物的结构表征 核磁共振氢谱采用Aglient 600MHz DD2 核磁共振仪,以氘代DMSO 为溶剂将少量目标化合物溶解,以四甲基硅烷为参考,进行目标化合物的氢核磁共振检测。
高分辨质谱采用Aglient 6530 型液相色谱飞行时间质谱串联仪,先将少量目标化合物用适量甲醇溶解,过滤后装入样品瓶中待检测。其中,离子源为ESI源;检测模式为负离子模式;干燥气温度300 ℃;毛细管电压4 000V;碎裂电压为135V;色谱柱为Aglient Extend-C18柱(1.8μm,2.1mm×50mm);流动相为甲醇-水(80∶20,V/V);流速0.2mL/min;进样量为2μL。
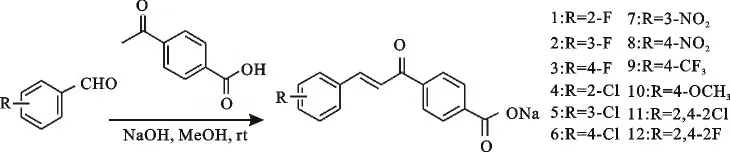
图1 目标化合物1~12合成路线图Fig.1 Synthesis of compounds 1-12
1.2.3 最小抑菌浓度(MIC)测定 艰难梭菌和产气荚膜梭菌采用琼脂稀释法测定其MIC 值[16]。将化合物用DMSO 配成浓度为1.28 mg/mL 的原始浓度药液,用液体培养基倍比稀释成640、320、160、80、40、20、10、5、2.5μg/mL 浓度的药液。分取上述不同浓度药液稀释1mL 加至9 mL 的琼脂培养基中,混合均匀后倒平板,得到含药浓度为别为64、32、16、8、4、2、1、0.5、0.25μg/mL 的琼脂平板。将艰难梭菌和产气荚膜梭菌厌氧培养18h后,用培养基稀释至浓度为OD 600nm=0.1(含菌量约为107CFU/mL)。用移液器分别在上述含药琼脂平板表面点种10μL 菌悬液,厌氧培养箱内培养48h,目测有无菌落生长。没有加入化合物的平板作为空白对照组,加入甲硝唑的平板作为药物对照组。
革兰阳性菌金黄色葡萄球菌和革兰阴性菌大肠埃希菌采用微量肉汤稀释法测定其最小抑菌浓度[17]。首 先 将 化 合 物 用 DMSO 制 成 浓 度 为1mg/mL的溶液,用MH 肉汤倍比稀释至浓度分别为64、32、16、8、4、2、1、0.5、0.25μg/mL 备 用。细菌复苏后接种到含MH 肉汤培养基的灭菌试管中培养2h~4h,用细菌密度测试仪测定菌悬液浓度并调节至0.5 麦氏浓度标准(1×108CFU/mL~2×108CFU/mL)备用。用PBS 液将菌悬液做1∶10稀释,取96孔板,每孔加入97.5μL 的含有不同浓度化合物的MH 肉汤,然后加入用PBS液稀释好的菌悬液2.5μL,每孔的总体积为100μL,同时设置空白对照组、氨苄西林和环丙沙星药物对照组。放入恒温培养箱37℃恒温过夜培养18h~24h后,在黑暗背景下肉眼观察混合物清亮,孔底无菌落形成的最低浓度即为化合物的MIC值。
2 结果
2.1 目标化合物的结构表征
(E)-4-[3-(2-氟苯基)丙烯酰基]苯甲酸钠(1),微 黄 色 固 体 1.18 g,产 率 73%;1H-NMR(600 MHz,DMSO-d6)δ8.23-7.90(m,6H),7.80(d,J=15.7Hz,1H),7.49(s,1H),7.38-7.22(m,2H).HR-MS(ESI):计算值C16H10FO3[M-Na]-269.061 9,实测值269.062 1。
(E)-4-[3-(3-氟苯基)丙烯酰基]苯甲酸钠(2),微 黄 色 固 体 0.92 g,产 率 57%;1H-NMR(600 MHz,DMSO-d6)δ8.12-7.93(m,5H),7.84(d,J=10.0Hz,1H),7.75-7.63(m,2H),7.47(s,1H),7.26(s,1H).HR-MS(ESI):计算值C16H10FO3[M-Na]-269.061 9,实 测 值269.062 4。
(E)-4-[3-(4-氟苯基)丙烯酰基]苯甲酸钠(3),微 黄 色 固 体 1.23 g,产 率 72%。1H-NMR(600 MHz,DMSO-d6)δ8.11(s,2H),8.04-7.93(m,4H),7.90(d,J=15.6 Hz,1H),7.73(d,J=15.8Hz,1H),7.28(s,2H).HR-MS(ESI):计算 值C16H10FO3[M-Na]-269.061 9,实 测 值269.062 4。
(E)-4-[3-(2-氯苯基)丙烯酰基]苯甲酸钠(4),微 黄 色 固 体 1.13 g,产 率 70%。1H-NMR(600 MHz,DMSO-d6)δ8.21(d,J=7.1 Hz,1H),8.10-7.92(m,6H),7.55(d,J=7.2 Hz,1H),7.53-7.37(m,2H).HR-MS(ESI):计算值C16H10ClO3[M-Na]-285.032 4,实测值285.031 8。
(E)-4-[3-(3-氯苯基)丙烯酰基]苯甲酸钠(5),微 黄 色 固 体 1.43 g,产 率 83%。1H-NMR(600 MHz,DMSO-d6)δ8.15-7.76(m,7H),7.68(d,J=15.6Hz,1H),7.53-7.35(m,2H).HRMS(ESI):计算值C16H10ClO3[M-Na]-285.032 4,实测值285.031 7。
(E)-4-[3-(4-氯苯基)丙烯酰基]苯甲酸钠(6),微 黄 色 固 体 1.53 g,产 率 89%。1H-NMR(600 MHz,DMSO-d6)δ8.02(d,J=7.8 Hz,2H),7.98-7.86(m,5H),7.68(d,J=15.5 Hz,1H),7.49(d,J=8.1Hz,2H).HR-MS(ESI):计算值C16H10ClO3[M-Na]-285.0324,实 测 值285.032 8。
(E)-4-[3-(3-硝 基 苯 基)丙 烯 酰 基]苯 甲 酸 钠(7),微 黄 色 固 体1.62 g,产 率91%。1H-NMR(600 MHz,DMSO-d6)δ8.76(s,1H),8.45-7.62(m,9H).HR-MS(ESI):计算值C16H10NO5[MNa]-296.056 4,实测值296.057 0。
(E)-4-[3-(4-硝 基 苯 基)丙 烯 酰 基]苯 甲 酸 钠(8),微 黄 色 固 体0.85 g,产 率48%。1H-NMR(600 MHz,DMSO-d6)δ8.25(s,2H),8.22-8.02(m,5H),7.97(s,2H),7.78(d,J=15.5 Hz,1H).HR-MS(ESI):计算值C16H10NO5[M-Na]-296.056 4,实测值296.057 9。
(E)-4-[3-(4-三氟甲基苯基)丙烯酰基]苯甲酸钠(9),微 黄 色 固 体1.27g,产 率66%。1H-NMR(600 MHz,DMSO-d6)δ8.16-7.69(m,10H).HR-MS(ESI):计 算 值C17H10F3O3[M-Na]-319.058 8,实测值319.059 2。
(E)-4-[3-(4-甲氧基苯基)丙烯酰基]苯甲酸钠(10),微 黄 色 固 体0.86 g,产 率50%。1H-NMR(600 MHz,DMSO-d6)δ8.02(d,J=7.6 Hz,2H),7.96(d,J=7.3 Hz,2H),7.83(d,J=7.9Hz,2H),7.78(d,J=15.5 Hz,1H),7.68(d,J=15.5 Hz,1H),6.99(d,J=8.0 Hz,2H),3.79(s,3H).HR-MS(ESI):计算值C17H13O4[M-Na]-281.081 9,实测值281.082 3。
(E)-4-[3-(2,4-二氯苯基)丙烯酰基]苯甲酸钠(11),微 黄 色 固 体1.35 g,产 率78%。1H-NMR(600 MHz,DMSO-d6)δ8.25(s,1H),8.15-7.86(m,6H),7.73(s,1H),7.53(s,1H).HR-MS(ESI):计算值C16H9Cl2O3[M-Na]-318.993 4,实测值318.993 4。
(E)-4-[3-(2,4-二氟苯基)丙烯酰基]苯甲酸钠(12),微 黄 色 固 体1.78 g,产 率92%。1H-NMR(600 MHz,DMSO-d6)δ8.22(s,1H),8.14-7.87(m,5H),7.75(d,J=15.5 Hz,1H),7.37(s,1H),7.21(s,1H).HR-MS(ESI):计算值C16H9F2O3Na[M-Na]-287.052 5,实测值287.052 9。
以化合物12为例,其核磁共振氢谱及高分辨质谱图见图2和图3。

图2 化合物12 的核磁共振氢谱图Fig.2 1H-NMR spectra of compound 12
其中,δ8.22(s,1H)为A 环3 位上的氢;δ 8.14-7.87(m,5H)为B环的4个氢和双键2位的1个氢重叠形成的多重峰;δ7.75(d,J =15.5Hz,1H)为双键1位上的氢;δ7.37(s,1H)为A 环5位上的氢;δ7.21(s,1H)为A 环6位上的氢。
化合物12分子式为C16H9F2O3Na,是一种钠盐,易于形成负离子,以ESI源负离子模式测定其分子 离 子 峰[M-Na]-为287.052 5,计 算 值 为287.052 9,二者之间误差在可接受范围之内。

图3 化合物12 的高分辨质谱图Fig.3 High resolution mass spectroscopy of compound 12
2.2 目标化合物的抑菌活性
用琼脂稀释法测定了目标化合物对艰难梭菌和产气荚膜梭菌的MIC值,用微量肉汤稀释法测定了目标化合物对大肠埃希菌和金黄色葡萄球菌的MIC值(表1)。

表1 目标化合物对4种菌的最小抑菌浓度Table 1 MIC values of target compounds against the 4bacterial strains (μg/mL)
从表1中可以看出,化合物9和11对艰难梭菌具有中等的抑制作用,MIC 值均为8μg/mL。化合物6和12对艰难梭菌有较高的抑制作用,MIC 值稍高于对照药物甲硝唑。化合物11对产气荚膜梭菌有明显抑制作用,MIC 值与对照药物甲硝唑相当。化合物9和11对金黄色葡萄球菌显示一定的抑制作用,MIC值分别为8μg/mL和2μg/mL。目标化合物对革兰阴性菌大肠埃希菌无明显抑制作用,MIC值均大于64μg/mL。化合物12对艰难梭菌的体外抑菌活性见图4。

图4 化合物12 对艰难梭菌和产气荚膜梭菌的体外抑菌活性Fig.4 Antibacterial activities of compound 12against Clostridium difficile and Clostridium perfringens
3 讨论
查尔酮骨架结构1,3-二苯基丙烯酮的通常由相应的醛和含有α位H 原子的酮通过克莱森-斯密特缩合反应制得。本文以取代苯甲醛、4-乙酰基苯甲酸为原料,用氢氧化钠作碱,甲醇作溶剂高产率的制备了12个新型含有查尔酮结构(E)-4-[3-(取代苯基)丙烯酰基]苯甲酸钠类化合物。制备的化合物结构简单、合成条件简洁、后处理简单,化合物结构经高分辨质谱及核磁共振氢谱确证。体外抑菌试验表明,部分合成的化合物对厌氧菌艰难梭菌和产气荚膜梭菌有较好的抑制作用,MIC 值与对照药物甲硝唑相当或稍弱。化合物9和11对金黄色葡萄球菌显示一定的抑制作用,大部分化合物对大肠埃希菌无明显抑制作用。构效关系分析显示,4-氯取代的化合物6和2,4-二氟取代的化合物12对艰难梭菌显示出较高的抑制作用;2,4-二氯取代化合物11对除了大肠埃希菌之外其他3种菌都显示出较高的抑制作用。化合物6、9、11和12可作为有潜在抗寄生虫活性的备选化合物,相应的抗寄生虫活性有待进一步研究。
[1] 廖头根,汪秋安,方伟琴,等.新型查尔酮类化合物的合成及其生物活性研究[J].有机化学,2006,26(5):685-689.
[2] Ghosh A,Mandal S,Banerji A,et al.A new chalcone from Pongamia pinnata and its antioxidant properties[J].Nat Prod Commun,2009,4(2):209-210.
[3] 刘 滔,胡永洲.2′-羟基查尔酮的Mannich反应极其产物的生物活性[J].有机化学,2006,26(7):983-987.
[4] Bekhit A A,Habib N S,el-Din A,et al.Synthesis and antimicrobial evaluation of chalcone and syndrome derivatives of 4(3H)-quinazolinone[J].Boll Chim Farm,2001,140(5):297-301.
[5] Chen M,Theander T G,Christensen S B,et al.Licochalcone A,a new antimalarial agent,inhibits in vitro growth of the human malaria parasite Plasmodium falciparum and protects mice from P.yoelii infection[J].Antimicrob Agents Chemother,1994,38(7):1470-1475.
[6] Boeck P,Bandeira Falcao C A,Leal P C,et al.Synthesis of chalcone analogues with increased antileishmanial activity[J].Bioorg Med Chem,2006,14(5):1538-1545.
[7] Liu M,Wilairat P,Croft S L,et al.Structure-activity relationships of antileishmanial and antimalarial chalcones[J].Bioorg Med Chem,2003,11(13):2729-2738.
[8] Ram V J,Saxena A S,Srivastava S,et al.Oxygenated chalcones and bischalcones as potential antimalarial agents[J].Bioorg Med Chem Lett,2000,10(19):2159-2161.
[9] Larsen M,Kromann H,Kharazmi A,et al.Conformationally restricted anti-plasmodial chalcones[J].Bioorg Med Chem Lett,2005,15(21):4858-4861.
[10] Nielsen S F,Boesen T,Larsen M,et al.Antibacterial chalcones-bioisosteric replacement of the 4′-hydroxy group[J].Bioorg Med Chem,2004,12(11):3047-3054.
[11] López S N,Castelli M V,Zacchino S A,et al.In vitro antifungal evaluation and structure-activity relationships of a new series of chalcone derivatives and synthetic analogues,with inhibitory properties against polymers of the fungal cell wall[J].Bioorg Med Chem,2001,9(8):1999-2013.
[12] Lall N,Hussein A A,Meyer J J.Antiviral and antituberculous activity of Helichrysum melanacme constituents[J].Fitoterapia,2006,77(3):230-232.
[13] 许方方,胡玉苗,冉姗姗,等.艰难梭菌毒素及致病基因的研究进展[J].动物医学进展,2013,34(7):100-103.
[14] Wu X,Alam M Z,Feng L,et al.Prospects for flavonoid and related phytochemicals as nature-inspired treatments for Clostridium difficile infection[J].J Appl Microbiol,2014,116(1):23-31.
[15] Sharma N,Mohanakrishnan D,Shard A,et al.Stilbene-chalcone hybrids:design,synthesis,and evaluation as a new class of antimalarial scaffolds that trigger cell death through stage specific apoptosis[J].J Med Chem,2012,55(1):297-311.
[16] NCCLS.Performance standards for antimicrocbial susceptility testing:Sixteenth informational supplement[S].Nat Commit-Clin Lab Stand,2006.
[17] Pridmore A,Burch D,Lees P.Determination of minimum inhibitory and minimum bactericidal concentrations of tiamulin against field isolates of Actinobacillus pleuropneumoniae[J].Vet Microbiol,2011,151(3-4):409-412.

