鸭疫里默菌aroA 基因缺失突变株的构建及生物学特性研究
张 硕,刘 宁,卢 媞,王 颖,周祖涛,2,刘 梅,2,
胡思顺1,2,栗绍文1,2,毕丁仁1,2,李自力1,2*
(1.华中农业大学动物医学院,湖北武汉430070;2.农业微生物学国家重点实验室,湖北武汉430070)
鸭疫里默菌感染是由鸭疫里默菌(R.anatipestifer,RA)引起的严重危害养鸭业的重要接触性传染病之一,临床剖检病变主要表现为全身浆膜炎性渗出。该病呈世界范围分布,给各国的养鸭业造成了重大的经济损失[1-2]。根据目前分离RA 发现其与鸭大肠埃希菌混合感染率高,并且混合感染的致病力更强[3]。随着我国养鸭业的发展,RA 已成为危害我国养鸭业的主要传染病之一。
目前关于鸭疫里默菌毒力因子的报道较少。胡清海等[4]利用同源重组的方法构建了RA 血清2型的OmpA 基因缺失株,发现OmpA 是RA 的一个重要毒力因子,可能主要起黏附入侵作用。周祖涛等[5]报道了RA-YM 株的基因组序列,发现RA 的sspA 基因编码产物与ScpB 蛋白具有高度的同源性,从而预测sspA 可能是RA 的毒力相关因子。郑娟等选择性捕获转录序列(SCOTS)技术筛选体内外差异性表达基因,预测了几个毒力相关蛋白[6]。
芳香族氨基酸在细菌中只有一条通往分支酸的合成途径,aroA 基因是这个途径中的关键基因。罗晓松等[7]通过在鱼源嗜水气单胞菌aopB/aopD 缺失株的基础上缺失aroA 基因从而构建无毒菌株,且生长速度明显慢于亲本株;Buzzola R F 等[8]构建的金黄色葡萄球菌aroA 基因缺失株的毒力比亲本株下降了约16倍;多杀性巴氏杆菌和迟缓爱德华菌等均有关于aroA 基因缺失减毒株构建成功的报道[9-10]。
构建缺失基因菌株的方法较多,利用自杀性质粒需要在宿主菌的复制原点的驱动下才能复制的特点,使用自杀性质粒介导同源重组,这是当前构建基因缺失菌株的一种比较有效的方法,通过研究发现鸭疫里默菌只需一次重组就可以成功构建基因缺失菌株,并在鸭疫里默菌中待缺失的aroA 基因的左右同源臂之间插入一个壮观霉素抗性基因作为筛选标记来筛选基因缺失菌株[11]。本试验通过构建重组自杀性质粒,缺失RA-YM 株的aroA 基因,并对其生物学特性进行研究,为进一步深入研究RA 的分子致病机理,构建鸭疫里默菌基因工程疫苗奠定基础。
1 材料与方法
1.1 材料
1.1.1 菌株、质粒和试验用动物 大肠埃希菌DH5α由本室保存;鸭疫里默菌血清1 型云梦分离株(RA-YM)由华中农业大学动物医学院兽医微生物与免疫学实验室分离鉴定并保存;pBluescriptⅡSK(+),自 杀 性 质 粒pRE112 及 宿 主 菌E.coli X7213由本实验室保存;pMD18-T 载体购自宝生物工程(大连)有限公司;携带壮观霉素(Spc)抗性基因pIC333质粒由华中农业大学生命科学院孙明教授惠赠;1 日龄非免疫健康樱桃谷肉鸭共111只购于湖北某种鸭厂。
1.1.2 主要试剂和仪器 限制性内切酶BamHⅠ、Sac Ⅰ、Hind Ⅲ、Kpn Ⅰ、r TaqTM、ETaqTM、T4DNA 连接酶、DNA marker均购自宝生物工程(大连)有限公司;DNA 凝胶回收试剂盒购自Tiangen公司;质粒提取试剂盒购自Omega公司。本研究所用引物见表1。

表1 本研究所用引物Table 1 Primers used in this study
1.2 方法
1.2.1 重组自杀性质粒pRE112-LSR 的构建 参照文献[12]扩增模板RA-YM 株aroA 基因。以鸭疫里默菌基因组为模版,用引物Leftarm P1/Leftarm P2、Rightarm P3/Rightarm P4 分 别 扩 增RA-YMaroA 基因左右侧的基因片段。以pIC333质粒为模板,用引物Spc P1/Spc P2扩增壮观霉素抗性基因(Spc),将纯化的PCR 产物分别与克隆载体pMD18-T 连 接。用BamH Ⅰ和Sac Ⅰ将pTRightarm 质粒上的aroA 基因右臂插入到pBluescriptⅡSK(+)载体上,构建质粒pSK-Rigtarm;用Hind Ⅲ和BamHⅠ将pT-Spc质粒上的Spc插入到pSK-Rigtarm 上,构建质粒pSK-Rigtarm-Spc;用KpnI和Hind Ⅲ将pT-Leftarm 质粒上的aroA 基因左臂插入到pSK-Rigtarm-Spc质粒上,构建质粒pSK-LSR;用KpnⅠ和SacⅠ将pSK-LSR质粒上的LSR 片段重组到自杀性质粒pRE112上,构建质粒pRE112-LSR;将 质 粒pRE112-LSR 转 化E.coli X7213感受态细胞,涂布含氯霉素(12.5μg/mL)和DAP(50μg/mL)的LB 琼脂固体平板,挑取单菌落,摇菌,小提质粒酶切鉴定并测序。
1.2.2 RA-YMaroA 基因缺失菌株的构建及鉴定
以含有pRE112-LSR 质粒的E.coli X7213菌株为供体菌,鸭疫里默菌血清1 型云梦分离株(RAYM)为受体菌,采用接合转移的方法构建缺失株。挑取在含壮观霉素的平板上生长的细菌克隆为候选突变株,以引物Spc p1/Spc p2;扩增突变株内部的Spc抗性基因片段;以引物Y1/Y2、Z1/Z2扩增待缺失的aroA 基因。
1.2.3 RA-YMaroA 基因缺失株生化特性鉴定挑取鸭疫里默菌aroA 缺失株与野生株RA-YM 株单菌落接种在TSB培养基中,37℃、200r/min摇床培养过夜,转接至蔗糖、阿拉伯糖、精氨酸双水解酶、明胶、尿素等生化鉴定管中,37℃静置过夜。
1.2.4 鸭疫里默菌aroA 基因缺失株体外生长的测定 将RA-YMaroA 基因缺失株及RA-YM 株菌液分别转接至TSB培养基中,37℃、200r/min振荡培养,每隔1h分别取菌液测定其OD 600nm 值,绘制细菌体外生长曲线。
1.2.5 鸭疫里默菌aroA 基因缺失株LD50的测定
将90 只8 日 龄 樱 桃 谷 肉 鸭 随 机 分 为3 组,YM组(A 组)30只,aroA 基因缺失株组(B组)50只,对照组(C组)10只。A 组按照106、107和108CFU/mL;B组按照105、106、107、108和109CFU/mL 进行脚蹼注射攻毒,每只0.5mL,C组注射等量PBS。观察7d,记录发病症状并记录死亡数,计算LD50。
1.2.6 鸭疫里默菌aroA 基因缺失株在鸭体内生长情况的测定 将21只8日龄的樱桃谷肉鸭随机分为3 组,YM 组(D 组)、aroA 基 因 缺 失 株 组(E组)各9只,对照组(F 组)3只。通过对D 组、E 组活鸭计数,D、E、F组按照105CFU/mL进行脚蹼注射攻毒,每只0.5mL,对照组注射等量PBS。观察发病症状,从D 组和F 组各取3只鸭于1、4、7d跖骨内侧静脉采血同时各随机选取3 只鸭处死并取心、肝、脑,研磨后倍比稀释涂布TSA 平板,37℃静置过夜培养后计数。
2 结果
2.1 重 组 自 杀 性 质 粒pRE112-LSR 及RA-YM aroA 基因缺失株的构建
重 组 自 杀 性 质 粒pRE112-LSR 经Kpn Ⅰ+Sac Ⅰ酶切鉴定正确(图1),RA-YMaroA 缺失株中能扩增出Spc基因(图2);将筛选到的RA-YM aroA 基因缺失株在含有Spc的TSB 培养基中盲传,用引物Y1 和Y2、Z1 和Z2 对每一代都进行鉴定。鉴定结果显示连续传了5代都没有扩增出已缺失的aroA 基因片段,结果显示筛选到的RA-YM aroA 基因缺失株能够稳定的传代(图3)。

图1 pRE-Leftarm-Spc-Rightarm(pRE-LSR)酶切鉴定Fig.1 Identification of pRE-Leftarm-Spc-Rightarm(pRE-LSR)by enzyme digestion
2.2 鸭疫里默菌aroA 基因缺失株的生化鉴定
鸭疫里默菌aroA 缺失株与野生株RA-YM 株的对碳源和氮源的利用情况及其他表型见表2。aroA 缺失株与野生株RA-YM 株的生化特性比较,缺失株不再水解精氨酸。
2.3 鸭疫里默菌aroA 基因缺失株体外生长测定
根据鸭疫里默菌aroA 基因缺失株和亲本株体外生长测定结果显示,aroA 基因缺失株在TSB 培养基中培养12h时的活菌数相比亲本株有显著的减少(图4)。aroA 基因缺失株在对数期生长速度稍慢与亲本株,并在稳定期逐渐趋于一致(图5)。
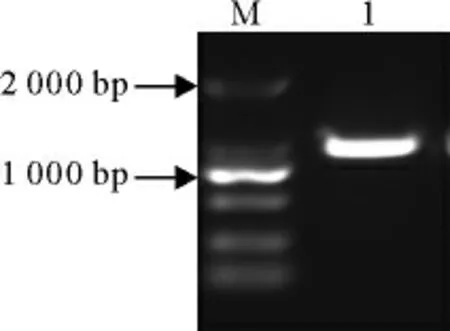
图2 RA-YMaroA 缺失株中的Spc基因PCR 扩增产物Fig.2 PCR amplifiction of Spc gene in RA-YM△aroA
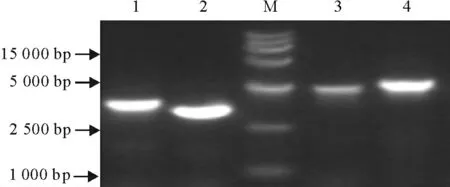
图3 RA-YMaroA 基因缺失株中aroA 基因PCR 扩增产物Fig.3 PCR products of aroA gene in RA-YM△aroA

表2 aroA 基因缺失株与RA-YM 株生化特性比较Table 2 Comparison of the biochemical characterstics between aroA mutant strain and RA-YM strain
2.4 鸭疫里默菌aroA 基因缺失株LD50的测定
鸭疫里默菌aroA 基因缺失株和亲本株经过脚蹼注射,并记录死亡情况,通过改良寇氏法计算出鸭疫里默菌aroA 基因缺失株的LD50为1.9×106CFU,亲本株的LD50为5.9×105CFU,毒力下降3倍左右。
2.5 鸭疫里默菌aroA 基因缺失株在鸭体内生长情况的测定
鸭疫里默菌aroA 基因缺失株和亲本株经过脚蹼注射5×104CFU,每只0.5mL,在1、4、7d无菌采取血液及心、肝、脑组织,并对采取的血液及组织选择合适稀释度,涂布TSA平板计数结果可知,在樱桃谷肉鸭体内,接种菌等量情况下,鸭疫里默菌aroA 基因缺失株血液与心、肝、脑组织的载菌量与亲本株相比有所下降,但差异不显著(图6~图9)。

图4 RA-YM 和RAΔaroA 在TSB培养基中培养12h活菌计数结果Fig.4 The live bacterial counts of RA-YM and RAΔaroA cultured in TSB culture medium for 12h

图5 RA-YM 和RAΔaroA 体外生长曲线的测定结果Fig.5 The growth curves of RA-YM and RAΔaro Ain vitro

图6 雏鸭血液载菌量的测定Fig.6 The quantity of isolated bacteria from duckling blood

图7 雏鸭心脏载菌量的测定Fig.7 The quantity of isolated bacteria from duckling heart

图8 雏鸭肝脏载菌量的测定Fig.8 The quantity of isolated bacteria from duckling liver

图9 雏鸭脑载菌量的测定Fig.9 The quantity of isolated bacteria from duckling brain
3 讨论
通过构建自杀性重组质粒,采用结合转移的方法构建RA-YMaroA 基因缺失株,该方法以同源重组为基础,其同源片段长度是影响重组效率的重要因素之一。研究表明,同源片段在0.3kb~1.2kb范围内时重组效率较高[13],本研究同源片段正是在此基础上设计的,并成功构建了缺失株。
aroA 基因编码5-烯醇丙酮酞莽草酸-3磷酸合成酶,是细菌催化芳香族氨基酸合成的关键基因,该基因被破坏后均可阻断芳香族氨基酸的合成,导致细菌不能得到相应的化合物。所以,当aroA 基因缺失后,可以导致其细菌的生长能力变慢,毒力下降等生物学变 化[7-10],而 其免 疫 原 性 相 对 较 好[14]。通过本研究发现,aroA 缺失突变株在体外与亲本株相比,缺失株不再水解精氨酸,生长能力也有一定下降,证实了营养缺陷型基因aroA 对细菌的影响,且致病力试验结果显示其LD50较亲本株下降了3 倍左右,表明RA-YMaroA 缺失株的毒力有所减弱,与波氏杆菌aroA 基因缺失株的毒力下降类似[15]。
体内载菌量试验表明,缺失株较亲本株在血液和组织中的载菌量有所减少,其原因可能是由于缺失aroA 基因后导致营养供给不足而影响细菌的生长;但其差异并无体外培养显著,发现其与迟缓爱德华氏菌aroA 基因缺失株体内载菌试验有较大差异[10],推测由于菌株是单基因缺失,其在体内繁殖一段时间后,鸭疫里默菌的代偿机制弥补了aroA基因缺失后对细菌生长的影响,具体作用机制还有待于进一步研究。
本试验通过结合转移的方法成功构建了鸭疫里默菌aroA 基因缺失株,生物学试验结果表明RAYMaroA 基因缺失株相比野生株毒力有所减弱,生长减缓,为鸭疫里默菌分子致病机理的深入研究及基因工程疫苗的研制提供了科学依据。
[1] 蔡宝祥.家畜传染病学[M].北京:中国农业出版社,2001.
[2] 吕殿红,张毓金,王 刚.鸭疫里默菌病的研究进展[J].动物医学进展,2000(S1):189-192.
[3] 艾地云,姚 琪,罗 玲,等.湖北部分地区鸭疫里氏杆菌的分离鉴定[J].动物医学进展,2011,32(9):46-50.
[4] Hu Q,Han X,Zhou X,et al.OmpA is a virulence factor of R.anatipestifer[J].Vet Microbiol,2011,150(3):278-283.
[5] Zhou Z,Peng X,Xiao Y,et al.Genome sequence of poultry pathogen R.anatipestifer strain RA-YM[J].J Bacteriol,2011,193(5):1284-1285.
[6] 郑 娟.利用SCOTS技术筛选鸭疫里氏杆菌体内外差异表达的基因[D].湖北武汉:华中农业大学,2008.
[7] 罗晓松,尚 书,侯化鹏,等.鱼源嗜水气单胞菌aopB-/aopD-/aroA-缺失株的构建及鉴定[J].农业生物技术学报,2009(1):29-35.
[8] Buzzola F R,Barbagelata M S,Caccuri R L,et al.Attenuation and persistence of and ability to induce protective immunity to a Staphylococcus aureus aroA mutant in mice[J].Infect Immun,2006,74(6):3498-3506.
[9] 郭东春,卢 艳,刘家森,等.多杀性巴氏杆菌aroA 基因缺失突变株的构建及鉴定[J].微生物学报,2012,52(4):526-531.
[10] Mo Z L,Li J,Li G Y,et al.Phenotypic characterization,virulence,and immunogenicity of Edwardsiella tarda LSE40 aroA mutant[J].Appl Microbiol Biotechnol,2013,97(14):6325-6335.
[11] 卢凤英,苗 双,倪欣涛,等.鸭疫里默氏杆菌TonB依赖性受体TbdR2基因缺失株的构建[J].中国家禽,2013(16):21-24.
[12] Zhou Z,Zheng J,Tian W,et al.Identification of R.anatipestifer genes differentially expressed in infected duck livers by the selective capture of transcribed sequences technique[J].Avian Pathol,2009,38(4):321-329.
[13] Leloup L,Ehrlich S D,Zagorec M,et al.Single-crossover integration in the Lactobacillus sake chromosome and insertional inactivation of the ptsI and lacL genes[J].Appl Environ Microbiol,1997,63(6):2117-2123.
[14] Zhang Q,Hu R,Hu J,et al.aroA deleted Bordetella bronchisepticainspiring robust mucosal immune response and provide full protection against intranasal challenge[J].Res Vet Sci,2013,94(1):55-61.
[15] 彭 忠,梁 婉,曾东柱,等.波氏杆菌aroA 基因缺失株的研究及应用[A].中国畜牧兽医学会家畜传染病学分会、解放军军事医学科学院军事兽医研究所.中国畜牧兽医学会家畜传染病学分会第八届全国会员代表大会暨第十五次学术研讨会论文集[C].江苏徐州:中国畜牧兽医学会家畜传染病学分会、解放军军事医学科学院军事兽医研究所,2013.

