萝卜IRAP技术体系建立与品种指纹图谱构建
李 芳, 徐 良, 魏美甜, 龚义勤, 柳李旺
(南京农业大学作物遗传与种质创新国家重点实验室/南京农业大学园艺学院,江苏南京 210095)
萝卜IRAP技术体系建立与品种指纹图谱构建
李 芳, 徐 良, 魏美甜, 龚义勤, 柳李旺
(南京农业大学作物遗传与种质创新国家重点实验室/南京农业大学园艺学院,江苏南京 210095)
为建立萝卜逆转座子间扩增多态性(IRAP)技术体系,基于萝卜Ty1-copia类逆转座子逆转录酶的保守序列设计引物,对IRAP-PCR反应主要因素进行分析。建立的萝卜IRAP标记技术体系(20 μl)为:20 ng基因组DNA模板,1×PCR buffer,0.25 mmol/L dNTPs,2.0 mmol/L Mg2+,0.4 μmol/L引物,1 UTaqDNA聚合酶。将所建立的IRAP标记技术体系应用于14个萝卜品种指纹图谱分析,结果显示,筛选出的2个特异引物RsTy1F5和RsTy1F10在14份萝卜材料中共扩增得到了16个多态性条带,可以将14份萝卜材料完全区分开,每份种质都有独特的指纹图谱,表明IRAP技术可以有效地应用于萝卜种质鉴定和指纹图谱的构建。
萝卜;逆转座子;IRAP;指纹图谱
逆转座子(Retrotransposon)为普遍存在于真核生物基因组中的可移动转座元件,是核基因组的主要组成部分,在植物基因组进化过程中扮演重要角色[1-4]。根据末端是否包含长重复序列(Long terminal repeat,LTR),逆转座子可分为LTR和non-LTR逆转座子两大类。LTR逆转座子依据其编码区蛋白基因顺序的不同,又可分为Ty1-copia和Ty3-gypsy2个亚类[5-7],其中Ty1-copia类逆转座子在植物界分布较广,也是目前研究较多的一类。逆转座子在植物基因组中分布范围较广、异质性较高,并且具有高拷贝和插入位点多等特性,非常适用于分子标记的开发。IRAP(Inter-retrotransposon amplified polymorphism)是一种基于逆转座子开发的分子标记,由Kalendar[8]1999年首次在大麦中提出,其原理是依据逆转座子LTR的保守序列或逆转录酶的相对保守序列设计引物,这些引物在PCR扩增过程中可与LTR逆转座子的相应区域退火,进而扩增出相邻的同一家族2个逆转座子成员间的片段[9]。IRAP标记具有操作简单、多态性丰富和检测效率高等优点,目前已经在种质鉴定、遗传图谱检测和多样性分析等领域得到了广泛应用[10-12]。研究结果表明,IRAP标记在大麦及烤烟不同品种间均可扩增出丰富的多态性条带,特别适合作物遗传多样性研究[8],目前已在茄子、马铃薯、梨、梅等作物中得到广泛应用[13-16]。
萝卜为起源于中国的一种重要根菜类蔬菜作物,其种质资源十分丰富,种质资源的保存和利用,对于选育高产、优质、抗病新品种具有重要意义[17-18]。随着新品种的不断增加,基础育种材料亲本被重复使用,新基因资源的缺乏造成遗传基础狭窄,新品种的鉴定难度逐渐增大[19],同名异物或同物异名现象时有发生,单纯依靠表型性状很难区分[20]。DNA指纹图谱是在DNA分子标记基础上建立的反映生物个体间差异的DNA电泳图谱,是进行品种鉴定的重要技术,具有快捷、准确、稳定、经济等特点,中国已将DNA指纹图谱鉴定作为品种质量监控的重要手段之一[21]。利用分子标记进行品种鉴定并构建指纹图谱对知识产权保护和维护生产者与育种者的利益尤为重要[19]。随着基因组学研究的发展,多种分子标记技术已经广泛应用于萝卜种质鉴定和遗传多样性研究,如RAPD、SSR、ISSR等,但尚未见有关萝卜IRAP标记分析的相关报道。
本研究以萝卜品种NAU-SN为试验材料,对萝卜IRAP反应体系中Mg2+、dNTPs和引物浓度等主要因素进行分析,建立并优化萝卜IRAP-PCR技术体系,并应用于萝卜品种指纹图谱的构建,以期为开展萝卜遗传多样性、品种鉴定与性状遗传标记定位研究奠定技术基础,也为萝卜性状遗传改良和分子育种提供高效的分子技术手段。
1 材料与方法
1.1 试验材料
反应体系优化、引物筛选采用萝卜品种NAUSN,用于指纹图谱构建的14个萝卜品种(表1),均由南京农业大学萝卜遗传育种研究室保存。

表1 用于IRAP标记分析的14个萝卜品种Table 1 The 14 radish genotypes used for IRAP analysis
1.2 基因组DNA提取
萝卜基因组DNA提取采用改良的CTAB-氯仿-异戊醇法[22]。
1.3 IRAP引物设计与合成
利用Clustalx软件对本研究室分离到的萝卜Ty1-copia类逆转座子逆转录酶序列进行多重比对,在其保守区域设计特异引物(表2)。

表2 IRAP引物名称及信息Table 2 Information of IRAP primers
1.4 IRAP扩增反应体系和参数设置
PCR反应各组分浓度及优化条件见表3,其中Mg2+、dNTPs和引物分别设置3个浓度梯度,共有27个处理。

表3 IRAP-PCR体系各组分浓度优化Table 3 The design of components concentrations for IRAP-PCR protocol
PCR扩增程序参照Campbell等[16]设定并稍加改良:94℃4 min 1个循环;94℃30 s,49℃30 s, 72℃2 min 38个循环;72℃延伸10 min,10℃保存。PCR扩增产物在8%聚丙烯酰胺凝胶上分离, 120 V电泳3 h左右,AgNO3染色并显色后,拍照记录。
2 结果与分析
2.1 IRAP-PCR扩增体系建立
2.1.1 最优Mg2+浓度水平筛选 Mg2+在反应过程中主要影响TaqDNA聚合酶的活性,在图1中,泳道1~9 Mg2+浓度为1.0 mmol/L,泳道10~18 Mg2+浓度为2.0 mmol/L,泳道19~27 Mg2+浓度为3.0 mmol/L,结果显示,当Mg2+浓度处在一个较低的水平(1.0 mmol/L)时,不能有效扩增,产生的条带基本没有或者较少,一些片段明显缺失;当Mg2+浓度处在一个较高的水平(3.0 mmol/L)时,相对的条带清晰度有所下降,条带有缺失现象,主要为弱带;当Mg2+浓度处在中间水平(2.0 mmol/L)时,扩增的条带清晰,基本无缺失现象,所以本研究中最适宜Mg2+浓度为2.0 mmol/L。
2.1.2 最优dNTPs与引物浓度水平筛选 结果(图1)显示,当dNTPs浓度为0.1 mmol/L,引物浓度为0.2 μmol/L时(泳道1、10、19),随着Mg2+浓度的升高,扩增条带从无到有,部分片段缺失;当dNTPs浓度为0.10 mmol/L,引物浓度为0.4 μmol/L时(泳道4、13、22),不同Mg2+浓度均能扩增出条带,且随着Mg2+浓度的升高,条带数量有所增加;当dNTPs浓度为0.10 mmol/L,引物浓度为0.8 μmol/L(泳道7、17、25),随着Mg2+浓度的升高,弱带数增加,当Mg2+浓度处于最高水平时,条带数量减少,部分条带缺失。
当dNTPs浓度为0.25 mmol/L,引物浓度为0.2 μmol/L时(泳道2、11、20),扩增效果不明显,随着Mg2+浓度的增加,条带从无到有,但不清晰且部分片段不能扩增;当dNTPs浓度为0.25 mmol/L,引物浓度为0.4 μmol/L时(泳道5、14、23),随着Mg2+浓度的升高,扩增条带从无到有,并逐渐清晰,同时条带的数量也增加,尤其是弱带的数量增加明显;当dNTPs浓度为0.25 mmol/L,引物为高浓度0.8 μmol/L时(泳道8、17、26),随着Mg2+浓度增加某些条带从无到有,条带数明显增加。
当dNTPs浓度为0.50 mmol/L,引物为低浓度水平0.2 μmol/L时(泳道3、12、21),随着Mg2+浓度增加,扩增条带从无到有,在Mg2+浓度为中高浓度时扩增条带数量基本无变化;当dNTPs浓度为0.50 mmol/L,引物浓度为0.4 μmol/L时(泳道6、15、24),随着Mg2+浓度的增加,条带特别是弱带数量有所增加;当dNTPs浓度为0.50 mmol/L,引物浓度为0.8 μmol/L时(泳道9、18、27),扩增条带的数量随着Mg2+浓度的增加而增加,但当Mg2+浓度达到3.00 mmol/L时,条带出现模糊情况,清晰度下降。综上所述,dNTPs浓度与引物浓度的最优组合为:dNTPs浓度为0.25~0.50 mmol/L,引物为0.4~0.8μmol/L。当引物处于相同浓度水平时,随着dNTPs浓度的升高,条带数量增多,但基本为弱带,变化范围可以忽略,故选择dNTPs浓度为0.25 mmol/L,引物浓度为0.4~0.8 μmol/L。
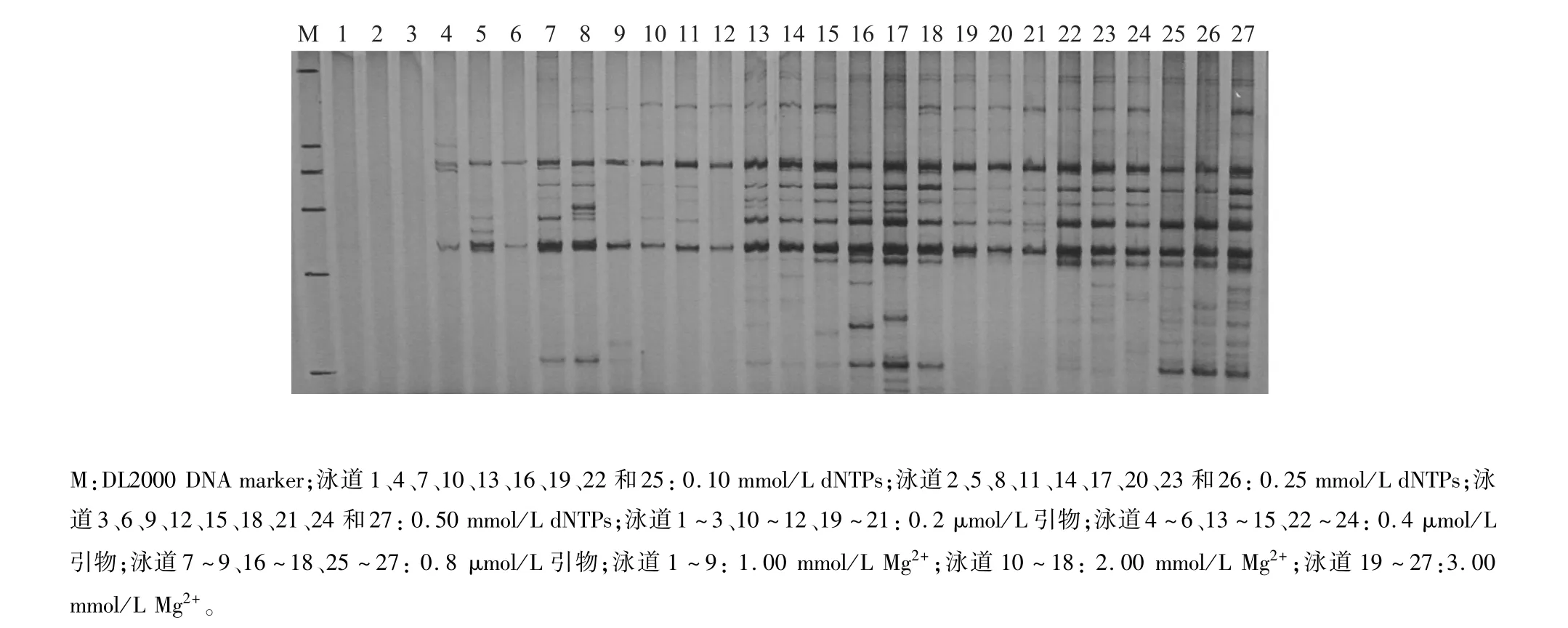
图1 萝卜IRAP-PCR电泳图谱Fig.1 IRAP-PCR profiles of radish
2.2 萝卜品种指纹图谱的构建
以优化的IRAP标记体系为基础,对设计的特异性引物进行筛选,从中选出2条扩增条带清晰,多态性高且稳定性好的引物在14个萝卜品种中构建指纹图谱,共扩增出16个多态性条带(图2)。根据DNA扩增图谱中IRAP标记位点扩增条带分布情况进行数字化统计,以“1”和“0”代表扩增条带的有和无,获得了各品种由16位数字组成的字符串,建立了基于2个引物组合扩增的14个萝卜品种数字指纹图谱(表4)。利用2个引物组合可以将这14个品种完全区分开来,每一份种质材料都有自己独特的指纹图谱。

图2 引物RsTy1F5(A)和RsTy1F10(B)在14个萝卜品种中的扩增图谱Fig.2 The PCR amplification profiles of 14 radish cultivars with primers RsTy1F5(A)and RsTy1F10(B)

表4 14份萝卜品种的特征指纹图谱Table 4 The IRAP unique fingerprint map of 14 cultivars of radish
3 讨论
逆转座子在植物基因组中分布广泛,基于逆转座子的分子标记具有丰富的多态性和高信息量等优点[23]。IRAP标记作为逆转座子分子标记的一种,可检测逆转座子在宿主基因组中的插入多态性,操作简单,不需要进行酶切及引入引物接头等繁琐过程,是应用较广泛的逆转座子标记之一[24]。
IRAP标记基于PCR反应,不同浓度Mg2+、dNTPs、引物等因素对扩增结果影响较大。增加Mg2+浓度对扩增条带的增加或减少有较大的影响[25];低浓度的引物会使PCR效率降低,而浓度过高又可能会产生非靶序列的扩增[26];高浓度的dNTPs会使反应速度加快,但成本高且不利于多态性条带的扩增,浓度过低则相反。本试验中Mg2+浓度过低时,条带缺失严重,增加其浓度,扩增条带增加且清晰,但浓度过高却又影响了条带的清晰度和扩增效果;引物浓度较低时条带数量与高浓度相比,也有明显减少;而中等水平和高水平浓度的dNTPs扩增效果差异不大,均能得到理想条带,为节约成本,故选择中等水平浓度。因此本研究确定的萝卜IRAP标记体系为(20 μl):20 ng DNA模板,1×PCR buffer,0.25 mmol/LdNTPs,2.00 mmol/LMg2+,0.4 μmol/L引物,1 UTaqDNA聚合酶,与前人研究结果基本一致[17,27]。
萝卜是重要的蔬菜类作物,种质资源十分丰富,随着选育品种的增多,种质材料间的差异越来越小,单纯依靠表型性状来进行区分非常困难,利用DNA分子标记技术进行种质鉴定,结果稳定可靠且效率高,不受环境等因素的影响[28]。IRAP标记较常规DNA分子标记而言,稳定性高且多态性更为丰富,适用于种质鉴定、遗传多样性分析等研究,并已在茄子和果梅等作物中得到广泛证实[29-30]。陶爱芬等利用IRAP和ISSR标记比较分析了28份烟草种质资源多样性,结果表明IRAP标记中每个引物产生的多态性条带及多态性比率明显高于ISSR标记,且条带更稳定[31]。27份柿种质资源遗传多样性分析结果表明IRAP标记产生的多态性远远高于RAPD标记[32]。利用IRAP标记已经成功构建了柿属植物、苹果指纹图谱,并鉴定出芽变品种间的差异[33-34]。本试验根据已建立的萝卜IRAP技术体系,从设计的IRAP引物中筛选出2条稳定性高、多态性强的引物,在14份萝卜种质材料中检测出16个多态性位点,并成功构建了萝卜品种指纹图谱。从本研究结果可以看出,利用IRAP分子标记构建的萝卜指纹图谱条带清晰,指纹差异丰富,多态率高,表明建立的IRAP标记是构建萝卜品种指纹图谱的一种理想标记,在萝卜遗传多样性分析方面是有效的,将为萝卜优良品种选育和遗传改良提供新型有效的分子技术手段。
[1] 张胜利,许桂芳,李东方,等.逆转座子对真核生物基因组及宿主基因表达的影响[J].核农学报,2010,24(2):314-318.
[2] FLAVELL R.Repetitive DNA and chromosome evolution in plants [J].Biological Sciences,1986,312(1154):227-242.
[3] KASHKUSH K,FELDMAN M,LEVY A A.Transcriptional activation of retrotransposons alters the expression of adjacent genes in wheat[J].Nature Genetics,2003,33(1):102-106.
[4] MCCARTHY E M,LIU J,LI Z G,et al.Long terminal repeat retrotransposons ofOryza sativa[J].Genome Biology,2002,3(10):1-11.
[5] GRANDBASTIEN M A.Retroelements in higher plants[J].Trends in Genetics,1992,8(3):103-108.
[6] GABRIEL A,WILLEMS M,MULES E H,et al.Replication infidelity during a single cycle of Ty1 retrotransposition[J].Proceedings of the National Academy of Sciences,1996,93(15):7767-7771.
[7] KUMAR A,BENNETZEN J L.Plant retrotransposons[J].Annual Review of Genetics,1999,33(1):479-532.
[8] KALENDAR R.IRAP and REMAP:two new retrotransposon-based DNA fingerprinting techniques[J].Theor Appl Genet,1999,98: 704-711.
[9] 王子成,李忠爱,邓秀新.植物反转录转座子分子标记[J].植物学通报,2003,20(3):287-294.
[10]肖炳光,杨本超.利用IRAP标记分析烤烟品种间遗传差异[J].西北植物学报,2006,26(6):1119-1124.
[11]NAIR A S,TEO C H,HARRION P H,et al.Genome classification of banana cultivars from south India using IRAP markers[J].Euphytica,2005,144:285-290.
[12]张玉翠,杨伟华,匡 猛,等.32个棉花主栽品种DNA指纹图谱构建及遗传多样性分析[J].棉花学报,2012,24(2):120-126.
[13]KUMAR A,HIROCHIKA H.Applications of retrotransposons as genetic tools in plant biology[J].Trends in Plant Science,2001, 6:127-133.
[14]CAMPBELL B C,LEMARE S,PIPERIDIS G,et al.IRAP,a retrotransposon-based marker system for the detection of somaclonal variation in barley[J].Molecular Breeding,2010,27(2):193-206.
[15]王利英,杜永臣,张 斌,等.茄子IRAP和REMAP分子标记的开发[J].园艺学报,2008,35(9):1363-1367.
[16]沈玉英,高志红,王 飞,等.梅(Prunus mume)IRAP分子标记技术体系的建立[J].果树学报,2011,28(3):423-427.
[17]娄丽娜,王 辉,王 成,等.腌制萝卜种质资源的遗传多样性[J].江苏农业学报,2013,29(6):1421-1426.
[18]胡 伟,陈 豫,伍 洋.不同激素浓度配比对萝卜愈伤组织形成的影响[J].江苏农业科学,2014,42(7):60-62.
[19]缪恒彬,陈发棣,赵宏波,等.应用ISSR对25个小菊品种进行遗传多样性分析及指纹图谱构建[J].中国农业科学,2008,41 (11):3735-3740.
[20]王美荣,许 勇,詹永乐,等.厚皮甜瓜品种组合SSR指纹图谱构建[J].中国农学通报,2010,26(20):47-51.
[21]滕海涛,吕 波,赵久然,等.利用指纹图谱辅助植物新品种保护的可能性[J].生物技术通报,2009(1):1-6.
[22]LIU L W,ZHAO L P,GONG Y Q,et al.DNA fingerprinting and genetic diversity analysis of late-bolting radish cultivars with RAPD,ISSR and SRAP markers[J].Scientia Horticulturae, 2008,116(3):240-247.
[23]KALENDAR R,FLAVELL A J,ELLIS T H N,et al.Analysis of plant diversity with retrotransposon-based molecular markers[J]. Heredity,2011,106:520-530.
[24]CAMPBELL B C,LEMARE S,PIPERIDIS G,et al.IRAP,a retrotransposon-based marker system for the detection of somaclonal variation in barley[J].Molecular Breeding,2010,27(2):193-206.
[25]龚义勤,李 培,王明霞,等.萝卜基因组DNA的RAMP-PCR体系优化[J].植物研究,2006,26(1):93-97.
[26]林菊生.现代细胞分子生物学技术[M].北京:科学出版社, 2004:368-370.
[27]王 东,江 彪,娄群峰,等.甜瓜属REMAP分子标记体系的建立及应用[J].中国瓜菜,2011,24(3):6-9.
[28]赵卫国,王 灏,李殿荣,等.甘蓝型特高含油量油菜种质及其主栽品种的指纹图谱构建[J].植物遗传资源学报,2011,12 (6):904-909.
[29]赵海燕,王秋锦,孙清鹏,等.茄子IRAP分子标记体系的建立与优化[J].中国农学通报,2008,24(2):75-80.
[30]沈玉英,高志红,王 飞,等.梅(Prunus mume)IRAP分子标记技术体系的建立[J].果树学报,2011,28(3):423-427.
[31]陶爱芬,刘中华,祁建民,等.烟草种质资源遗传多样性的IRAP和ISSR标记比较分析[J].武汉植物学研究,2009,27 (6):589-594.
[32]杜晓云,罗正荣.部分柿属植物IRAP反应体系的建立和指纹图谱构建[J].农业生物技术学报,2006,14(6):931-936.
[33]杜晓云,宿福园,张青林,等.利用IRAP技术揭示部分柿属种间遗传关系[J].果树学报,2012,29(6):1004-1009.
[34]周永军,孙其宝,孙 俊,等.苹果IRAP反应体系的建立和指纹图谱构建[J].安徽农业大学学报,2010,37(3):558-563.
(责任编辑:袁 伟)
Establishment of inter-retrotransposon amplified polymorphism(IRAP) reaction system and construction of cultivar fingerprint in radish(Raphanus sativus L.)
LI Fang, XU Liang, WEI Mei-tian, GONG Yi-qing, LIU Li-wang
(National Key Laboratory of Crop Genetics and Germplasm Enhancement/College of Horticulture,Nanjing Agricultural University,Nanjing 210095,China)
Based on the conserved domain of Ty1-copia-like retrotransposon reverse transcriptase of radish,inter-retrotransposon amplified polymorphism(IRAP)primers were designed.Several important reaction factors of IRAP were studied to establish and optimize IRAP marker system in radish.The IRAP-PCR was performed in a optimized 20-μl reaction mixture containing 20 ng DNA,1×PCR buffer,0.25 mmol/L dNTPs,2.0 mmol/L Mg2+,0.4 μmol/L primer and 1 UTaqDNA polymerase.DNA fingerprint maps of 14 radish genotypes were constructed with optimized IRAP molecular marker system.A total of 16 polymorphic bands were generated with two primers,RsTy1F5 and RsTy1F10.The 14 radish genotypes could be absolutely distinguished with the two IRAP primers.Each radish genotype had a unique fingerprint,suggesting that IRAP marker was practical and effective in radish cultivar identification and fingerprint construction.
radish;retrotransposon;inter-retrotransposon amplified polymorphism(IRAP);fingerprinting
S634.3
A
1000-4440(2015)01-0143-06
李 芳,徐 良,魏美甜,等.萝卜IRAP技术体系建立与品种指纹图谱构建[J].江苏农业学报,2015,31(1):143-148.
10.3969/j.issn.1000-4440.2015.01.023
2014-05-25
国家自然科学基金项目(31372064);江苏省科技支撑计划项目(BK20140706)
李 芳(1987-),女,江苏镇江人,硕士研究生,从事蔬菜作物遗传育种研究。(Tel) 18005289219;(E-mail)lifang191919@126.com
柳李旺,(E-mail)nauliulw@njau.edu.cn

