转运真核表达盒的重组T7噬菌体构建
徐 海, 鲍 熹, 王义伟, 卢 宇, 许梦薇, 侯继波
(江苏省农业科学院/国家兽用生物制品工程技术研究中心,江苏南京 210014)
转运真核表达盒的重组T7噬菌体构建
徐 海, 鲍 熹, 王义伟, 卢 宇, 许梦薇, 侯继波
(江苏省农业科学院/国家兽用生物制品工程技术研究中心,江苏南京 210014)
为了构建转运真核表达盒的重组T7噬菌体,并分别在体外、体内条件下检测其标签蛋白质EGFP的表达。以T7噬菌体基因组左侧578 bp处为插入位点,取上游400 bp和下游200 bp片段作为左右同源臂,并在其中插入表达EGFP基因的真核表达盒(EEB),构建同源重组质粒pUC-L-EEB-R。将该质粒载体转化T7噬菌体宿主细菌BL21,在噬菌体繁殖过程中完成同源重组,PCR筛选重组T7-EEB噬菌体。提取该重组噬菌体基因组转染Vero细胞后体外检测EGFP蛋白质表达,纯化的噬菌体免疫小鼠后体内检测EGFP蛋白质表达。结果显示,通过同源重组方法成功构建了携带真核表达盒的重组T7噬菌体,PCR检测和酶切鉴定均证明表达盒已正确插入。T7-EEB基因组转染真核细胞可见明显的EGFP蛋白质表达,免疫小鼠后活体荧光检测到EGFP蛋白质信号,在小鼠肝脏、脾脏组织中RT-PCR检测到EGFP基因的mRNA转录。表明同源重组方法可以用于构建重组T7噬菌体,噬菌体能够转运真核表达盒并实现蛋白质表达。
同源重组;DNA疫苗;真核表达;T7噬菌体
DNA疫苗是20世界90年代发展起来的一种新型疫苗,是指将含有编码靶抗原基因的质粒载体导入宿主,通过宿主细胞表达抗原从而诱导机体产生免疫反应。该免疫途径不仅能激发体液免疫反应,还能诱导高水平的细胞免疫,尤其是细胞毒性T淋巴细胞(CTL)反应,在疾病的防治中具有较大优势[1-2]。
DNA疫苗有多种免疫途径:肌肉、皮内、皮下及静脉等注射,也可通过基因枪发送至细胞内[3]。不同DNA导入方式会引起辅助性T淋巴细胞(Th)向不同方向极化,产生免疫应答的机制与效果不同[4-5]。这种差异除了DNA疫苗本身抗原的特异性以外,其主要原因是DNA疫苗给药后,绝大多数的DNA在转运到靶细胞前被机体的酶类降解失活,裸露质粒DNA转运到胞内的效率低下,从而导致免疫效果不够理想[6-7]。因此,提高DNA疫苗转运至靶细胞的效率,是研制高效DNA疫苗的一个方向。目前,通过PLGA、海藻酸钠、壳聚糖及其衍生物等可生物降解材料包裹DNA疫苗来提高效率[8-9]。
T7噬菌体是感染肠杆菌的烈性噬菌体,其颗粒结构稳定能耐受极端的理化环境,在体液环境中保持结构完整从而有效保护衣壳内部的基因组不受损伤[10]。噬菌体颗粒的不对称性有利于募集T细胞,使其被免疫细胞识别、吞噬、降解;该过程能够有效地将噬菌体基因组直接转运到免疫细胞内部,是转运DNA疫苗的优良运输工具。通过同源重组方法将真核表达盒插入到T7噬菌体基因组非编码区,使其随噬菌体基因组复制而复制,构建出遗传稳定的重组噬菌体。利用重组T7噬菌体作为真核表达盒的转运工具,既能保护DNA不受酶类物质的降解破坏,又能诱发细胞吞噬从而直接将DNA送入免疫细胞内部提高抗原递呈的靶向性。本研究在T7噬菌体基因组左侧非编码区插入表达EGFP标签蛋白质的真核表达盒,建立构建转运真核表达盒重组噬菌体的方法,并验证EGFP蛋白质的表达情况,为T7噬菌体用于DNA疫苗的转运奠定基础。
1 材料与方法
1.1 试验材料
菌株与质粒:T7 Select 415-1b Cloning Kit购于Merck公司;pUC-19、pEGFP-N1质粒由国家兽用生物制品工程技术研究中心实验室保存。
主要试剂:限制性内切酶、TaqDNA聚合酶、T4 DNA连接酶、反转录酶均为大连宝生物公司产品;脂质体2000为Invitrogen公司;其余试剂均为分析纯。
主要仪器:超高速离心机购自美国Beck-man公司;BTX电转化仪、PCR仪购自大连宝生物公司;Geldoc-It Imaging System购自美国UVP公司;荧光显微镜购自德国蔡司公司。
1.2 试验小鼠
6周龄ICR小鼠购于南京医科大学试验动物中心,饲养于江苏省农业科学院实验动物中心。
1.3 插入位点的选择
利用DNAstar软件比较T7 Select 415-1b与T7野生型噬菌体基因组,选择缺失位点用于真核表达盒的插入。
1.4 同源重组质粒载体构建
以T7 Select 415-1b噬菌体基因组为模板,PCR扩增插入位点左侧400 bp(L)和右侧150 bp(R)基因片段作为同源臂,并将其插入pUC-19质粒载体构建重组质粒pUC-L-R。以真核表达载体pEGFP-N1为模板,PCR扩增真核启动子(Pcmv)、EGFP、polyA尾巴等元件并进行顺序拼接成完整真核表达盒(Eukaryotic expression box,EEB),将其插入重组质粒pUC-L-R构建同源重组质粒载体pUC-LEEB-R,酶切鉴定正确的克隆送样测序鉴定。
1.5 重组噬菌体构建与鉴定
将同源重组质粒pUC-L-EEB-R导入T7噬菌体宿主E.coliBL21,挑取单菌落重组BL21细菌,过夜培养。T7 Select 415-1b噬菌体稀释至103PFU/ml,分别取10 μl T7噬菌体和BL21重组菌,加到1 ml LB培养液中,37℃培养3 h。共培养液做10倍比稀释,双层琼脂夹心法测定滴度,挑取单克隆噬菌体斑,用EGFP上、下游引物做菌落PCR鉴定,筛选阳性噬菌体斑即为同源重组噬菌体,命名为T7-EEB,提取重组噬菌体基因组酶切鉴定。
1.6 EGFP表达与鉴定
1.6.1 体外表达鉴定 将处于对数生长期的Vero细胞经胰酶消化后用无抗生素含10%胎牛血清(FCS)的MEM培养液轻轻吹下,调整细胞密度到1 ml 1.0×106个,然后均匀分布于6孔细胞培养样板,用不含抗生素的培养基调整体积到2 ml每孔,于二氧化碳培养箱37℃过夜培养。参照Invitrogen公司脂质体2000操作说明,将提取的重组T7-EEB噬菌体基因组、同源重组质粒载体pUC-L-EEB-R分别转染Vero细胞,培养24 h后荧光显微镜观察。
1.6.2 体内表达鉴定 15只小鼠随机分为3组,每组5只,即pUC-L-EEB-R质粒免疫组、T7-EEB重组噬菌体免疫组和空白对照组。于0周免疫组小鼠左后腿肌肉注射盐酸布比卡因50 μl(0.5 mg/ml)预处理,3 d后同部位注射pUC-L-EEB-R质粒DNA 100 μl(1 μg/μl)和T7-EEB重组噬菌体颗粒100 μl(1×1011PFU/ml);14 d后同等剂量加强免疫1次。分别于首免疫和二免后7 d经活体成像系统(南京大学生命科学学院协助)检测EGFP表达情况;并在二免后14 d处死小鼠,采集肝脏、脾脏提取总RNA,RT-PCR检测EGFP基因mRNA转录水平。
2 结果
2.1 插入位点及构建流程
对比T7 Select 415 1b噬菌体与野生型T7噬菌体基因组,发现T7 Select 415 1b基因组有4个缺失位点,其中在左侧578~579 bp有2 168 bp缺失,适合插入外源基因。选择578 bp处作为插入位点,以同源重组的方式将真核表达盒导入,操作流程见图1。

图1 同源重组示意图Fig.1 A schematic diagram of homologous recombinanation
2.2 同源重组质粒鉴定
构建的同源重组质粒载体pUC-L-EEB-R分别用左侧同源臂5′端XhoⅠ和右侧同源臂3′端BamHⅠ双酶切鉴定,观察到长度约2 200 bp的预期条带,测序结果进一步证实所构建的载体与设计一致。表明该同源重组质粒载体pUC-L-EEB-R构建成功(图2)。
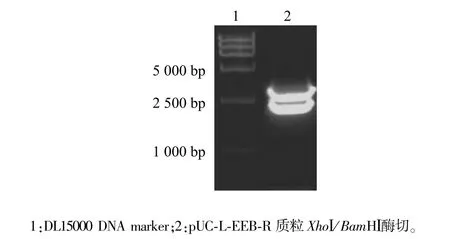
图2 同源重组质粒载体酶切鉴定Fig.2 Identification of homologous recombinant vector by enzyme digestion
2.3 重组噬菌体筛选与鉴定
挑取待鉴定噬菌斑,用针对EGFP基因的上下游引物做菌落PCR,5个噬菌斑扩增出3个720 bp目的条带,初步筛选到插入真核表达盒的重组噬菌体T7-EEB(图3)。扩繁T7-EEB重组噬菌体并提取基因组,以位于T7 Select 415 1b噬菌体基因组左侧3 805位的SmiⅠ位点进行酶切鉴定。T7 Select 415 1b基因组酶切获得3 800 bp目的条带,而T7-EEB基因组酶切获得5 000 bp目的条带,条带大小符合预期(图4)。通过菌落PCR初步筛选到阳性重组噬菌体,酶切鉴定确定该重组噬菌体成功插入真核表达盒。
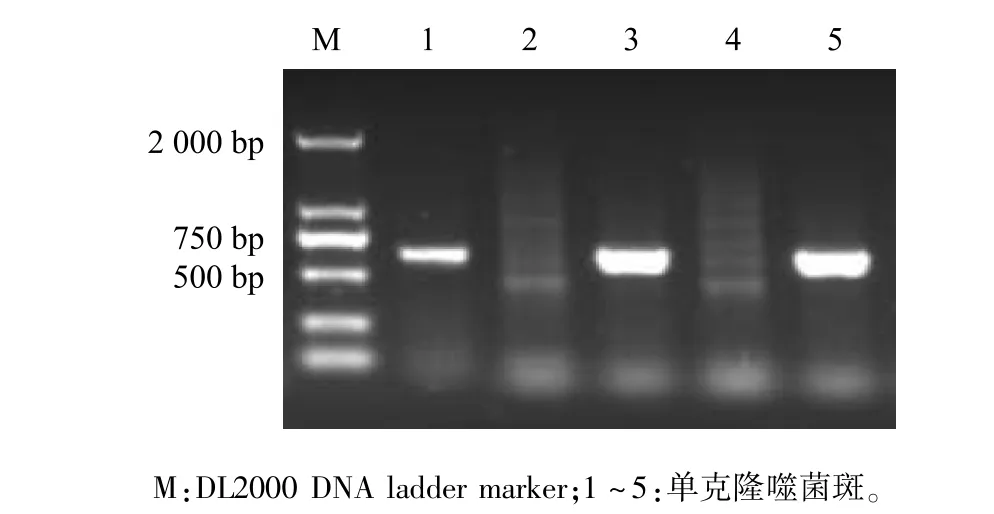
图3 重组噬菌体PCR鉴定Fig.3 Identification of recombinant phage by PCR
2.4 T7-EEB噬菌体基因组体外表达
构建的真核表达盒能够在真核细胞中表达EGFP标签蛋白质(图5)。同源重组质粒pUC-L-EEB-R(图5A)转染效率较高,视野内可见多个细胞表达;T7-EEB基因组(图5B)分子量较大,转染效率较为低下,仅单个细胞可见蛋白质表达;细胞空白对照(图5C)未见显色,没有蛋白质表达。
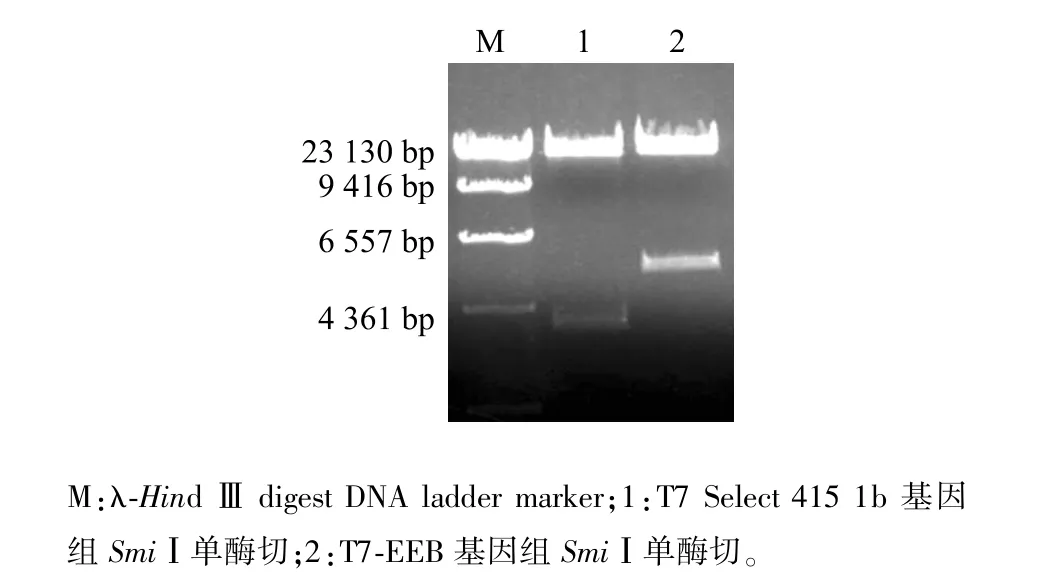
图4 噬菌体基因组酶切鉴定Fig.4 Identification of phage genome by enzyme digestion
2.5 T7-EEB介导体内表达
首次免疫后7 d经活体成像系统检测EGFP蛋白质表达情况,T7-EEB免疫小鼠能够检测到EGFP蛋白质发射信号,而pUC-L-EEB-R免疫后未能检测到信号(图6A);在二次免疫后7 d,T7-EEB和pUC-L-EEB-R免疫小鼠均能检测到信号(图6B),空白对照均未检测到信号(图6A和图6B)。说明T7-EEB免疫后EGFP蛋白质的表达比pUCL-EEB-R免疫后更加迅速。
二次免疫后取小鼠肝脏、脾脏提取总RNA,RTPCR检测编码EGFP蛋白质的mRNA转录水平。结果(图7)显示,电泳条带可见T7-EEB免疫组mRNA转录水平高于pUC-L-EEB-R免疫组,空白对照未能扩增出目的条带。
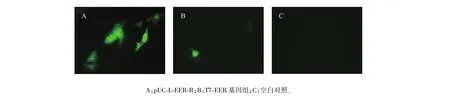
图5 EGFP真核表达Fig.5 Eukaryotic expression of EGFP

图6 免疫小鼠活体荧光检测Fig.6 Fluorescence images of immunized mice
3 讨论

图7 mRNA转录RT-PCR检测Fig.7 Detection of mRNA transcription by RT-PCR
T7噬菌体载体Novagen公司独家产品,是一种烈性噬菌体,在胞浆内组装子代粒子,成熟的噬菌体通过细胞裂解而释放。该T7噬菌体载体对比野生型T7噬菌体其基因组左侧578 bp处有约2 000 bp缺失,理论上可用于插入外源基因而不影响T7噬菌体生物学性状。本研究将携带真核表达盒的质粒导入T7噬菌体宿主细菌BL21,在噬菌体繁殖时完整基因组与质粒的同源重组,进而筛选出插入真核表达盒的重组噬菌体。T7噬菌体繁殖迅速,每个宿主细胞释放约200个子代噬菌体粒子,本构建方法没有引入有效的筛选标记,如何提高筛选几率决定该方法的可操作性。本研究中以极低的感染复数感染宿主细胞,增加T7噬菌体在宿主细菌中的循环次数进而提高同源重组几率。重组T7噬菌体由于复制负担增加,在平皿上表现出较小的噬斑形态,挑选形态较小的噬斑进行菌落PCR鉴定能够提高筛选阳性率。本研究从5个单噬斑中筛选到3个疑似阳性克隆,证明同源重组方法构建重组噬菌体具有可行性。
利用完整噬菌体粒子作为真核表达盒的转运载体是一个比较新的途径。在这个过程中,克隆到噬菌体基因组中的真核表达盒携带保护性抗原基因,以完整的噬菌体粒子免疫动物,在噬菌体被免疫细胞吞噬、裂解后释放出的真核表达盒利用宿主细胞表达元件启动保护性抗原的表达。Clark等[11-13]用包含乙肝表面抗原表达盒的完整的λ噬菌体颗粒免疫动物发现其免疫保护效果是裸露的核酸疫苗的10倍左右。噬菌体转运真核表达盒与传统质粒DNA疫苗传递系统相比在对核酸酶的稳定性方面有明显优势;而且噬菌体颗粒被免疫细胞吞噬,抗原递呈效率更高。本研究中,基因组的体外瞬时转染证明噬菌体携带的真核表达盒可以实现蛋白质的表达,由于T7-EEB基因组分子量远大于pUC-LEEBR,其转染效率较低所表达的EGFP蛋白量也相对较少。相反,T7-EEB免疫组相比pUC-L-EEB-R免疫组,其EGFP表达更为迅速、表达量更高,间接说明噬菌体颗粒转运真核表达盒作为DNA疫苗免疫的新途径效率更高效果更好。
噬菌体进入体内会很快被循环系统清除,但是在脾脏可以检测到存活的噬菌体,其存活周期可以达到14~21 d[14]。在噬菌体治疗过程中,兔子口服噬菌体后血浆中能检测到活性噬菌体,并且能够检测到针对噬菌体衣壳蛋白质的特异性体液免疫反应[15]。本研究中所用T7噬菌体衣壳蛋白质p10B还可以用于外源多肽的表面展示,可在其表面展示抗原表位激发体液免疫反应,而基因组中嵌合的真核表达盒可以表达蛋白质激发细胞免疫反应,可以进一步升级该系统达到体液、细胞免疫的双重激发。因此,基于该理念开发噬菌体疫苗并且可以通过口服途径进行免疫,将会是一种具有良好前景的疫苗研发策略。
[1] MA L.DNA vaccines:an historical perspective and view to the future[J].Immunol Rev,2011,239(1):62-84.
[2] MICHELE A K,DAVID B W.DNA vaccines:ready for prime time[J].Nature Reviews Genetics,2008(9):776-788.
[3] PASETTI M F,BARRY E M,LOSONSKY G,et al.AttenuatedSalmonella entericaserovar Typhi andShigella flexneri2a strains mucosally deliver DNA vaccines encoding measles virus hemagglutinin,inducing spcific immune responses and protection in cotton rats[J].J Virol,2003,77(9):5209-5217.
[4] PACHUK C J,MCCALLUS D E,WEINER D B,et al.DNA vaccines-challenges in delivery[J].CurrOpin Mol Therapy,2000,2 (2):188.
[5] DUBENSKY T W,LIU M A,ULMER J B.Delivery systems for gene based vaccines[J].Mol Med,2000,6(9):723.
[6] ERTL H C,XIANG Z.Novel vaccine approaches[J].J Immunol,1996,156(10):3579-3582.
[7] FYNAN E F,WEBSTER R Q,FULLER D H,et al.DNA vaccines:Protectivev immunizations by parenteral mucosal,and genegun inoculations[J].Proc Natl Acad Sci USA,1993,90(24): 478-482.
[8] HAO T,MCKEEVER U,HEDEY M L.Biological potency of microsphere encapsulated plasmid DNA[J].J Controlled Release, 2000,69:249.
[9] GUPTA R K,CHANG A C,SIBER G R.Biodegradable polymer microspheres as vaccine adjuvants and delivery systems[J].Deve BiolStand,1998,92:63.
[10]徐 海,王义伟,鲍 熹,等.表面展示GnRH重组T7噬菌体构建及其免疫效果[J].江苏农业学报,2014,30(4):809-813.
[11]CLARK J R,MARCH J B.Bacteriophage-mediated nucleic acid immunization[J].FEMS Immunol Med Microbiol,2004,40 (1):21-26.
[12]CLARK J R,MARCH J B.Bacterial viruses as human vaccines? [J].Expert Rev Vaccines,2004,3(4):463-476.
[13]CLARK J R,BARTLEY K,JEPSON C D,et al.Comparison of a bacteriophage-delivered DNA vaccine and a commercially available recombinant protein vaccine against hepatitis B[J].FEMS Immunol Med Microbiol,2011,61(2):197-204.
[14]KELLER R,ENGLEY F B.Fate of bacteriophage particles introduced into mice by various routes[J].Proc Soc Exp Biol Med, 1958,1:577-580.
[15]REYNAUD A,CLOASTRE L,BERNARD J,et a1.Characteristics and diffusion in the rabbit of a phage forEscherichia coli0103.Attempts to use this phage for therapy[J].Vet Microbial, 1992,30(2-3):203-212.
(责任编辑:袁 伟)
Construction ofrecombinantbacteriophageT7deliveringeukaryotic expression box
XU Hai, BAO Xi, WANG Yi-wei, LU Yu, XU Meng-wei, HOU Ji-bo
(Jiangsu Academy of Agricultural Sciences/National Veterinary Biological Medicine Engineering Research Center,Nanjing 210014,China)
To construct a recombinant T7 phage delivering eukaryotic expression box and to detect the EGFP(enhanced green fluorecent protein)tag protein expressionin vivoandin vitro,respectively,a 400-bp fragment(L)located at the upstream of 578 bp of T7 genome and a 200-bp fragment(R)located at the downstream were used as homologous arms. Eukaryotic expression box encoding EGFP protein(EEB)was inserted into left and right arm to construct homologous recombinant plasmid vector pUC-L-EEB-R.Plasmid vector was transformed into bacterium BL21 where homologous recombinant took place during the T7 phage propagation.EGFP protein expression was identified by phage genome transfection and phage particle immunization.PCR and restriction enzyme digestion analysis demonstrated that eukaryotic expression box was inserted into T7 phage genome correctly.Visible EGFP protein expression was detected bothin vivoandin vitro.In mice liver and spleen,mRNA transcription ofEGFPgene was detected by RT-PCR as well.These results indicate that homologous recombinanation is capable to construct recombinant T7 phage which could deliver eukaryotic expression box and achieve protein expression.
homologous recombination;DNA vaccine;eukaryotic expression;T7 phage
Q939.48
A
1000-4440(2015)01-0117-05
徐 海,鲍 熹,王义伟,等.转运真核表达盒的重组T7噬菌体构建[J].江苏农业学报,2015,31(1):117-121.
10.3969/j.issn.1000-4440.2015.01.018
2014-08-07
江苏省农业科技自主创新基金项目[CX(11)4073]
徐 海(1982-),男,江苏扬州人,硕士研究生,主要从事预防兽医学方面的研究。(Tel) 13645161013;(E-mail)hai_x @126.com
侯继波,(E-mail)houjibo@jaas.ac.cn
——紫 苏

