抗白粉病黄瓜品种的叶片组织结构及其生理生化
陈夕军, 朱键鑫, 陈 羽, 张 青,2, 张家豪, 张孝然, 黄奔立
(1.扬州大学园艺与植物保护学院,江苏扬州 225009;2.苏州市农业科学院,江苏苏州 215155)
抗白粉病黄瓜品种的叶片组织结构及其生理生化
陈夕军1, 朱键鑫1, 陈 羽1, 张 青1,2, 张家豪1, 张孝然1, 黄奔立1
(1.扬州大学园艺与植物保护学院,江苏扬州 225009;2.苏州市农业科学院,江苏苏州 215155)
为明确不同黄瓜品种对白粉病的抗性机制,采用组织切片和田间接种的方法,从近130份种质中筛选出高抗(GY14A、GY4)、中抗(津春4号、津优30号)、中感(W12757、仪黄)、高感(DE843、平望乳瓜)黄瓜品种各2份,并对8份黄瓜品种的形态结构与抗性生理生化进行研究。结果表明,高抗品种叶片组织结构紧凑,栅栏组织排列整齐、紧密,且细胞壁较厚;而高感品种则细胞壁较薄,叶片组织间出现大量空隙;中抗和中感品种虽具清晰的栅栏组织,但空隙较大,说明叶片组织细胞的排列整齐和紧密度以及细胞壁的厚度与黄瓜品种对白粉病的抗性密切相关。病原菌接种后,抗性品种体内防御酶活性上升速度与幅度都明显高于感病品种,且过氧化物酶(POD)同功酶谱带较深,H2O2积累较慢。另外,抗性品种叶片中可溶性蛋白质含量明显高于感病品种,而可溶性糖含量则明显低于感病品种,还原糖含量无明显差异。
组织结构;生理生化机制;白粉病;抗病性;黄瓜
近年来,随着保护地蔬菜种植面积的不断扩大,病害亦日趋严重。黄瓜白粉病是保护地蔬菜的重要病害之一,一般年份造成损失10%~20%,重病年可达50%以上,严重影响了黄瓜的产量与品质[1]。筛选与培育抗性品种是防治黄瓜白粉病最经济有效的手段,因此研究黄瓜抗病机制并在生产上加以应用,就显得尤为迫切。
植物的抗病性与其形态结构密切相关,表皮毛数量、蜡质层和角质层厚度、表皮细胞壁的结构(木栓化、木质化、钙化和硅化程度),以及气孔、水孔和皮孔等自然孔口的形状、大小和位置等,都会影响到寄主植物的抗病性[2-5]。而植物表皮组织排列的整齐度、紧密性和层数对病菌的侵入和扩展亦可产生重要影响[3]。
植物体内除本身存在的抗菌物质,如酚类、皂角苷、不饱和内酯、芥子油、有机硫化物和糖苷类化合物外,常为抵抗病原物侵染等逆境而产生其他一些抗菌物质,如过氧化氢[6-7]、抗坏血酸[8-9]以及防御酶[6,10],这些物质对于作物对病原物的抗性起重要作用,特别是防御酶类。苯丙氨酸解氨酶与植物体内酚类物质的合成相关;多酚氧化酶则可将酚氧化成醌,这些醌类物质对病原菌具有很强的毒性,亦可作为植保素合成的前体,参与植物对病原菌的生理和物质防御[11];而过氧化物酶则催化过氧化氢与多种有机或无机氢供体发生氧化还原反应;超氧化物歧化酶作为重要的防御酶类,可清除寄主体内过多的氧自由基,保护膜系统。本研究拟通过比较不同抗感白粉病黄瓜品种组织结构与相关抗性物质的差异,初步探明黄瓜抗白粉病机制,为建立该病的综合防控措施提供理论依据。
1 材料与方法
1.1 供试材料
供试黄瓜种质:GY14A、GY4,高抗;津优30号、津春4号,中抗;WI2757、仪黄,中感;平望乳瓜、DE843,高感[12-13]。以上种质均由扬州大学园艺与植物保护学院陈学好博士提供。黄瓜种子浸种、催芽后,播于塑料穴盘的伯爵泥炭-2育苗基质中,2片真叶后移栽至盆钵中备用。
供试菌源:黄瓜白粉病菌采自扬州大学试验基地大棚黄瓜病叶,经鉴定确认后,于黄瓜感病品种上扩繁备用。
1.2 黄瓜抗白粉病鉴定[14]
将于感病黄瓜品种上扩繁的白粉病菌孢子用毛笔轻轻刷入无菌水中,并向其中加入少许吐温-20,配成1 ml 1×106个孢子的孢子液。将孢子液均匀喷施于第2片真叶完全展开的黄瓜幼苗叶片上,清水作空白对照,每处理10株,3次重复。10 d后调查病株率及病级,计算病情指数。病级分级标准如下: 0级,无病斑;1级,病斑占叶面积的1/5以下,白粉模糊不清;2级,病斑占叶面积1/5~1/3,白粉较为明显;3级,病斑占叶面积1/3~1/2,白粉层较厚、连片;4级,病斑占叶面积1/2~2/3,白粉层浓厚,叶片开始变黄、坏死;5级,病斑占叶面积2/3以上,叶片枯黄。
1.3 组织切片制作
参照方中达的方法[15],略有改动。取黄瓜5~6叶期叶片,切成3 mm×3 mm方块,FAA固定液固定,铁矾液媒染2 h,再以苏木精预染2 h。分别以10%、30%、50%、70%、85%、95%和无水乙醇(3次)递度脱水,每级停留20~30 min。再以无水乙醇∶二甲苯3∶1液、无水乙醇∶二甲苯1∶1液、无水乙醇∶二甲苯1∶3液和二甲苯(3次)依次透明处理,每次处理20 min。透明处理后的材料于二甲苯∶石蜡1∶1溶液中浸蜡,65℃烘箱中1 h;烘箱温度调为60℃,并向其中加入纯石蜡3次,每次间隔1 h。将浸蜡瓶从烘箱中取出后迅速倒入包埋盒中,材料置于盒底,整个包埋盒移至冷水中冷却,完成包埋。对包埋有材料的蜡块进行修块和切片,并将切片轻放于涂有薄层蛋白质甘油和蒸馏水的玻片上,60℃烤片30 min,用滤纸吸除多余的水分。先用二甲苯和乙醇溶液脱蜡,再以伊红染色,最后在材料中央滴加适量树胶,以脱脂盖玻片封片,形成永久玻片,显微镜下观察组织结构。
1.4 防御酶活性测定
将1 ml 1×106个孢子的孢子液均匀喷施于5~6片真叶的黄瓜植株上,分别于接种前、接种后1 d、3 d、5 d和7 d取倒2至倒3叶片进行相关防御酶活性测定,每处理3次重复。苯丙氨酸解胺酶(PAL)、多酚氧化酶(PPO)和过氧化物酶(POD)等活性测定参照孔凡明等的方法[16]进行,超氧化物歧化酶(SOD)活性测定参照邹琦的方法[17]进行。
1.5 糖含量测定
可溶性糖含量测定参照张妙霞等的蒽酮-稀硫酸法[18]。以葡萄糖绘制可溶性糖标准曲线,糖含量计算公式为:可溶性糖含量(%)=[C×(V/a)×n]/ (W×106),式中,C为标准方程求得的糖质量(μg),a为吸取的样品液体积(ml),V为提取液体积(ml),n为稀释倍数,W为组织质量(g)。
还原糖含量测定参照袁晓华等的3,5-二硝基水杨酸比色法[19]。以葡萄糖绘制还原糖标准曲线,糖含量计算公式为:还原糖含量(%)=[C×(V/a)]/(W×10),式中,C为标准曲线方程求得的还原糖质量(mg),V为提取液体积(ml),a为显色时吸取的样品液体积(ml),W为样品质量(g)。
1.6 可溶性蛋白质含量测定
参照邹琦的方法[17]。取接种后叶片0.5 g,剪碎后加入5 ml蒸馏水研磨,匀浆后于4 000 r/min下离心10 min。取上清1.0 ml于具塞试管中,加入5 ml考马斯亮蓝G-250溶液充分混匀。放置2 min后,于595 nm下读取吸光值。以牛血清蛋白制作标准曲线。样品中可溶性蛋白质含量(mg/g)=(C×VT)/(V1×FW×1 000),式中,C为查得的标准曲线值(μg),VT为提取液总体积(ml),V1为测定时加样量(ml),FW为样品鲜质量(g)。
1.7 木质素含量的测定
参照波钦诺克的方法[20]。以淀粉作指示剂,以0.1 mol/L Na2S2O3溶液为滴定液,滴定至溶液变为蓝绿色为止(滴定终点)。木质素含量(%)= [0.043×K×(a-b)]/FW,K为Na2S2O3的浓度,FW为样品鲜质量(g),a为滴定对照液所用Na2S2O3体积(ml),b为滴定样品液所用Na2S2O3体积(ml)。
1.8 过氧化氢含量的测定
参照邹琦的方法[17]。标准曲线绘制时的比色波长为415 nm,光径1 cm。过氧化氢含量(μmol/g)=(C×VT)/(FW×V1),C为标准曲线上查得的H2O2量(μmol),VT为样品提取液总体积(ml),V1为测定时所用样品提取液体积(ml),FW为植物组织鲜质量(g)。
2 结果与分析
2.1 不同黄瓜品种对白粉病的抗性
对高抗、中抗、中感和高感白粉病品种各2个再次进行温室鉴定,结果表明各品种抗性差异明显,其中GY14A和GY4完全抗病,而DE843的病株率和病情指数则分别为40.33%和6.82,平望乳瓜的病株率和病情指数分别为46.73%和7.14(表1)。
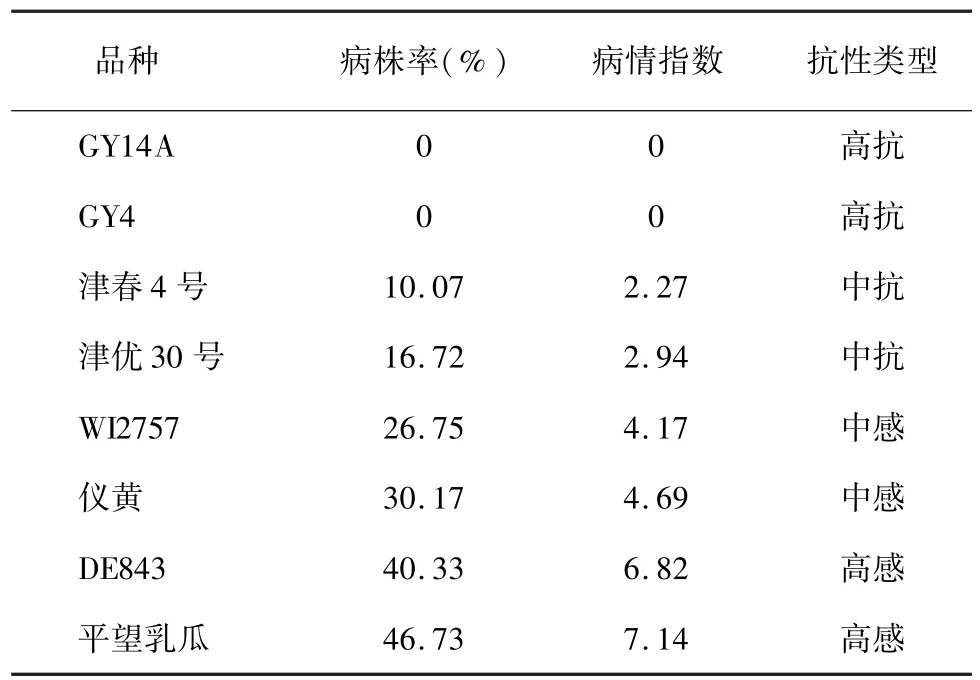
表1 黄瓜不同抗性品种的病株率与病情指数Table 1 Incidences and disease indexes of cucumber cultivars with different resistances to powdery mildew
2.2 不同抗性黄瓜品种的叶片组织结构差异
从图1可以看出,高抗品种的组织结构紧凑,细胞壁较厚,栅栏组织排列整齐、紧密,海绵组织紧贴栅栏组织,且都较清晰;而高感品种的叶片组织出现大量空隙,较难见到完整细胞,细胞壁较薄,栅栏组织排列稀松,与海绵组织之间也没有明显界限,表皮细胞层也远薄于其他品种;中抗品种的细胞壁要薄于高抗品种,栅栏组织虽不及高抗品种紧密,但要远好于平望乳瓜等高感品种;中感品种虽能见到清晰的栅栏组织,但空隙仍较大。由此可见,叶片组织细胞排列整齐、紧密,细胞壁较厚可能是黄瓜抗白粉病的主要原因之一。

图1 不同抗性黄瓜品种叶片组织显微结构Fig.1 Microstructures of the leaves of cucumber cultivars with different resistances to powdery mildew
2.3 不同抗性黄瓜品种接种前后防御酶活性的变化
接种前后各品种防御酶活性的变化见图2。接种前,各品种苯丙氨酸解胺酶(PAL)活性差异不大;接种后,高抗品种GY14A和GY4的PAL活性明显上升,1 d后达最大值;而中抗品种的出峰时间明显滞后,接种后3 d活性才达最大值;感病品种PAL活性在接种后明显下降。接种前,各品种体内过氧化物酶(POD)活性较低,且与品种抗性表现无相关性;接种后,抗性品种体内POD活性及上升幅度明显高于感病品种,且维持时间较长。接种前,以抗性品种体内多酚氧化酶(PPO)活性较高;接种后,亦以抗性品种体内PPO的上升幅度较大,并在接种后1 d达最大值;感病品种在接种前后PPO活性的变化并无明显的规律。接种前抗性品种体内超氧化物歧化酶(SOD)活性明显低于感病品种;接种后抗性品种体内SOD活性急剧上升,且一直维持在较高水平;而感病品种SOD活性却在接种后急剧下降,直至第5 d才回复到原来水平。由此可见,几种防御酶在接种白粉病菌的抗性黄瓜品种体内都可被强烈诱导,而在感病品种中表现并不一致,说明防御酶与品种抗性有显著相关性。
2.4 不同抗性黄瓜品种接种前后糖含量的变化
可溶性糖含量测定结果表明,抗病黄瓜品种中可溶性糖含量明显低于感病品种。接种后,抗病品种中可溶性糖含量出现缓慢下降;而感病品种中,则出现明显的短暂上升,并分别于第1至第3 d达最大值,然后急剧下降(图3)。还原糖含量在抗感白粉病黄瓜品种中并无明显差异,均呈波浪性起伏。由此可见,抗性品种在接种白粉病菌后,可通过降低体内可溶性糖含量来提高自身对病原物的抗性。
2.5 不同抗性黄瓜品种接种前后可溶性蛋白质含量的变化
不同抗性品种在接种前,其体内可溶性蛋白质含量无明显差异。接种1 d后,高抗品种中可溶性蛋白质含量急剧上升,然后又急剧下降,第3 d时与其他品种已基本无差异(图4)。说明,抗性品种可通过短时间里提高自身可溶性蛋白质含量来提高对病原物的抗性。
2.6 不同抗性黄瓜品种接种前后木质素含量的变化
较高的木质素含量是抗病品种的基本特征。接种前,抗性品种体内的木质素含量明显高于感病品种;接种后,所有品种中木质素含量都有所增加,且抗感品种趋势一致,但感病品种木质素含量总体低于抗病品种(图5)。
2.7 不同抗性黄瓜品种接种前后过氧化氢含量的变化
接种前,抗感品种体内过氧化氢含量虽有不同,但差异较小;接种后,各品种体内过氧化氢含量都有一短期(3 d)内上升的过程,但以感病品种上升幅度较大,而抗性品种增幅平缓(图6)。
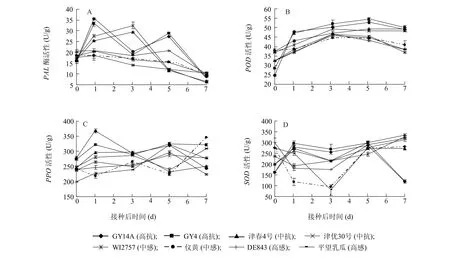
图2 不同抗性黄瓜品种接种后体内防御酶活性变化Fig.2 Changes of defense enzymes activities in cucumber cultivars with different resistances to powdery mildew after inoculation
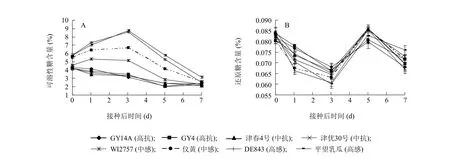
图3 不同抗性黄瓜品种接种后体内糖含量变化Fig.3 Changes of sugar contents in cucumber cultivars with different resistances to powdery mildew after inoculation
3 讨论
植物体形态结构常与其对逆境的适应性有关。不同生境下,热带植物对木质部腔化的抗性与其茎叶的结构密切相关[21]。高抗梨黑星病的早金香梨叶片栅栏组织为2层、较厚,且海绵组织致密,表面蜡质也较厚;而感病品种则仅有一层栅栏组织,且较薄,海绵组织疏松[22]。大豆抗灰斑病品种叶片亦表现栅栏组织排列整齐、紧密、层数较多等抗性结构特征,感病品种则表现栅栏组织层数少、排列疏松等易感特征[3]。本研究结果表明,在黄瓜抗白粉病品种中,其栅栏组织排列整齐、紧密,且细胞壁较感病品种明显偏厚。感病品种中,叶片组织间出现大量空隙,栅栏组织与海绵组织间分界模糊,表皮层较薄。这些结果说明,黄瓜叶片的组织结构与其对白粉病的抗性密切相关。
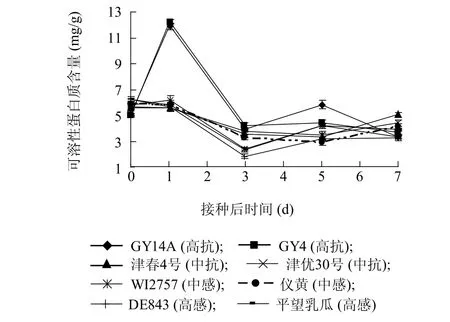
图4 不同抗性黄瓜品种接种后体内可溶性蛋白质含量变化Fig.4 Changes of soluble protein contents in cucumber cultivars with different resistances to powdery mildew after inoculation

图5 不同抗性黄瓜品种接种后体内木质素含量变化Fig.5 Changes of lignin contents in cucumber cultivars with different resistances to powdery mildew after inoculation
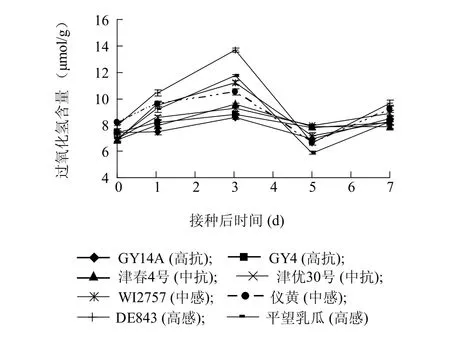
图6 不同抗性黄瓜品种接种后体内过氧化氢含量变化Fig.6 Changes of H2O2contents in cucumber cultivars with different resistances to powdery mildew after inoculation
大量研究结果表明,寄主对病原物的抗性亦与其体内的防御酶和一些次生代谢物质有关。寄主在受到外界生物或非生物因素诱导后,为抵抗病原物侵染或逆境的影响,体内防御酶活性和次生代谢物含量会发生明显变化[23-24]。如核黄素可及时诱导甜菜体内过氧化氢的产生和酚类物质的积累,同时上调其PAL和cprx1基因的表达[25];含氮杂环类化合物可诱导黄瓜体内防御酶的活性大大提高,从而增强其对白粉病的抗性[10]。另外,PAL是连接植物初级代谢和苯丙烷类代谢、催化苯丙烷类代谢第一步反应的酶,PAL活性的提高可使苯丙烷类物质更高效地转化而形成木质素、类黄酮等物质,提高植物的抗病性。本研究结果表明,接种病原菌后,黄瓜抗感白粉病品种中防御酶活性变化并不一致,抗性品种在接种后短期内酶活上升明显,而且持续时间较长;而感病品种的酶活性上升有滞后现象,且上升幅度较小。这也进一步说明,抗白粉病黄瓜品种在清除体内氧自由基以及合成与抵抗病菌侵入的次生代谢物方面,能力要高于感病品种。
有关植株体内糖含量与其抗病性的关系研究结果并不一致。龙书生等[26]认为,玉米茎秆内的可溶性糖、还原糖和总糖的量与植株的抗性呈显著正相关,糖分含量的高低可作为其抗镰刀菌茎腐病的育种指标。而云兴福[27]则认为,黄瓜子叶和同一植株不同叶位真叶内可溶性糖含量与其对霜霉病的抗性呈高度正相关;还原糖含量及还原糖与总糖比则与抗病性呈高度负相关。本研究发现,黄瓜抗白粉病品种中可溶性糖含量明显低于感病品种,且在接种病原菌后,其含量有下降趋势;而感病品种中却有短时上升现象。而且,还原糖含量在抗、感白粉病黄瓜品种中并无明显变化规律。同样,不同植物被不同病原菌侵染后,其体内的可溶性蛋白质含量变化亦并不相同[28-29]。这是由于糖和可溶性蛋白质含量本就与植物对病原菌抗性无关,还是由于寄主对不同病原菌表现抗性的机理不同,有待进一步研究。
[1] 冯东昕,李宝栋.主要瓜类作物抗白粉病育种研究进展[J].中国蔬菜,1996(1):55-59.
[2] 李海英,倪红涛,杨庆凯.大豆叶片结构与灰斑病抗性的研究Ⅰ:大豆叶片气孔密度、茸毛密度与灰斑病抗性的关系[J].中国油料作物学报,2001,23(3):52-53.
[3] 李海英,刘亚光,杨庆凯.大豆叶片结构与灰斑病抗性的研究Ⅱ:大豆叶片组织结构与灰斑病抗性的关系[J].中国油料作物学报,2002,24(2):58-60.
[4] FORD C M.Identification of seedless table grape cultivars and a bud sport berry[J].Horticulture Science,1993,17(3):366-368.
[5] NAGDY P L,BOYD D J.Binary pathway for analysis of primary infection and host response in populations of powdery mildew fungi [J].Canadian Journal of Botany,1993,57:497-511.
[6] 沙爱华,黄俊斌,林兴华,等.水稻白叶枯病成株抗性与过氧化氢含量及几种酶活性变化的关系[J].植物病理学报,2004, 34(4):340-345.
[7] KIM KHIOOK I L,SCHNEIDER C,HELOIR M C,et al.Image analysis methods for assessment of H2O2production andPlasmopara viticoladevelopment in grapevine leaves:application to the evaluation of resistance to downy mildew[J].Journal of Microbiological Methods,2013,95(2):235-244.
[8] 马雪瑞,段玉玺,陈立杰,等.利用抗坏血酸揭示小粒黑豆对胞囊线虫抗性的研究[J].大豆科学,2011,30(1):123-126.
[9] KERCHEV P I,PELLNY T K,VIVANCOS P D,et al.The transcription factor ABI4 is required for the ascorbic acid-dependent regulation of growth and regulation of jasmonate-dependent defense signaling pathways in Arabidopsis[J].The Plant Cell,2011, 23:3319-3334.
[10]陈喜文,郝友进,陈德富,等.含氮杂环化合物对黄瓜白粉病抗性的诱导作用及其与防御酶系统的关系[J].植物病理学报, 2003,33(6):535-540.
[11]郭红莲,程根武,陈 捷,等.玉米灰斑病抗性酚类物质代谢作用的研究[J].植物病理学报,2003,33(4):342-346.
[12]吕淑珍,马德华,霍振荣,等.优质抗病高产黄瓜新品种-津春4号[J].中国蔬菜,1994(2):1-3.
[13]蔡建华,黄奔立,朱键鑫,等.黄瓜不同种质材料白粉病田间发病调查及抗性分析[J].江苏农业科学,2006(6):152-155.
[14]陈夕军,沈世炜,陈银凤,等.氯化胆碱诱导黄瓜抗白粉病机理研究[J].中国蔬菜,2013(18):81-87.
[15]方中达.植病研究方法[M].北京:中国农业出版社,1998: 91-108.
[16]孔凡明,许志刚.水稻不育系抗白枯病与体内酶活性变化的关系[J].安徽农业大学学报,1998,25(3):217-223.
[17]邹 琦.植物生理学实验指导[M].北京:中国农业出版社, 2000:163-164.
[18]张妙霞,孔祥生,郭秀璞,等.蒽酮法测定可溶性糖显色条件的研究[J].洛阳农专学报,1997,17(4):24-28.
[19]袁晓华,杨中汉.植物生理生化实验[M].北京:高等教育出版社,1993:108.
[20]波钦诺克X H.植物生物化学分析方法[M].荆家海,丁钟荣,译.北京:科学出版社,1981:178-181.
[21]MARKESTEIJN L,POORTER L,PAZ H,et al.Ecological differentiation in xylem cavitation resistance is associated with stem and leaf structural traits[J].Plant,Cell&Environment,2011, 34(1):137-148.
[22]姜淑苓,贾敬贤,王 斐,等.早金香梨抗黑星病鉴定及组织结构与抗病关系研究[J].中国农学通报,2009,25(4):215-217.
[23]HAO Y H,WU C F,ZHAO D W,et al.Proteomic analysis of glucohexaose induced resistance to downy mildew in‘Cucumis Sativus'[J].Australian Journal of Crop Science,2013,7(9): 1242-1251.
[24]CHEN F,WANG M,ZHENG Y,et al.Quantitative changes of plant defense enzymes and phytohormone in biocontrol of cucumber Fusarium wilt byBacillus subtilisB579[J].World Journal of Microbiology and Biotechnology,2010,26(4):675-684.
[25]TAHERI P,TARIGHI S.A survey on basal resistance and riboflavininduced defense responses of sugar beet againstRhizoctonia solani[J].Journal of Plant Physiology,2011,168(10):1114-1122.
[26]龙书生,李亚玲,张宇宏,等.糖分含量作为抗镰刀菌茎腐病玉米品种的育种指标研究[J].山东农业大学学报,1999,30 (4):372-376.
[27]云兴福.黄瓜组织中氨基酸、糖和叶绿素含量与其对霜霉病抗性的关系[J].华北农学报,1993,8(4):52-58.
[28]景 岚,王丽芳,康 俊.不同抗性的向日葵品种接种锈菌后叶片中可溶性蛋白、可溶性总糖及叶绿素含量的变化[J].临沂师范学院学报,2008,30(6):76-80.
[29]周博如,李永镐,刘太国,等.不同抗性的大豆品种接种大豆细菌性疫病菌后可溶性蛋白、总糖含量的变化研究[J].大豆科学,2000,10(2):111-114.
(责任编辑:张震林)
Physiological and biochemical mechanism of cucumber cultivars resistant to powdery mildew and their differences in microstructure of leaves
CHEN Xi-jun1, ZHU Jian-xin1, CHEN Yu1, ZHANG Qing1,2, ZHANG Jia-hao1, ZHANG Xiao-ran1, HUANG Ben-li1
(1.College of Horticulture and Plant Protection,Yangzhou University,Yangzhou 225009,China;2.Suzhou Academy of Agricultural Sciences,Suzhou 215155,China)
To define the resistance mechanism of cucumber to powdery mildew,eight cucumber cultivars,selected from near 130 cultivars with different resistance levels to powdery mildew,were involved to research the differences of microstructures and physiological and biochemical indexes.Cucumber cultivars GY14A and GY4 are highly resistant,Jinchun No.4 and Jinyou No.30 are moderately resistant,W12737 and Yihuang are moderately susceptible,and DE843 and Pingwangrugua are highly susceptible.The highly resistant cultivars showed arranged palisade tissues thick cell walls while the highly susceptible cultivars exhibited thin cell walls and a great number of interspaces among cells.The palisade tissues were clearly seen in moderately resistant and susceptible cultivars,however,with large interspaces among the cells.The results indicated that the resistance levels of cucumber cultivars were associated with the arrangement and compactness of leaf cells and the thickness of their cell walls.After inoculation withSphaerotheca fuliginea,the increases of defense enzymes activities of resistant cultivars were greater than those of susceptible cultivars.ThebandsofPODisozymes of resistant cultivars were much darker,and the accumulations of H2O2were slower.In addition,the contents of soluble proteins in the resistant cultivarswere higher than those in the susceptible cultivars while the soluble sugar contents were lower.The reducing sugar contents had no obvious difference.
tissue structure;physiological and biochemical mechanism;powdery mildew;resistance;cucumber
S436.421.1+2
A
1000-4440(2015)01-0055-07
陈夕军,朱键鑫,陈 羽,等.抗白粉病黄瓜品种的叶片组织结构及其生理生化[J].江苏农业学报,2015,31(1):55-61.
10.3969/j.issn.1000-4440.2015.01.008
2014-07-07
江苏省农业科技自主创新基金项目[CX(12)3019];江苏省自然科学基金项目(BK2010305)
陈夕军(1973-),男,江苏阜宁人,博士,副教授,专业方向为植物病害及其防控。(E-mail)xjchen@yzu.edu.cn
黄奔立,(E-mail)yzhbl2003@163.com;张 青,(E-mail) zhangqingsz@163.com

