187例胰腺癌手术风险分析
刘涛 张宏 孙诚谊
·论 著·(临床实践)
187例胰腺癌手术风险分析
刘涛 张宏 孙诚谊
目的 探讨影响胰腺癌手术风险因素,总结经验教训以提高胰腺癌诊治水平。方法 回顾性分析187例胰腺癌手术病人的临床资料。选取18项可能影响胰腺癌围手术期死亡和术后并发症的相关因素,数据采用Logistic回归及χ2检验进行统计学分析,筛选出影响胰腺癌围手术期死亡和术后并发症的危险因素。结果 围手术期死亡18例,发生术后并发症者73例。影响围手术期死亡的危险因素是年龄、肝功能Child-Pugh分级、非计划再次手术,影响围手术期术后并发症的危险因素是年龄、肝功能分级、手术方式、肿瘤分期。结论 胰腺癌围手术期风险是多因素综合作用的结果,年龄、肝脏储备功能是影响胰腺癌围手术期风险的独立危险因素,其中年龄大于60岁及肝功能Child-Pugh分级C级的病人,胰腺癌围手术期死亡和术后并发症的发生率显著升高。
胰腺癌;围手术期;危险因素;回顾性分析
胰腺癌是诊断和治疗非常困难的恶性肿瘤之一,其5年存活率仅2%[1],有“癌症之王”之称,行肿瘤切除后的5年生存率仍<20%[2-3],但手术仍然是唯一有可能治愈胰腺癌并获得无瘤生存的措施。与其他手术相比,胰腺癌多为中晚期老年病人,且常伴有内科合并症,手术复杂,围手术期并发症多,死亡率高。随着营养支持、麻醉、手术技术及围术期监测等技术的提高,胰腺癌围手术期的风险已明显下降,但仍有25%左右的并发症发生率及5%左右的死亡率[4]。因此,如何在手术前准确评估胰腺癌病人的手术风险,权衡手术利弊,把握手术尺度,对提高胰腺癌病人的手术疗效、降低手术风险有着重要意义。本文通过对贵州医科大学附属医院2007年1月至2015年1月收治的187例胰腺癌手术病人的临床资料进行回顾性分析,探讨影响胰腺癌围手术期风险的危险因素,总结经验教训以提高胰腺癌诊治水平。
资料与方法
一、一般资料
187例中,男性112例,女性75例,男女比例为3∶2;年龄23~81岁,平均(57.75±12.14)岁。伴有术前合并症者67例(35.8%),主要临床表现有皮肤巩膜黄染133例(71.1%),黄疸持续时间3~120 d,平均(25.8±19.3) d,上腹部疼痛不适96例(51.3%),食欲不振90例(48.1%),体重下降120例(64.2%),腰背部疼痛58例(31.0%),腹部包块18例(9.6%)。
二、临床分型和术前肝功能Child-Pugh分级
根据胰腺癌的发生部位对胰腺癌进行临床分型,其中胰头癌159例(85.0%),胰体尾癌27例(14.4%),全胰癌1例(0.5%)。按Child-Pugh标准对肝功能进行分级,A级73例(39.1%),B级99例(52.9%),C级15例(8.0%)。
三、临床诊断及肿瘤分期
所有病例均经病理石蜡切片确诊,其中导管腺癌157例,囊腺癌9例,腺泡细胞癌9例,腺鳞癌2例,黏液腺癌7例,小细胞癌2例,高级别神经内分泌癌1例。采用Hermreck临床分期法将胰腺癌分为四期,其中Ⅰ期11例(5.9%),Ⅱ期65例(34.8%),Ⅲ期74例(39.6%),Ⅳ期37例(19.8%)。
四、手术方式
手术方式主要有胰十二指肠切除术、胰体尾+脾切除术、姑息性胆肠吻合术、姑息性胃肠吻合术、姑息性胆肠胃肠双重吻合术及探查+活检术。手术方式由术者根据肿瘤部位、肿瘤分期及可切除性、术者手术经验及围手术期病人具体情况决定。对于胰头癌主要施行胰十二指肠切除术,对于胰体尾癌主要施行胰体尾+脾切除术。行根治性手术切除71例,其中胰十二指肠切除术52例,胰体尾+脾切除术19例。行姑息性手术116例,其中胆肠吻合术55例,胃肠吻合术5例,胆肠胃肠双重吻合术32例,探查+活检术24例。
五、统计学方法
所有资料用Excel 2007建立数据库,用SPSS (19.0版)软件包进行分析,分类变量间的比较采用χ2检验。自变量选取18项可能影响胰腺癌围手术期死亡和并发症的因素(表1),分别是:性别、年龄、术前总胆红素、丙氨酸转氨酶(ALT)、天冬氨酸转氨酶(AST)、γ-谷氨酰转移酶(γ-GGT)、血糖、白蛋白、肝功能分级、术前合并症、术前减黄、手术方式、术中失血量、术中输血量、血管侵犯、手术时间、肿瘤分期、非计划再次手术。先用χ2检验、单因素Logistic回归分析进行筛选,对单因素分析差异有统计学意义的再进行多因素Logistic回归分析(Forward:LR法),P<0.05为差异有统计学意义。

表1 影响胰腺癌围手术期死亡与术后并发症的危险因素
结 果
一、围手术期死亡
187例胰腺癌病人中围手术期死亡18例(9.6%),其中男性14例,女性4例;年龄56~81岁,平均(66.6±5.6)岁。年龄>60岁者死亡17例,发生术后并发症者54例(56.8%);40~60岁年龄段死亡1例,发生术后并发症者17例(23.0%);<40岁的病人无一例死亡,发生术后并发症者2例(11.1%)。胰十二指肠切除术死亡15例(28.8%),胰体尾+脾切除术死亡2例(10.5%),姑息性胆肠吻合术死亡1例(0.8%)。因多器官功能衰竭死亡8例,胰漏合并感染或出血3例,胆漏合并感染1例,上消化道出血3例,肾衰竭、肝衰竭及重症肺部感染致呼吸衰竭各1例。非计划再次手术的胰腺癌病人9例,死亡6例,其中4例为放弃治疗后死亡,死亡原因为胃瘫再次手术死亡2例,胰瘘并腹腔感染出血死亡2例,胰瘘并感染死亡1例,腹腔大出血死亡1例,非计划再次手术死亡率为66.7%。经单因素分析显示,年龄、白蛋白、肝功能分级、术前合并症、手术方式、术中失血量、血管侵犯、肿瘤分期、非计划再次手术、术后并发症等10项因素对围手术期死亡率有统计学意义,在单因素分析的基础上,控制混杂困素,应用多因素Logistic回归分析(Forward:LR法)显示,年龄、肝功能分级、非计划再次手术是胰腺癌围手术期死亡的独立危险因素(表2)。
二、术后并发症
术后发生严重并发症者73例(39.0%),其中主要有胰漏17例次(9.1%),胆漏14例次(7.5%),腹腔内出血9例次(4.8%),多器官功能衰竭8例次(4.3%)。经单因素分析显示,年龄、肝功能分级、术前合并症、手术方式、术中失血量、术中输血量、血管侵犯、肿瘤分期等8项因素对术后并发症发生率有统计学意义,应用多因素Logistic回归分析(Forward:LR法)显示,年龄、肝功能分级、手术方式、肿瘤分期是影响胰腺癌术后并发症的独立危险因素(表3)。
将多因素分析筛选出的影响胰腺癌围手术期风险的危险因素再次进行χ2检验,比较得出影响胰腺癌围手术期风险的独立危险因素为年龄(并发症χ2=26.58,P<0.01;死亡率χ2=15.21,P<0.01)和肝功能分级(并发症χ2=34.70,P<0.01;死亡率χ2=369.56,P<0.01)。
讨 论
胰腺癌的发病率及死亡率占全部恶性肿瘤的第8~9位[5],但由于胰腺解剖关系及胰腺癌疾病本身特点,早期诊断困难,绝大多数病人就诊时已为中晚期,根治性手术切除率低。胰腺癌手术特别是胰十二指肠切除术切除范围广泛,手术复杂,涉及重要脏器及血管,导致胰腺癌围手术期并发症多,死亡率高居恶性肿瘤的第4或5位[6]。因此,如何提高胰腺癌病人手术成功率,减少围手术期死亡率及术后并发症是外科医师最为关注的问题和争议的焦点。
本研究结果显示随着年龄增加围手术期风险加大,国内外学者[7-8]均有类似报道。这可能与老年病人的特殊生理及临床特点有关,老年病人生理器官与细胞功能衰退,机体储备代偿能力及免疫力低下,且常有心肺伴发疾病,疾病应激及手术耐受能力差,术后易出现水电解质及酸碱平衡紊乱,可能因为较小的创伤打击或轻微的缺血缺氧而迅速进入严重的失代偿状态,增加了手术风险。但对于老年病人,亦有多数学者认为年龄已不再是影响术后并发症及死亡率的主要危险因素[9]。本组资料亦显示术前积极纠正内科合并症,仔细评估手术风险,适当减小手术范围能在减少手术风险的前提下改善生活质量。
有研究[10]表明肝功能分级是胰腺癌围手术期风险的独立危险因素,本文多因素分析结果与其相符,并提示肝功能分级C级病人围手术期风险显著增高。肝脏功能复杂,几乎所有的血浆蛋白及凝血因子均在肝脏合成,同时也可储备和供应能量,并具有解毒、免疫、维持水电解质平衡等功能。伴有肝功能损害的病人,往往并存不同程度的肝脏储备功能不全,同时因手术及麻醉等创伤对机体的打击又可加重肝功能损害,导致术后低蛋白血症及凝血功能障碍甚至肝衰竭。且一旦发生肝衰竭,无特别有效治疗措施逆转,易致病人围手术期死亡。因此术前必须对肝功能受损程度及代偿储备能力做充分评估,加强保肝治疗,慎重选择手术时机、范围及方式。需要指出的是,Child-Pugh分级可能亦有其局限性,本研究有2例肝功能分级A级的病人发生围手术期死亡,提示有必要综合应用其他的肝功能评估方法。因胰腺癌病人多伴有梗阻性黄疸,有研究[11]提示明显梗阻性黄疸状态下,利用99mTc-GSA SPECT/CT显像技术可能更能有效地评估肝脏储备功能。

表2 影响胰腺癌围手术期死亡的多因素Logistic回归分析结果
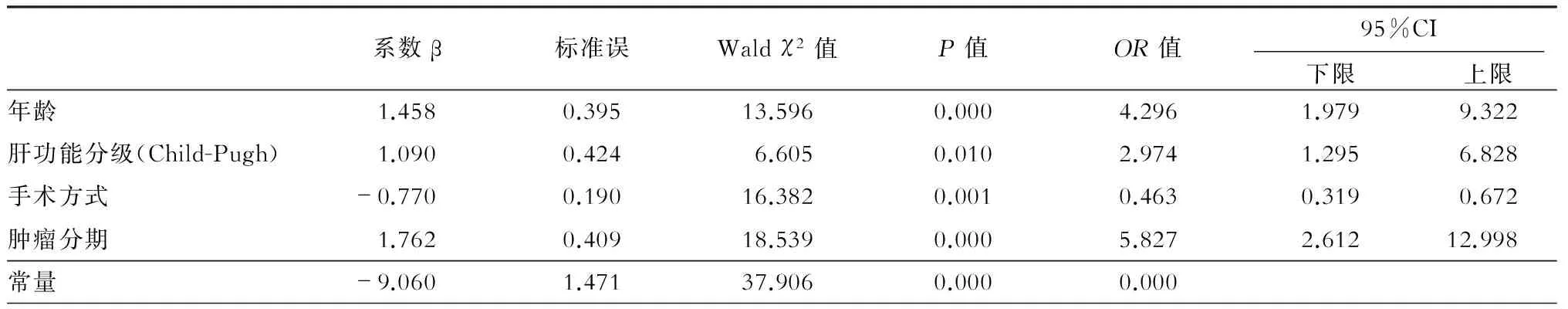
表3 影响胰腺癌术后并发症的多因素Logistic回归分析结果
有学者报道42例非计划再次手术病人中有5例死亡,死亡率11.95%[12]。本研究非计划再次手术死亡率66.7%,明显高于文献报道。可能是由于胰腺癌本身手术创伤极大,且短期内病人要经历连续手术打击,加之术后胰瘘及腐蚀血管出血引起的腹腔内感染继发全身炎症反应及多器官功能不全,病人免疫力及耐受力迅速下降,感染进行性加重,形成恶性循环,导致非计划再次手术死亡率较其他疾病明显增高。同时,因非计划再次手术导致的医疗费用增长可能亦在一定程度上增加了病人的经济负担,导致非医源性的死亡率增高。因此,非计划再次手术重在预防,应注重减少首次手术的技术失误,加强围手术期管理及监测,及时发现再次手术指征并及早手术干预,减少病人负担,对降低胰腺癌非计划再次手术死亡率有重要意义。
肿瘤分期显著增加胰腺癌围手术期风险[13],本研究也提示肿瘤分期与术后并发症率相关。因肿瘤分期较晚病人多已侵犯邻近组织,并常有淋巴结或远处转移,手术治疗为达根治目的创伤相对较大,且常有肝肾等重要脏器功能损害,肝功能分级也多为B级或C级,肝脏储备功能低下,抗打击能力弱,更易发生术后并发症,增加围手术期风险。有条件时,术前可应用超声内镜、正电子发射计算机断层显像-CT(PET-CT)及三维重建可视化仿真数字医学技术进一步明确肿瘤分期,评估胰腺癌的可切除性,制定个体化的手术方案以保障手术安全,降低围手术期风险。
手术方式是依据病情决定的,一般情况良好、肿瘤分期早的病人应尽量行根治性切除术,一般情况差,肿瘤分期晚的病人则行简单姑息性手术。有研究认为[14],姑息性手术病人常为肿瘤晚期,且常伴营养不良甚至恶病质等表现,肝肾等重要脏器功能不同程度受损,抗手术打击能力差,围手术期死亡风险明显高于根治性手术病人。本研究多因素分析虽未显示手术方式与围手术期死亡率相关,仅显示与术后并发症相关,但单因素分析显示接受根治性手术的病人死亡率(17/18)明显高于姑息性手术的病人(1/18),正好与上述结论相反,且胰十二指肠切除术并发症率及死亡率明显高于文献报道[4,15]。可能原因是本研究样本量偏小,同时为改善生活质量减少手术风险,术前已对肠系膜血管受侵等风险大的病例进行了筛选,选择了经皮肝穿刺胆管引流术(PTCD)等创伤更小的方式,缩小了姑息性手术的范围。针对胰十二指肠切除手术方式,因本研究已将壶腹周围肿瘤等行胰十二指肠切除术的病人排除在外,而胰头癌较壶腹周围肿瘤的手术切除率更低,手术风险更大,可能一定程度上增加了本研究胰十二指肠切除术的围手术期死亡率。有报道[16]指出胰十二指肠切除术后专业组与非专业组胰瘘发生率有显著差异,吻合口瘘发生主要与吻合技术缺陷有关。本资料显示围手术期死亡病人中有7例发生胰瘘,2例发生胆瘘,可能与吻合技术有关。但因本研究时间跨度长,手术医师多,同一手术医师不同阶段技术熟练程度也不一样,且总体样本量较小,无法将手术医师因素及手术技巧纳入研究指标。需要提及的是,受本地经济水平影响,本组死亡病人中有8例(15.4%)为出现术后并发症后因经济因素等原因放弃治疗而死亡,可能也适当增加了围手术期死亡率。同时,本研究有3例进展期胰腺癌病人术后病理报告肿瘤标本切缘阳性,提示可能有手术医师为提高病人5年生存率而放宽手术指征追求根治性手术切除率,可能也导致了本研究的胰腺癌围手术期高死亡率。因此,我们应进一步细化胰腺外科专业分工,规范医师分级管理制度,严格掌握手术适应证,若术中无法行R0切除,应考虑放弃根治性手术,除此以外,还应加强外科团队建设,改进手术技巧,提高围手术期监测与管理水平,防患于未然,减少术后并发症率,降低围手术期死亡率。
本研究结果提示,胰腺癌围手术期风险是多因素综合作用的结果,年龄、肝脏储备功能是影响胰腺癌围手术期风险的独立危险因素,其中年龄大于60岁及肝功能分级C级的病人,胰腺癌围手术期死亡和术后并发症的发生率显著升高,胰腺癌诊治水平也一定程度上影响胰腺癌围手术期风险。
1 Szajda SD,Waszkiewicz N,Chojnowskz S,et al.Carbohydrate markers of pancreatic cancer. Biochem Soc Trans,2011,39:340-343.
2 Tkachev SI,Medvedev SV,Znatkova YR,et al.Possibilities of stereotactic radiotherapy in the palliative treatment of patients with pancreatic cancer.Vopr Onkol,2015,61:121-124.
3 潘耀振,孙诚谊,张浩,等.影响胰腺癌预后因素的分析.腹部外科,2014,27:26-30.
4 Klaiber U,Probst P,Knebel P,et al.Meta-analysis of complication rates for single-loop versus dual-loop(Roux-en-Y) with isolated pancreaticojejunostomy reconstruction after pancreaticoduodenectomy.Br J Surg,2015,102:331-340.
5 He XY,Yuan YZ.Advances in pancreatic cancer research:moving towards early detection.World J Gastroenterol,2014,20:11241-11248.
6 Rossi ML,Rehman AA,Gondi CS.Therapeutic options for the management of pancreatic cancer.World J Gastroenterol,2014,20:11142-11159.
7 Chang ST,Nguyen DC,Raptis C,et al.Natural history of preoperative subcentimeter pulmonary nodules in patients with resectable pancreatic adenocarcinoma: A retrospective cohort study.Ann Surg,2015,261:970-975.
8 陈健,张宏,颜登国.结直肠癌病人围手术期死亡风险评估.中华普通外科杂志,2014,29:707-710.
9 Chang YT,Tien YW,Jeng YM,et al.Overweight increases the risk of malignancy in patients with pancreatic mucinous cystic neoplasms.Medicine (Baltimore),2015,94:797.
10 Fiorino S,Cuppini A,Castellani G,et al.HBV-and HCV-related infections and risk of pancreatic cancer.JOP,2013,14:603-609.
11 Yoshida M,Shiraishi S,sakaguchi F,et al.Fused 99m-Tc-GSA SPECT/CT imaging for the preoperative evaluation of postoperative liver function:can the liver uptake index predict postoperative hepatic functional reserve?.Jpn J Radiol,2012,30:255-262.
12 陆叶珍,余华,杨燕,等.关于加强非计划再次手术监管的探讨.中国医院管理,2012,32:32-33.
13 Sánchez Cabús S,Fernández-Cruz L.Surgery for pancreatic cancer: Evidence-based surgical strategies.Cir Esp,2015,73:115-123.
14 Risch HA,Yu H,Lu L,et al.Detectable Symptomatology Preceding the Diagnosis of Pancreatic Cancer and Absolute Risk of Pancreatic Cancer Diagnosis.Am J Epidemiol,2015,182:26-34.
15 杨孙虎,黄明哲,李峰,等.胰十二指肠切除术后腹内并发症和手术死亡的影响因素分析.中国普外基础与临床杂志,2014,21:313-317.
16 戴存才,苗毅,刘训良,等.专业组与非专业组胰十二指肠切除之比较.中华肝胆外科杂志,2005,11:665-667.
Analysis for surgical risk of 187 patients with pancreatic cancer
LiuTao*,ZhangHong,SunChengyi.
*GuizhouMedicalUniversity,Guiyang550004,China
SunChengyi,Email:chengyisun@medmail.com.cn
Objective To investigate the perioperative risks of patients with pancreatic cancer to increase the levels of diagnosis and treatment for pancreatic cancer. Methods The clinical data of 187 patients with pancreatic cancer undergoing surgical treatments were retrospectively analyzed. Eighteen kinds of related factors probably influencing the pancreatic cancer perioperative death and postoperative complications were selected,and the data were statistically analyzed with Logistic regression and Chi-square test. The independent risk factors for perioperative death and postoperative complications of pancreatic cancer patients were screened out.Results There were 18 perioperative deaths,and postoperative complications occurred in 73 cases. The independent risk factors influencing the perioperative death were age,Child-Pugh score,and unplanned reoperation,etc.,and those for perioperative complications were age,Child-Pugh score,surgical procedures,tumor staging,etc.Conclusions Perioperative risks of pancreatic cancer result from the combined action by multiple factors. Above 60 years old,poor liver reserve function,unplanned reoperation,surgical method,and tumor staging are independent risk factors influencing the perioperative death and postoperative complications in pancreatic cancer patients.
Pancreatic cancer; Perioperative period; Risk factors; Retrospective analysis
国家国际科技合作专项(2014DFA31420);贵州省科学技术厅社发攻关项目(黔科合SY字2015-3047)
550004 贵阳,贵州医科大学(刘涛、孙诚谊);贵州医科大学附属医院肝胆外科 贵州省肝胆胰脾疾病研究所(张宏、孙诚谊)
孙诚谊,Email:chengyisun@medmail.com.cn
R576
A
10.3969/j.issn.1003-5591.2015.05.012
2015-07-09)

