去甲斑蝥素对梗阻性肾病Wnt/β-catenin 表达的影响
向玉琼 李素文 肖 争 李 军 段绍斌 孙 林 刘 虹 庾楠楠 彭佑铭 刘伏友 李 瑛
去甲斑蝥素对梗阻性肾病Wnt/β-catenin 表达的影响
向玉琼 李素文 肖 争 李 军 段绍斌 孙 林 刘 虹 庾楠楠 彭佑铭 刘伏友 李 瑛
目的:观察去甲斑蝥素(NCTD)对梗阻性肾病(UUO)大鼠模型及人近端肾小管上皮细胞(HK-2)纤维化模型Wnt/β-catenin 表达的影响。 方法:(1)动物实验:第一批SD大鼠随机分为假手术组(Sham组)、UUO 3d组、UUO 7d组及UUO 14d组,每组各4只。将第二批SD大鼠随机分为假手术组(sham)、模型组(UUO 14d)、NCTD 0.05 mg/kg干预组,NCTD 0.1 mg/kg干预组,每组4只。(2)细胞实验:体外培养HK-2细胞,分对照组、转化生长因子β1(TGF-β1) 5 ng/ml刺激组、TGF-β1 5 ng/ml刺激+NCTD(2.5 mg/L、5 mg/L)干预组。免疫组化、Western Blot检测Wnt4、β-catenin蛋白表达情况,Real-time PCR检测Wnt4、β-catenin mRNA表达情况。 结果:随着UUO大鼠梗阻时间延长,β-catenin蛋白表达逐渐升高,UUO 14d表达最强。与UUO组相比,NCTD组Wnt4、β-catenin蛋白及mRNA表达明显下降(P<0.05);与对照组相比,TGF-β1刺激组Wnt4、β-catenin蛋白表达上调;与TGF-β1刺激组相比,NCTD不同浓度干预组Wnt4、β-catenin蛋白表达下调,且呈浓度依赖(P<0.05)。 结论:NCTD干预可以下调梗阻性肾病大鼠肾组织及TGF-β1刺激的HK-2细胞中Wnt4和β-catenin的表达。
梗阻性肾病 去甲斑蝥素 肾间质纤维化 Wnt4 β-catenin
去甲斑蝥素(NCTD)是斑蝥素去掉2、3位两个甲基的衍生物,具有防治器官组织纤维化、抗肿瘤活性、炎症免疫调节、抗氧化和升高白细胞等作用[1]。NCTD安全性好,目前美国已经将其列为极有潜力的肿瘤化疗药物[2]。我们课题组前期通过系列研究证实,NCTD可能是通过抑制TGF-β/Smad信号通路实现抗肾间质纤维化作用[3-12]。Wnt/β-catenin 信号途径参与了糖尿病肾病、肾肿瘤、多囊肾、急性肾衰竭等多种肾脏疾病的发病,近来研究证实,Wnt/β-catenin 信号途径也参与了肾间质纤维化的发生发展[13-15]。NCTD可能是一种非常有前景的抗肾间质纤维化药物[7]。因此,本研究以梗阻性肾病(UUO)大鼠模型及人近端肾小管上皮细胞(HK-2)纤维化模型来探讨NCTD对Wnt/β-catenin 表达的影响,为进一步阐明NCTD抗肾间质纤维化的作用机制奠定基础。
材料与方法
材料及试剂 6周龄清洁级健康雄性SD大鼠32只,体重(263.23±8.32)g,购于中南大学湘雅二医院动物实验部。HK-2细胞株(中南大学湘雅附一医院肾病实验室冻存),NCTD(北京双鹤高科天然药物公司),β-catenin、Wnt4多克隆抗体(Abcam公司),β-actin多克隆抗体(北京中杉金桥公司),小鼠二抗(北京中杉金桥公司)、兔二抗试剂盒(北京中杉金桥公司),RT-PCR试剂(购于加拿大Ferments公司),PCR引物(上海生工)。
UUO大鼠模型建立及分组 第一批16只大鼠随机分成4组:sham组、UUO 3d组、UUO 7d组、UUO 14d组,sham仅游离左侧输尿管,其余均于肾门处行左输尿管结扎术。于术后3d、7d、14d处死,取结扎侧肾脏,同时取出对照组大鼠肾脏。第二批16只大鼠随机分成4组:sham组、UUO 14d、NCTD 0.05 mg/(kg·d)干预组,NCTD 0.1 mg/(kg·d)干预组。造模手术于同一天完成,手术过程同前。NCTD干预组分别给予NCTD 0.05 mg/(kg·d),0.1 mg/(kg·d)腹腔注射,sham组和UUO 14d组腹腔注射等量生理盐水,观察至术后第14天。部分肾组织用多聚甲醛固定,行免疫组化检测,部分储存-80℃,行Western印迹和Real-time PCR检测。
HK-2细胞培养及分组 HK-2细胞用DMEM+10%FBS培养基,于37℃、5%CO2条件下培养、传代。参照课题组既往实验结果,采用转化生长因子β1(TGF-β1)干预浓度为5 ng/ml,检测TGF-β1在不同时间点(0h、1h、3h、6h、12h、24h、48h)对HK-2中β-catenin、wnt4表达水平的影响,获取合适的TGF-β1诱导时间为24h。实验随机分4组:(1)对照组;(2)TGF-β1组(TGF-β1 5 ng/ml刺激24h);(3)TGF-β1 5 ng/ml+NCTD 2.5 mg/L干预24h组;(4)TGF-β1 5 ng/ml+NCTD 5 mg/L干预24h组。收集细胞提取蛋白及mRNA行Western印迹和Real-time PCR检测β-catenin、Wnt4。
免疫组织化学检查 大鼠肾组织石蜡切片脱蜡水化,pH 6.0的柠檬酸盐缓冲液中行微波修复抗原,山羊血清封闭,37℃孵育30 min,分别滴加适当稀释的β-catenin、Wnt4一抗4℃孵育过夜,次日滴加辣根酶标记的羊抗兔IgG二抗工作液(37℃孵育30 min),DAB显色。图像半定量分析: 200倍显微镜下观察,每组随机观察10个不含肾小球和动脉的肾小管间质视野,用 Image-Pro P1uS Version 6.0图像分析系统分析各视野下阳性目标光密度和阳性面积百分比,用平均光密度(IOD/area)代表指标表达量。
Western Blot检测 取保存于-80 ℃的肾组织60 mg,加入适量裂解液后匀浆,离心,取2~4 μl蛋白BCA法检测蛋白浓度。每上样孔加20 μg总蛋白行5%~10% SDS-PAGE胶电泳。湿转法电转移至PVDF膜,用封闭液封闭1~2h后,各组分别加入适当稀释后的β-catenin、Wnt4抗体4℃过夜。辣根过氧化物酶(HRP)标记的二抗(1∶ 5 000)室温孵育1~1.5h,化学发光剂ECL反应5 min,曝光,扫描蛋白条带。采用labwork 4.0图像分析软件进行吸光度分析,以所测得的各指标的吸光度与内参照β-actin吸光度的比值代表定量值。
实时定量PCR检测 提取各组肾组织及HK-2细胞总RNA,酶标仪测定总RNA 质量,按RevertAidTM First Strand cDNA Synthesis Kit 合成cDNA。基因序列从Genebank中查阅,采用Primer5软件设计。引物序列见表1、2。PCR 扩增的反应程序为:50℃ 2 min,1 个循环;95℃ 10 min,1 个循环;95℃ 10 s,60℃ 60 s,72℃ 60 s,40个循环;72℃10 min终止反应。实时反应结束后制作终产物的溶解曲线,以Actin为管家基因,采用2-△△Ct方法分析相关基因的表达水平。
统计学分析 应用SPSS17.0软件系统进行统计分析,结果用均数标准差±s)表示。计量资料采用单因素方差分析(one-way ANOVA),两样本均数的比较采用t检验,以P<0.05认为差异有统计学意义。

表1 大鼠基因引物序列

表2 人近端肾小管上皮细胞基因引物序列
结 果
β-catenin在UUO大鼠肾脏中随梗阻时间延长表达增强 免疫组化结果显示β-catenin在各组大鼠的肾脏中均有表达,在sham组少量表达于肾小管上皮细胞基底侧,UUO组β-catenin在肾小管上皮细胞胞质表达增强,并有少数胞核表达。随着梗阻时间延长肾脏中β-catenin的表达逐渐增多,梗阻3d、7d时β-catenin较sham组已经升高(P<0.05),14d时表达最高,表达部位没有明显改变(图1)。Western Blot结果、PCR结果与免疫组化结果基本一致(图2)。以上结果均显示β-catenin随着大鼠肾脏梗阻时间延长表达逐渐升高,14d表达最高。为进一步探求NCTD对UUO大鼠模型Wnt/β-catenin的作用,接下来的实验我们将选择UUO 14d作为模型组,应用NCTD干预,检测 β-catenin、Wnt4的表达情况。
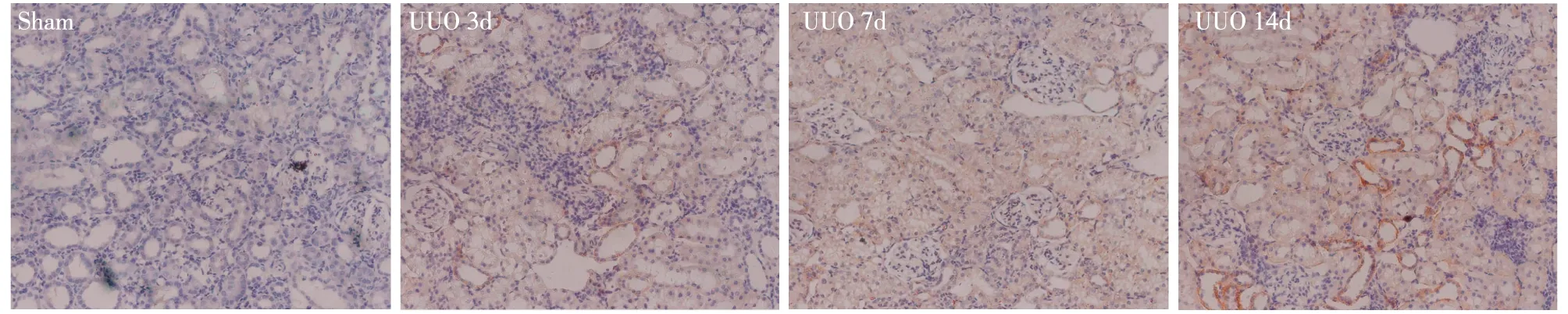
图1 梗阻性肾病(UUO)大鼠不同时间段肾脏β-catenin的表达情况(IH,×200)

图2 梗阻性肾病(UUO)大鼠不同时间段肾组织中β-catenin蛋白和mRNA表达的影响A:Western Blot;B:Real-time PCR;a:Sham;b:UUO 3d;c:UUO 7d;d:UUO 14d;*与Sham组相比较,P<0.05; #与UUO 3d模型组相比较,P<0.05;&与UUO 7d模型组相比较,P<0.05
NCTD可抑制UUO大鼠肾脏β-catenin 和Wnt4的表达 免疫组化显示β-catenin和Wnt4 在sham组肾小球系膜细胞、肾小管细胞少量表达,在UUO 14d组明显升高,NCTD干预可下调β-catenin、Wnt4蛋白表达,并随浓度增加逐渐下降(P<0.05)(图3)。Western Blot和Real-time PCR结果显示sham组Wnt4、β-catenin的蛋白和mRNA表达低,UUO 14d组与sham组比Wnt4、β-catenin的蛋白和mRNA表达明显升高(P<0.05),NCTD干预组较UUO组Wnt4、β-catenin的蛋白和mRNA表达下降,且呈浓度依赖(P<0.05)(图4)。结果提示UUO大鼠肾脏Wnt4、β-catenin蛋白和mRNA表达升高,不同浓度 NCTD可以下调Wnt4、β-catenin蛋白和mRNA表达,且呈浓度依赖。
NCTD干预可下调TGF-β1刺激的HK-2细胞中β-catenin和Wnt4的表达 Western Blot和Real-time PCR结果均显示TGF-β1刺激组较对照组组的β-catenin、Wnt4蛋白和mRNA表达上调(P<0.05);与TGF-β1组相比,NCTD干预组β-catenin、Wnt4蛋白和mRNA表达下调,且呈浓度依赖,差异有统计学意义(P<0.05)(图5)。由此可见TGF-β1刺激HK-2细胞可导致Wnt4、β-catenin蛋白和mRNA表达上调,不同浓度NCTD干预可以抑制Wnt4、β-catenin蛋白和mRNA表达。
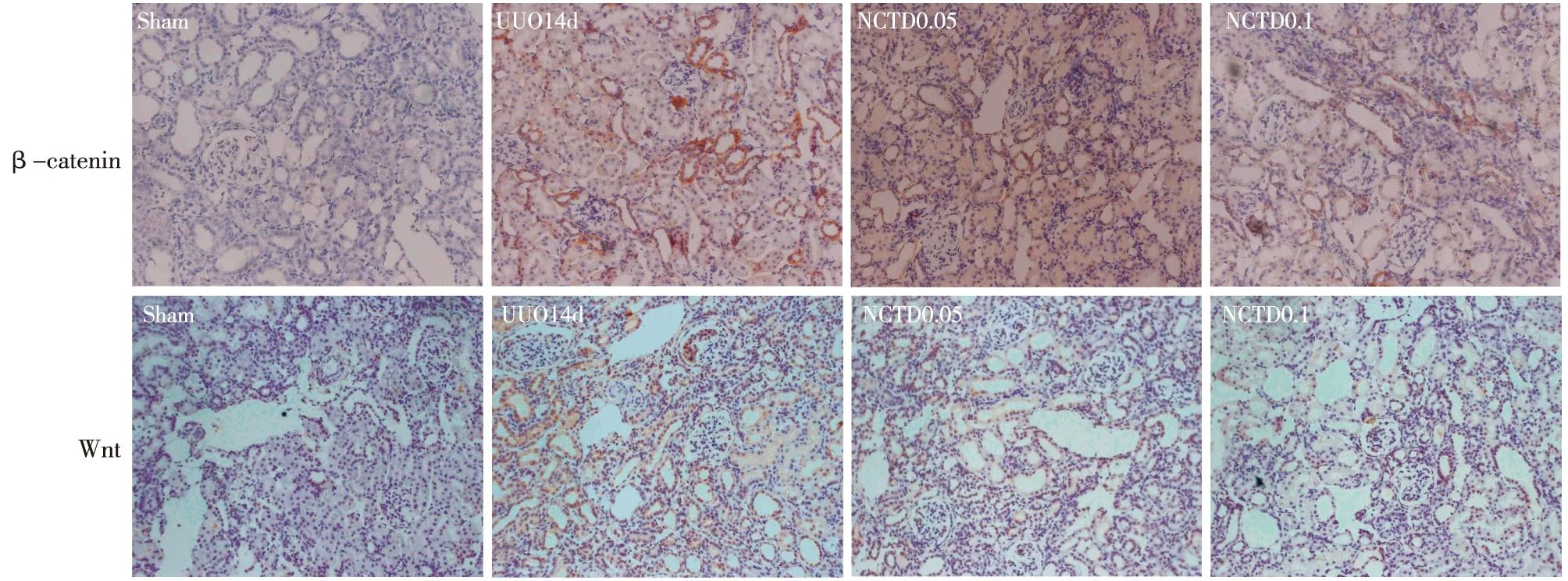
图3 NCTD对UUO大鼠肾组织中β-catenin、Wnt4蛋白表达的影响(IH,×200)NCTD:去甲斑蟊素;UUO:梗阻性肾病

图4 去甲斑蝥素(NCTD)对梗阻性肾病(UUO)大鼠肾组织中β-catenin、Wnt4蛋白和mRNA表达的影响A:Western Blot;B:Real-time PCR;a:Sham;b:UUO 14d;c:NCTD 0.05 mg/kg干预组;d:NCTD 0.1 mg/kg干预组;*:与sham组相比较,P<0.05;#:与UUO14d组相比较,P<0.05;&:与NCTD 0.05 mg/kg干预组相比较,P<0.05

图5 去甲斑蝥素(NCTD)对转化生长因子β1(TGF-β1)刺激的人近端肾小管上皮细胞(HK-2)细胞中β-catenin、Wnt4蛋白和mRNA表达的影响A:Western Blot;B:Real-time PCR;a:对照组;b:TGF-β1刺激组;c:TGF-β1 5 ng/ml+NCTD 2.5 mg/L干预组;d:TGF-β1 5 ng/ml+NCTD 5 mg/L干预组;*:与对照组相比较,P<0.05; #:与TGF-β1刺激组相比较,P<0.05;&:与TGF-β1 5 ng/ml+NCTD 2.5 mg/L干预组相比较,P<0.05
讨 论
肾脏纤维化是各种慢性肾脏疾病进展至终末期肾衰的最终结局,其主要病理改变为正常肾单位被大量增生的纤维细胞及肌成纤维细胞所取代,大量细胞外基质堆积,导致肾小球硬化、肾小管间质纤维化。延缓肾间质纤维化的进展,寻找合适的药物干预靶点,是近年来的研究热点。各国的学者做了大量的工作,试图寻找有效的治疗方法,但目前并无理想的抗肾间质纤维化的药物。
参与肾间质纤维化的信号通路众多,TGF-β/smad通路被认为是导致肾间质纤维化的主要通路。然而,TGF-β/smad通路不能完全阻断肾纤维化。Wnt/β-catenin参与胚胎进化和组织发育过程中的细胞增殖、极化及凋亡,也是介导肾间质纤维化的一个重要通路[16]。β-catenin是Wnt信号途径的关键因子,当β-catenin在细胞核内蓄积时,能激活Wnt信号传导通路,启动靶基因转录,导致细胞增生、侵袭和转移。有学者报道,β-catenin是器官病理损伤的保护因子[17],Zemans等[18]研究发现中性粒细胞迁移可激活肺上皮细胞β-catenin信号通路,从而修复肺上皮细胞,而用shRNA阻断β-catenin信号途径抑制肺上皮细胞修复。Zhou等[19]采用缺血再灌注损伤或叶酸造成小鼠急性肾损伤模型,研究显示β-catenin信号通路激活后可以减少细胞损伤。以上结论可能是因为采用的动物模型是在急性期,β-catenin信号途径主要参与急性损伤后修复。然而大量学者已证实Wnt/β-catenin信号通路促进了肾脏纤维化的发生[13-15]。
NCTD是斑蝥素去掉2、3位两个甲基的衍生物,它的肾毒性明显减弱,是我国具有独立知识产权的抗肿瘤药物。我们的前期研究发现NCTD能减轻蛋白负荷肾病、糖尿病肾病和UUO大鼠的肾间质纤维化,其机制可能是通过抑制TGF-β/smad信号通路实现[3-12],由于Wnt/β-catenin信号通路也与肾纤维化过程息息相关,我们想知道NCTD是否还能通过抑制Wnt/β-catenin信号途径来抗肾间质纤维化。
Surendran等[20]应用UUO大鼠模型研究发现,梗阻后48小时肾组织即可检测到Wnt4表达,且持续增高至梗阻后4周,同时肾小管上皮细胞胞浆中β-catenin水平增高,说明Wnt/β-catenin在梗阻性肾病模型的肾间质纤维化过程起重要作用。Bienz等[21]也在UUO大鼠肾脏纤维化模型中发现Wnt4等多种Wnt蛋白及靶基因蛋白有不同程度的升高。为此我们拟通过UUO大鼠模型及HK-2细胞纤维化模型来研究NCTD对β-catenin、Wnt4表达的影响。我们建立3d、7d和14d的UUO大鼠模型,通过免疫组化及Western blot、RT-PCR技术检测UUO不同时间动物模型的β-catenin表达及分布情况,探求β-catenin蛋白表达与UUO的关系。实验结果显示,sham组大鼠肾脏β-catenin表达少,随着梗阻时间的延长,肾脏梗阻程度加重,β-catenin表达逐渐升高。β-catenin在梗阻肾模型中升高,提示梗阻肾中Wnt/β-catenin信号途径活化,本实验结果与Surendran、Bienz的实验一致。
为探求NCTD对UUO大鼠模型Wnt/β-catenin的作用,接下来的实验我们选择UUO 14d作为模型组,应用NCTD不同浓度干预,检测β-catenin、Wnt4的表达情况。结果显示,UUO 14d大鼠肾组织中Wnt4、β-catenin蛋白表达较对照组增高,差异显著。不同浓度NCTD干预后Wnt4、β-catenin表达减弱,提示NCTD能下调Wnt4、β-catenin的表达,且呈浓度依赖。Villa等[22]也表示,在UUO模型中,抑制β-catenin信号通路可减少肾脏纤维化,因此我们推测NCTD可阻断β-catenin信号通路发挥抗大鼠肾纤维化。而且我们用TGF-β1刺激HK-2细胞建立HK-2细胞纤维化模型,用不同浓度NCTD干预,研究Wnt4、β-catenin蛋白在TGF-β1刺激的HK-2细胞中的表达,探讨NCTD对HK-2细胞Wnt4、β-catenin的影响。Western Blot及Real-time PCR结果显示,TGF-β1组Wnt4、β-catenin表达高于sham组,而NCTD干预组Wnt4、β-catenin低于TGF-β1模型组,且呈浓度依赖。以上均提示NCTD对Wnt/β-catenin信号通路有抑制作用,具体作用机制有待进一步研究证实。
小结:本研究从动物实验与细胞实验中均证实,Wnt4、β-catenin在梗阻肾纤维化模型及HK-2细胞纤维化模型中表达增高,不同浓度NCTD干预可下调Wnt4、β-catenin的表达,提示NCTD可抑制Wnt/β-catenin信号通路活化,除了TGF-β/Smad3介导的信号通路外,NCTD可以通过抑制Wnt/β-catenin信号通路发挥抗肾间质纤维化作用。此研究为进一步研究NCTD抗肾间质纤维化的分子机制提供了新的实验依据,同时为防治肾间质纤维化提供新的靶点和策略,并可促进NCTD开发成新型抗肾间质纤维化药物。
1 叶琨,刘伏友,李瑛,等.去甲斑蝥素干预蛋白负荷肾病大鼠的实验研究.中华肾脏病杂志,2007,23(2):82-86.
2 Massicot F,Dutertre-Catella H,Pham-Huy C,et al.In vitro assessment of renal toxicity and inflammatory events of two protein phosphatase inhibitors cantharidin and nor-cantharidin.Basic Clin Pharmacol Toxicol,2005,96(1):26-32.
3 Liu FY,Li Y,Peng YM,et al.Norcantharidin ameliorates proteinuria,associated tubulointerstitial inflammation and fibrosis in protein overload nephropathy.Am J Nephrol,2008,28(3):465-477.
4 Li Y,Chen Q,Liu FY,et al.Norcantharidin attenuates tubulointerstitial fibrosis in rat models with diabetic nephropathy.Ren Fail,2011,33(2):233-241.
5 Li Y,Sun Y,Liu F,et al.Norcantharidin inhibits renal interstitial fibrosis by blocking the tubular epithelial-mesenchymal transition.PloS One,2013,8(6):e66356.
6 Li Y,Liu FY,Peng YM,et al.Norcantharidin inhibits proliferation and fibronectin expression of HK-2 cells induced by albumin in vitro.Cell Biol Int,2011,35(12):1239-1241.
7 Li Y,Ge Y,Liu FY,et al.Norcantharidin,a protective therapeutic agent in renal tubulointerstitial fibrosis.Mol Cell Biochem,2012,361(1-2):79-83.
8 尤燕华,刘玉平,李瑛,等.去甲斑蝥素通过靶向抑制蛋白磷酸酶2Ac抗肾间质纤维化.中华肾脏病杂志,2014,30(4):293-298.
9 刘伏友,孙岩,孙林,等.去甲斑蝥素对TGF-β1 诱导的人近端肾小管细胞上皮间质转分化以及转录因子Snail1表达的影响.中国中西医结合肾病杂志,2009,10(11):952-957.
10 李瑛,陈琼,刘伏友,等.去甲斑蝥素不依赖钙调蛋白磷酸酶信号通路抑制高糖刺激肾小管上皮细胞细胞外基质的表达.肾脏病与透析肾移植杂志,2010,19(6):526-533.
11 孙岩,李瑛,孙林,等.去甲斑蝥素抑制单侧输尿管梗阻大鼠肾小管上皮-间充质转分化的实验研究.肾脏病与透析肾移植杂志,2012,21(1):46-52.
12 陈琼,李瑛,罗俊辉,等.去甲斑蝥素对高糖刺激的HK-2细胞FN,Col IV 和TGF-β1 mRNA及蛋白表达的影响.中南大学学报(医学版),2012,37(3):278-284.
13 Hwang I,Seo EY,Ha H.Wnt/beta-catenin signaling:a novel target for therapeutic intervention of fibrotic kidney disease.Arch Pharm Res,2009,32(12):1653-1662.
14 He W,Dai C,Li Y,et al.Wnt/beta-catenin signaling promotes renal interstitial fibrosis.J Am Soc Nephrol,2009,20(4):765-776.
15 Hao S,He W,Li Y,et al.Targeted inhibition of β-catenin/CBP signaling ameliorates renal interstitial fibrosis.J Am Soc Nephrol,2011,22(9):1642-1653.
16 Maiese K,Li F,Chong ZZ,et al.The Wnt signaling pathway:aging gracefully as a protectionist.Pharmacol Ther,2008,118(1):58-81.
17 Clevers H,Wnt/beta-catenin signaling in development and disease.Cell,2006,127(3):469-480.
18 Zemans RL,Briones N,Campbell M,et al.Neutrophil transmigration triggers repair of the lung epithelium via beta-catenin signaling.Proc Natl Acad Sci U S A,2011,108(38):15990-15995.
19 Zhou D,Li Y,Lin L,et al.Tubule-specific ablation of endogenous β-catenin aggravates acute kidney injury in mice.Kidney Int,2012,82(5):537-547.
20 Surendran K,Schiavi S,Hruska KA.Wnt-dependent beta-catenin signaling is activated after unilateral ureteral obstruction and recombinant secreted frizzled related protein4 alters the progression of renal fibrosis.J Am Soc Nephrol,2005,16(8):2373-2384.
21 Bienz M.beta-Catenin:a pivot between cell adhesion and Wnt signaling.Curr Biol,2005,15 (2):R64-67.
22 Villa L,Boor P,Konieczny A,et al.Effects and mechanisms of angiotensin II receptor blockade with telmisartan in a normotensive model of mesangioproliferative nephritis.Nephrol Dial Transplant,2011,26(10):3131-3143.
(本文编辑 青 松 春 江)
Effect of norcantharidin on Wnt/β-catenin expression in obstructive nephropathy
XIANGYuqiong,LISuwen,XIAOZheng,LIJun,DUANShaobin,SUNLin,LIUHong,YUNannan,PENGYouming,LIUHuyou,LIYing
Departmentofnephrology,SecondXiangyaHospital,CentralSouthUniversity,Changsha41001,ChinaCorrespondingauthor:LIYing(E-mail:liyingdoctor@163.com)
Objective:To observe the effect of norcantharidin (NCTD) on the expression of β-catenin and Wnt4 in unilateral ureter obstructive (UUO) rats model and human proximal renal tubular epithelial cells(HK-2) fibrosis model. Methodology:Firstly,sixteen male Sprague-Dawley rats were randomly divided into four groups including Sham operation group,UUO 3 days group,UUO 7 days group and UUO 14 days group (4 in each group). Secondly,another sixteen male Sprague-Dawley rats were also randomly divided into four groups:Sham operation group,UUO 14 days group,NCTD(0.05 mg/kg,0.1 mg/kg) interference group. At last,HK-2 cell were cultured and divided into control group,TGF-β1 (5 ng/ml) stimulation group,TGF-β1 (5 ng/ml) stimulation and followed by NCTD(2.5 mg/L,5 mg/L) interference group. Immunohistochemical staining,Western blotting and Real-time PCR were used to detect the protein and mRNA expression of wnt4 and β-catenin. Results:With prolong of ureter obstruction time,the expression of β-catenin protein increased gradually,it was the highest level in UUO 14 days group. So we chose the rat model with UUO 14 days in the following experiments,Compared with the UUO group,protein and mRNA expressions of β-catenin and Wnt4 were decreased in NTCD group,the difference is statistically significant. NTCD can also decrease the protein expression of β-catenin and Wnt4 in the HK-2 cells with TGF-β1 stimulation in the manner of concentration depedence. Conclusion:NTCD can down regulate the β-catenin and Wnt4 expression in vivo and in vitro.
Obstructive nephropathy norcanthadinrin renal interstitial fibrosis Wn4 β-catenin
国家自然科学基金(81370792,81100486);湖南省科技计划项目(2013SK3036);中华医学会临床医学专项资金(13030400425)
中南大学湘雅二医院肾内科(长沙,410011)
李 瑛(E-mail:liyingdoctor@163.com)
2015-02-25
ⓒ 2015年版权归《肾脏病与透析肾移植杂志》编辑部所有

