EPO对Aβ1-42所致AD样大鼠皮层神经元树突棘的影响*
李宜培, 尚俊杰, 王 黎
(1.河南医学高等专科学校 病理生理学教研室,郑州 451191; 2.郑州大学 基础医学院,郑州 450001; 3.河南医学高等专科学校 老年学研究所,郑州 451191)
基础医学
EPO对Aβ1-42所致AD样大鼠皮层神经元树突棘的影响*
李宜培1, 尚俊杰2, 王 黎3△
(1.河南医学高等专科学校 病理生理学教研室,郑州 451191; 2.郑州大学 基础医学院,郑州 450001; 3.河南医学高等专科学校 老年学研究所,郑州 451191)
目的 探讨erythropoietin(EPO)对Aβ1-42所致AD样大鼠记忆能力和皮层神经元树突棘的影响及作用机制。方法 雄性Wistar大鼠48只随机分为4组:生理盐水组、模型组、EPO治疗组和脑复康阳性对照组,每组12只。其中生理盐水组双侧海马注射生理盐水各5 μL,其余3组大鼠双侧海马注射凝聚态β-淀粉样蛋白(Aβ)各5 μL造模。EPO治疗组和脑复康阳性对照组从造模手术当天开始腹腔注射EPO(5 000 IU/kg,隔日一次)和脑复康(40 mg/kg,每日一次)。术后第10天Morris水迷宫法检测各组大鼠空间定向学习和记忆能力;利用高尔基染色、连续震荡切片和人工计数的方法,分析各组大鼠皮质神经元树突棘量的改变情况。结果 与生理盐水组、EPO治疗组及脑复康组相比,模型组水迷宫测试潜伏期延长,差异均有统计学意义(P<0.05)。与生理盐水组相比,模型组皮质神经元树突棘数目数目减少,EPO治疗组及脑复康对照组数目明显多于模型组(P<0.05);而EPO治疗组及脑复康对照组相比则无明显差异(P>0.05)。结论 EPO可以减轻Aβ1-42对大鼠皮质神经元树突棘的破坏,提高大鼠认知能力。
促红细胞生成素;Alzheimer’s disease;神经元树突棘; Morris水迷宫
阿尔茨海默病(Alzheimer's disease,AD)是一种老年患者常见的神经系统退行性疾病[1],其主要病理学特征为神经细胞外β-淀粉样蛋白(β-Amyloid peptide,Aβ)沉积形成的老年斑(senile plaque,SP)、神经细胞内异常磷酸化的tau蛋白聚集所形成的神经原纤维缠结(neurofibrillary tangles, NFTs)以及皮质、海马选择性的神经元变性和缺失[2]。Aβ是老年斑的主要组成成分,被认为是导致神经元损伤和认知功能障碍的主要原因[3]。近年来研究表明,促红细胞生成素(erythropoietin,EPO)在脑损害中发挥着重要的神经保护作用[4]。为探讨EPO在AD治疗中的作用,本实验采用大鼠海马注射凝聚态Aβ1-40的方法复制AD动物模型[5],通过腹腔注射重组人促红细胞生成素(recombinant human erythropoietin,rHu-EPO),观察EPO对AD大鼠学习记忆能力及皮质神经元树突棘量的改变情况,初步探讨其可能机制。
1 材料与方法
1.1 动物分组及处理 雄性2月龄Wistar大鼠55只,清洁级,体质量250~300 g,动物批号:SCXK(豫)2005-2001,由河南省实验动物中心提供。Morris水迷宫法筛选后,淘汰反应过于灵敏和迟钝的7只大鼠后,48只大鼠随机分为4组:生理盐水组、模型组、EPO治疗组和脑复康阳性对照组,每组12只。动物自由饮食,昼夜交替饲养,饲养室温度15~20 ℃。
1.2 主要试剂和仪器 Aβ1-40 (美国Sigma公司),rHu-EPO(上海克隆生物高技术有限公司),骨蜡(上海三友医疗器械有限公司)。0.5%亚硝酸钠生理盐水、10%甲醛生理盐水、1%AgNO3溶液、媒染液(水合氯醛25 g,重铬酸钾25 g,双蒸水250 mL溶解后加甲醛50 mL,最后用双蒸水定容至500 mL)均购于天津市大茂化学试剂厂;脑立体定位仪(ZH-蓝星B,安徽省淮北正华生物仪器设备有限公司),Morris水迷宫系统(DMS-2型,中国医学科学院药物研究所),恒温培养箱(GSP-9080MBE,上海博讯实业有限公司医疗设备厂),电子天平(瑞士METTLER TOLEDO)。
1.3 Aβ1-40孵育 将1 mg Aβ1-40溶于500 μL磷酸盐缓冲液,稀释为2 g·L-1的浓度,置于37 ℃恒温箱中连续孵育12 d,使蛋白充分伸展形成聚合态,然后4 ℃保存使用,忌反复冻融。
1.4 大鼠模型的建立 用体积分数6%水合氯醛腹腔注射麻醉大鼠(300 mg·kg-1)后将其固定于脑立体定位仪上。参照《大鼠脑立体定位图谱》[6]进行定位:以前囟为原点,向后4.0mm,中线旁2.0~2.5 mm,颅骨钻孔后进针3.0~3.5 mm。用微量进样器施行注射,每只大鼠注射5 μL。生理盐水组按照模型组方法在海马注射生理盐水 5 μL。EPO治疗组大鼠在正常喂养的基础上从造模手术当天开始腹腔注射5 000 IU·kg-1rHu-EPO,隔日1次,共5次。脑复康阳性对照组从造模手术当天开始腹腔注射脑复康40 mg·kg-1,每日一次,共10次。
1.5 Morris水迷宫行为学测试 Morris水迷宫由水迷宫装置、图像自动采集和分析处理系统组成。水迷宫分为4个象限,与平台所在象限相对立的象限为第一象限。训练时,大鼠从任一象限面向池壁入水,记录大鼠潜伏期(即从入水到四肢爬上平台所需的时间),图像采集系统拍摄其游泳轨迹。大鼠每天在每个象限学习4次,每次时限为60 s,即在60 s内大鼠未找到平台者停止记录,潜伏期记为60 s,大鼠由测试者引导站立平台上,持续10 s。大鼠从平台上取下,休息30~60 s后再进行下一次训练。记录第一象限的潜伏期为实验成绩。该实验从第31天连续训练大鼠7 d,记录第7天的潜伏期成绩来反映大鼠的空间记忆能力。
1.6 高尔基染色 水迷宫实验结束后,每组随机抽取2只做高尔基染色检查,观察树突棘数目及结构。大鼠用6%水合氯醛麻醉后,剪开胸腔,灌流针由心尖部朝主动脉起始处方向刺入,开始灌流。快速用500 mL 0.5%亚硝酸钠生理盐水灌流后;10%甲醛生理盐水继续灌流,速度先快后慢,时间控制在2~3 h;最后换上媒染液,速度先快后慢,时间约4~5 h。灌流结束后,取出脑组织,剥离海马置入媒染液中,避光浸泡3 d(常温:20~37 ℃),每天更换媒染液;3 d后,用1%硝酸银置换(置换前先用蒸馏水冲洗一下,再用硝酸银漂洗3次,每次5 min,连续3 d。
3 d后,震荡切片,震荡切片机的盒中为2%重铬酸钾溶液,捞片后用蒸馏水漂洗30 min; 1%明胶铺片,室温下约10 min晾干后进行梯度脱水透明,完毕后用中性树胶封片,油镜观察树突棘数目及观察,照像。
2 结果
2.1 皮质神经元树突棘的检测 皮质神经元细胞有 1 个顶树突,由胞体的顶端发出,顶树突在分支前可称为初级树突,初级树突较短,无树突棘。初级树突分支形成2~3条次级树突,次级树突较长,有少量树突棘,它沿途可发出3级树突。3 级树突偶尔可分支形成 4 级树突。树突棘(dendritic spine)是树突表面的棘状突起,形态各异,有细长形、树桩形、蘑菇形、杯子形等。
2.2 树突棘的变化 高尔基染色结果:生理盐水组树突棘形态规则,排列整齐且密集,树突棘数目是(1.36±0.18)个/μm ,与之相比, AD模型组树突棘个数为(0.74±0.19)个/μm,明显减少;rHu-EPO治疗组及脑复康对照组树突棘数目分别为(1.63±0.15)个/μm和(1.46±0.25)个/μm,与AD模型组相比差异有统计学意义(P<0.05),而与生理盐水组相比差异无统计学意义(P>0.05)。
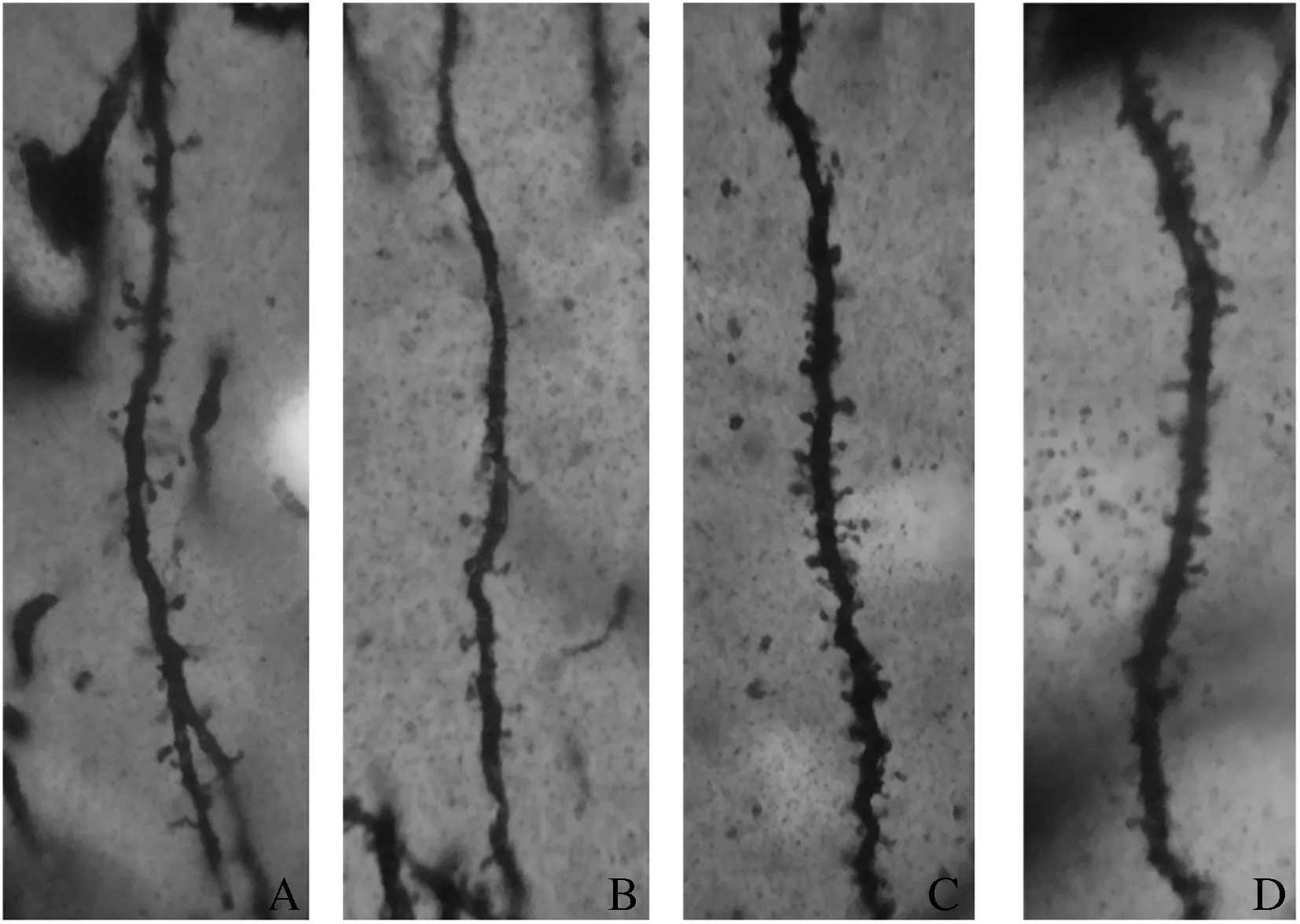
图1 高尔基染色: 各实验组皮质神经元树突棘比较
A 生理盐水组;B 模型组; C EPO治疗组; D 脑复康治疗组
3 讨论
树突棘是神经元之间形成突触连接和信息传递的部位,也是神经元适应内外环境变化的调节部位,有较强的可塑性,与大脑高级功能密切相关,树突棘的功能和结构的可塑性被认为是学习记忆的细胞基础。树突棘作为学习记忆的物质基础,其稳定性对学习记忆至关重要,树突棘的结构性病理学改变可改变突触的功能,从而导致学习记忆及认知缺陷[7]。在脑的神经活动中,90%以上的兴奋传导是通过树突棘进行的。树突棘是构成兴奋性突触的突触后结构,树突棘的减少提示衰老动物海马CA1区轴-棘突触数目的减少,这很可能是导致衰老动物学习记忆减退的形态学基础,以往对海马神经元树突棘数目随衰老而减少的研究结果也进一步支持这一观点[8]。
本实验发现模型组树突棘数量显著减少, EPO治疗组及脑复康对照组则明显多于模型组。本次结果表明Aβ1-42引起的AD样大鼠模型组空间记忆障碍的结构基础不是突触数量减少,而是突触功能降低。而EPO治疗组及脑复康对照组空间记忆测试成绩明显提高,其原因可能是EPO可以提高突触传递功能。但基于此的具体机制有待进一步研究。
[1] Lim G P,Yang F,Chu T,et al.Ibuprofen suppresses plaque pathology and inflammation in a mouse model for Alzheimer’s disease.[J] Neurosei,2000,20(15):5 709-5 714.
[2] 王德生,张守信.老年性痴呆[M].北京:人民卫生出版社,2001:60-77.
[3] Lim Y Y,Ellis K A,Harrington K,et al.Cognitive consequences of high Aβ amyloid in mild cognitive impairment and healthy older adults: implications for early detection of Alzheimer's disease[J].Neuropsychology,2013,27(3):322-332.
[4] Marsh J T,Brown W S,Wolcott D, et al. rHu-EPO treatment improves brain and cognitive function of anemic dialysis patients[J].Kidney Int,1991,39(l):155-163.
[5] Arif M,Kato T. Increased expression of PAD2 after repeated intracerebroventricular infusions of soluble Abeta(25-35) in the Alzheimer's disease model rat brain: effect of memantine[J],Cell Mol Biol Lett,2009,14(4):703-714.
[6] Paxionos G, Watson C,诸葛启钏译.大鼠脑立体定位图谱[M]. 3版.北京:人民卫生出版社,2005:25.
[7] Nimchinsky EA, Sabatini BL, Svoboda K. Structure and function of dendritic spines[J]. Annu Rev Physiol, 2002,64(1):313-353.
[8] Feldman ML, Dowd C. Loss of dendritic spines in aging cerebral cortex[J]. Anat Embryol (Berl), 1975,148(3):279-301.
[责任编校:柯 莉]
Effects of EPO on Cortical Neuron Dendritic Spinesof AD Rats Induced by Aβ1-42
LI Yi-pei1, SHANG Jun-jie2, WANG Li3△
(1.Department of Pathophysiology, Henan Medical College, Zhengzhou 451191, Henan China;2.Basic Medical College of Zhengzhou University, Zhengzhou 450001, Henan China;3.Institute of Gerontology, Henan Medical College, Zhengzhou 451191, Henan China)
Objective To investigate effects of erythropoietin(EPO)on Alzheimer rat’s memory ability and cortical neuron dendritic spines. Method Fourty eight rats complied with learned standard, were randomly divided into four groups(n=12): normal sodium group,model group, EPO treated group and piracetam treatment group. 5 uL normal sodium was injected into bilateral hippocampuses of normal sodium group. 5 uL condensed Aβ was injected into bilateral hippocampuses of other 3 groups. EPO treated groups were injected with 5 000 IU·kg-1EPO once every other day, piracetam treatment groups were injected with 40 mg·kg-1piracetam every day since the day of model operation.At the 10th day after operation, space orientation and memory of rats were assayed by Morris water maze. Analysis of each group rats cortex nerve in yuan to change the amount of dendritic spines useing of golg, continuous turbulence slicing and manual counting method. Results Compared with normal sodium group,EPO treated group and piracetam treatment group, the spatial memory were significantly reduced (P<0.05). Compared with normal sodium group, the numbers of cortical neuron and dendritic spines were reduced in model group, the numbers of cortical neuron and dendritic spines of EPO treated group and piracetam treatment group were increased than model group, but there was no significant differences between EPO treated group and piracetam treatment group (P<0.05). Conclusion EPO can reduce the destruction of the dendritic spines of rat cortical neurons to improve cognitive abilities in rats caused by Aβ1-42.
erythropoietin; Alzheimer’s disease; cortical neuron dendritic spines; Morris water maze
2014-11-30
李宜培(1981-),女,河南省社旗县人,硕士,讲师,从事病理生理学教学与科研。
△通讯作者:王黎,E-mail:kyk02@126.com。
河南省医学科技攻关计划项目(编号:201304092)。
R 654.2
A
1008-9276(2015)03-0263-03

