促肾上腺皮质激素释放激素受体1拮抗剂CP154526对大鼠海马神经元凋亡的影响
周 毅,刘 巍,张 悦
(河北医科大学 1.第二医院神经内科、2.病理学教研室、3.临床诊断学教研室,河北 石家庄 050017)
促肾上腺皮质激素释放激素受体1拮抗剂CP154526对大鼠海马神经元凋亡的影响
周 毅1,刘 巍2,张 悦3
(河北医科大学 1.第二医院神经内科、2.病理学教研室、3.临床诊断学教研室,河北 石家庄 050017)
目的 观察促肾上腺皮质激素释放激素(CRH)受体1拮抗剂CP154526对海马神经元凋亡的影响。方法 原代培养大鼠海马神经元,噻唑蓝(MTT)法测定细胞存活率,然后分为4组:正常对照组(Con)、CRH刺激组(CRH)、CRH和CP154526共同刺激组(CRH+CP)、CP154526刺激组(CP)。TUNEL、流式细胞术Annexin Ⅴ-PI法检测神经元凋亡率;Western blot检测凋亡蛋白Bax、Bcl-2、caspase-3表达水平。结果 10-8mol·L-1的CRH作用于海马神经元后,细胞存活率下降(P<0.05);50 mmol·L-1的CP154526可明显提升神经元存活率(P<0.05)。与正常对照组相比,CRH刺激后神经元凋亡率增加,Bax/Bcl-2比值增高,caspase-3表达增加;加用CP154526可明显降低神经元凋亡率、Bax/Bcl-2比值及caspase-3表达水平;而单独应用CP154526对凋亡没有明显影响。结论 一定浓度的CRH可诱导海马神经元细胞凋亡,其受体1拮抗剂CP154526可有效减轻细胞凋亡,发挥神经保护作用。
促肾上腺皮质激素释放激素;CP154526;海马;神经元;凋亡;原代培养
应激是指机体在受到内外环境因素及社会、心理因素刺激时所出现的全身性非特异性适应反应,其主要特征是以下丘脑-垂体-肾上腺皮质轴(hypothalamic pituitary adrenal axis,HPA)的激活为核心的生理和心理反应。促肾上腺皮质激素释放激素(corticotropin releasing hormone,CRH)是下丘脑分泌的调节HPA轴功能的多肽类激素,也是机体应激反应时发挥神经内分泌调节的关键激素[1]。近年来发现,CRH不仅在HPA轴调节中起着重要作用,作为一种神经递质,其在情绪反应、学习记忆和神经系统损伤与发育中也发挥着重要作用[2]。我们前期的研究发现,一定浓度的CRH可以降低海马神经元细胞存活率,并且呈现出浓度和时间依赖模式[3]。CRH通过其受体发挥生物学作用,CRH受体1(CRH-R1)主要表达于哺乳动物的中枢神经系统中,如下丘脑、海马、大脑皮层、杏仁体、蓝斑等部位,与CRH有较高的亲和力[4]。在应激状态下,CRH主要通过CRH-R1发挥内分泌、行为改变和内脏反应等功能的调节作用[5-7],但有关CRH-R1发挥作用的方式尚不清楚。本实验应用CRH-R1拮抗剂CP154526,重点探讨其对海马神经元凋亡的影响,以期明确CRH-R1在CRH诱导神经元凋亡中的作用,为应激所致精神损伤的防治提供一定的理论依据。
1 材料与方法
1.1 材料
1.1.1 动物 新生24 h内SD大鼠,♂♀不限,由河北医科大学实验动物中心提供。
1.1.2 主要试剂 DMEM培养基(Gibco)、胎牛血清(Cellgro)、Neurobasal培养基(Gibco)、B27(PAA)。CRH(Anaspec),CP154526(Tocris Bioscience,Bristol),0.25%胰蛋白酶(Sigma),四甲基偶氮唑蓝(MTT,Sigma)。兔抗MAP2一抗(Cell Signaling),兔抗Bax、Bcl-2多克隆抗体(Protein Tech),鼠抗caspase3单克隆抗体(Cell Signaling),FITC标记的IgG二抗(北京中杉金桥生物技术有限公司)。TUNEL试剂盒(Roche)。Annexin Ⅴ/PI凋亡检测试剂盒(联科生物)。
1.2 方法
1.2.1 海马神经元原代培养 新生24 h内SD乳鼠,75%乙醇消毒,无菌条件下断头、取双侧海马,解剖显微镜下去除血管及脑膜,剪碎后以0.125%胰蛋白酶消化15 min,含10%胎牛血清的DMEM培养基终止消化,1 mm口径吸管吹打均匀,细胞计数,稀释成1×106ml-1的细胞悬液,接种于6孔培养板(预先经0.1%多聚赖氨酸铺底),将培养板置于37℃、5%CO2培养箱内,3 h后补种植液,24 h后去除种植液,加入培养液(Neurobasal+B27)培养,每3 d换液,培养6~8 d神经细胞之间突触联成网状用于后续研究[8]。
1.2.2 神经元鉴定 取培养7 d海马神经元,70%酒精固定30 min,0.1%Triton 37℃孵育15 min,3%H2O2去除内源性过氧化物酶,山羊血清封闭30 min,兔抗MAP2一抗1 ∶200稀释,4℃过夜,FITC标记的山羊抗兔二抗37℃孵育2 h,PBS冲洗,甘油封片,荧光显微镜观察结果。
1.2.3 MTT检测细胞存活率 细胞悬液200 μL接种于96孔培养板中,加入不同浓度的CRH(10-9、10-8、10-7、10-6、10-5mol·L-1)作用48 h后,每孔加5 g·L-1MTT溶液20 μL,37℃孵育4 h后小心吸出上清液,每孔加入150 μL二甲基亚砜(dimethyl-sulfoxide, DMSO)振荡10 min,490 nm波长测定各孔吸光度值(A值),计算细胞存活率。存活率/%=实验组A值/空白对照组A值×100%。实验重复3次,找到诱导海马神经元存活率降低的CRH的最低敏感浓度。
用神经元培养液将CRH受体1特异性拮抗剂CP154526稀释至10、50、250 mmol·L-1的终浓度,与CRH共同刺激海马神经元48 h,上述同样方法检测神经元存活率,找到CP154526的最低敏感浓度。
1.2.4 实验分组 后续实验分为4组:(1)空白对照组:神经元培养液正常培养;(2)CRH组:用MTT结果中CRH诱导海马神经元凋亡的最低敏感浓度培养;(3)CRH+CP组:加入CRH同时加入CRH受体1拮抗剂CP154526;(4)CP组:只加入CP154526培养。各组培养液量一致,均培养48 h。
1.2.5 TUNEL检测细胞凋亡率 以末端脱氧核苷酸转移酶介导的dUTP缺口末端标记(TUNEL)法,按试剂盒说明进行细胞凋亡检测,DAPI复染细胞核。凋亡神经元细胞核呈绿色荧光。每张切片于凋亡细胞分布区域随机选取10个高倍视野,计算出平均每100个细胞中的凋亡细胞数,以百分数(%)表示凋亡百分率。
1.2.6 流式细胞术检测 用0.25%胰蛋白酶制备单细胞悬液,用膜联蛋白V (Annexin V) / 碘化丙啶(propidium iodide, PI)双染色标记法进行流式细胞仪检测细胞凋亡百分率。
1.2.7 Western blot检测海马神经元Bax、Bcl-2、caspase-3表达 收集各组细胞提取总蛋白,每组样品取50 μg总蛋白,加6×上样缓冲液,100℃变性5 min,经10% SDS-PAGE凝胶电泳后电转移至PVDF膜。5%脱脂奶粉37℃封闭2 h,加入一抗Bax(1 ∶1 000)、Bcl-2(1 ∶200)、caspase-3(1 ∶1 000)和β-actin(1 ∶1 000),4℃孵育过夜。TTBS洗膜后加辣根过氧化物酶标记的羊抗兔/鼠IgG(1:5000),37℃孵育2 h,TTBS洗膜,滴加ECL发光剂,于Odyssey FC成像系统中显影,并对条带进行定量分析。以目的条带和β-actin条带积分光密度值比值作为最终结果。

2 结果
2.1 原代培养海马神经元的形态特征及鉴定倒置显微镜下可见,原代培养海马神经元7 d时神经元胞体丰满,周围光晕明显,立体感强,突起增粗增长,连接成网状(Fig 1A),显示神经元成熟。Fig 1B所示为神经元特异性标志物MAP2免疫荧光染色,可见神经元胞体和突起着色,经鉴定神经元纯度在90%以上,可用于后续实验研究。

Fig 1 Primary culture and immunofluorescence identification of hippocampal neuron
A: morphological characteristics of primary cultivated hippocampal neuron(×200); B: the immunofluorescence identification of hippocampal neuron (×200).
2.2 MTT检测神经元存活率以正常对照组细胞存活率为100%计算,不同浓度的CRH刺激海马神经元后,随着浓度的增大,细胞存活率呈下降趋势;与正常对照组相比,浓度为10-8mol·L-1的CRH刺激后,细胞存活率降低即具有统计学意义(P<0.05,Fig 2A),故CRH导致神经元存活率降低的最低敏感浓度为10-8mol·L-1。
将不同浓度的CRH受体1特异性拮抗剂CP154526分别加入10-8mol·L-1CRH刺激的神经元培养基中,可见,随着浓度的增大,细胞存活率有所升高,与CRH组相比,50 mmol·L-1的CP154526可明显提升神经元存活率(P<0.05,Fig 2B)。

Fig 2 Cell viability assayed by MTT
*P<0.05,**P<0.01vscontrol;#P<0.05vsCRH.
2.3 TUNEL检测凋亡率TUNEL染色可见,与正常对照组相比,10-8mol·L-1的CRH刺激后凋亡细胞明显增加(P<0.05),加用50 mmol·L-1的CP154526后,凋亡细胞明显减少(P<0.05)。单独应用CP154526,和正常对照组相比,凋亡细胞没有明显变化,见Fig 3。
2.4 流式细胞术检测凋亡率Annexin Ⅴ是检测细胞早期凋亡的敏感指标之一。流式细胞仪将收集到的细胞分为四个象限,左下象限代表的是活细胞,右下象限代表的是早期凋亡细胞,右上象限代表的是晚期凋亡细胞。早期凋亡和晚期凋亡比率之和作为总的凋亡率。如Fig 4所示,与正常对照组相比,CRH刺激后神经元凋亡率明显增加(P<0.05);加用CP154526后,凋亡率明显降低(P<0.05);而单独应用CP154526,与正常对照组相比,神经元细胞凋亡率没有明显变化(P>0.05)。
2.5 Western blot检测海马神经元Bax、Bcl-2、caspase-3蛋白表达结果与正常对照组相比,CRH刺激后,凋亡标志蛋白Bax表达增加,Bcl-2表达降低,Bax/Bcl-2比值明显升高(P<0.05);caspase-3蛋白表达增加(P<0.05)。加用CP154526后,Bax/Bcl-2比值明显降低(P<0.05);caspase-3表达也明显降低(P<0.05)。而单独应用CP154526,Bax/Bcl-2比值和Caspase-3蛋白水平与对照组相比均无统计学意义(P>0.05),见Fig 5。
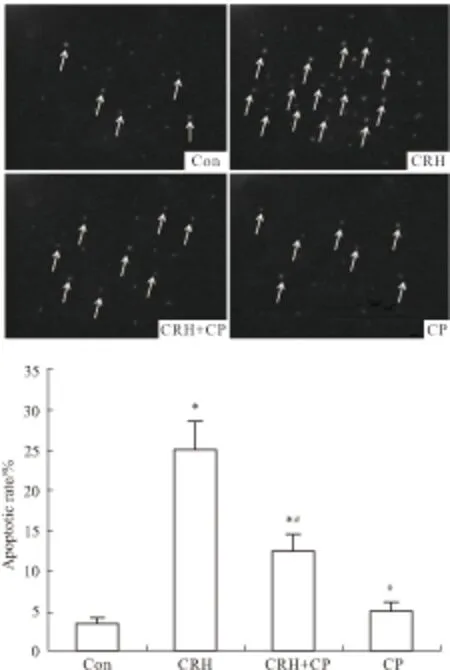
Fig 3 Neuron apoptotic rates of different groups examined by TUNEL(CRH: 10-8 mol·L-1; CP154526: 50 mmol·L-1)
*P<0.05vscontrol;#P<0.05vsCRH.
3 讨论
应激反应中,HPA轴激活的中枢控制是十分复杂的,在这一系列神经内分泌调节过程中,下丘脑合成和释放的CRH起着关键作用,它控制着HPA轴的兴奋水平。随着对应激反应研究的深入,发现CRH还是一种重要的神经递质,在情绪反应、学习记忆和神经系统损伤与发育中也有着重要作用[2]。
海马是边缘系统的重要组成部分,是HPA轴应激反应的高位调节中枢,参与了情绪、学习和记忆、行为、免疫等的调节,对应激反应非常敏感且易损,它的损伤在各种应激所致疾患中起到关键作用。研究表明,慢性应激可能通过增加海马神经元细胞凋亡,导致海马损害,从而诱发抑郁症[9-10]。因为位于海马CA1区的锥体细胞表达糖皮质激素受体,而应激状态下,肾上腺分泌的糖皮质激素可以通过血脑屏障作用于这些受体,因此,很多学者认为糖皮质激素及其受体介导应激对海马功能产生影响[11]。但是,当肾上腺切除后,慢性应激一样可以影响海马功能。越来越多的研究结果显示,CRH及其受体参与介导应激对海马结构和功能产生影响[12]。
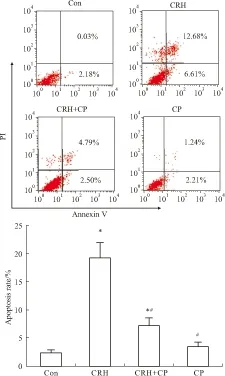
Fig 4 Neuron apoptotic rates of different groups examined by Annexin V/PI(CRH: 10-8 mol·L-1; CP154526: 50 mmol·L-1)
*P<0.05vscontrol;#P<0.05vsCRH.
目前已知的CRH受体有3种,即CRH-R1、CRH-R2和CRH-R3,均属于G蛋白偶联受体。3种受体的功能及与CRH的亲和力不尽相同。其中CRH-R1由415~420个氨基酸组成,与CRH有较高的亲和力。CRH-R1 mRNA主要表达于哺乳动物的中枢神经系统中,如下丘脑、海马、大脑皮层、杏仁体、蓝斑等部位,在外周的表达极其有限[4]。大量研究表明,在应激状态下,CRH主要通过CRH-R1发挥内分泌、行为改变和内脏反应等功能的调节作用[5-7]。CRH-R2序列与CHR-R1有约70%的同源性,其在中枢神经系统表达有限,而在外周主要表达在心肌、骨骼肌、胃肠道等部位[13]。CRH-R3最早于2001年被分离出来,由428个氨基酸序列组成,但有关其分布、特性及作用尚不清楚[14]。

Fig 5 Protein expression of Bax, Bcl-2 and Caspase-3 in different groups examined by Western blot (CRH: 10-8 mol·L-1; CP154526: 50 mmol·L-1)
*P<0.05vscontrol;#P<0.05vsCRH.
关于CRH受体在应激中的作用,有研究报道,应用CRH-R1基因敲除鼠,基础和应激状态下HPA轴功能明显受损。而边缘系统CRH-R1对调控应激时HPA轴反应至关重要[15]。我们前期研究发现,一定浓度的CRH可以降低海马神经元细胞存活率,但CRH的作用是否是通过其受体1来发挥的,及其具体的作用机制尚不清楚。本实验中,我们应用TUNEL、流式Annexin Ⅴ-PI双标染色、Western blot等方法进一步证实,CRH可以导致体外原代培养的大鼠海马神经元细胞凋亡增加,应用CRH-R1特异性拮抗剂CP154526可以有效的降低神经元凋亡率,说明CRH-R1确实在CRH诱导神经元凋亡的过程中发挥了重要作用。
关于CP154526降低神经元凋亡的可能原因,目前尚无明确报道。我们考虑, 可能与CP154526高度亲脂性及其半衰期较长有关,使得CP154526可与CRH-R1充分结合,从而抑制了CRH的作用。当然,细胞内调控凋亡的信号系统精细复杂,CP154526具体是如何发挥其调控作用的将是我们下一步研究的重点。
上述实验结果说明,应激状态下,一定浓度的CRH可通过其受体1诱导神经元细胞凋亡,而CP154526对神经细胞的凋亡具有一定的抑制作用,可为应激所致精神损伤的细胞保护治疗提供新的思路。
[1] Vale W, Spiess J, Rivier C, et al. Characterization of a 41-residue ovine hypothalamic peptide that stimulates secretion of corticotropin and beta-endorphin [J].Science, 1981, 213(4514): 1394-7.
[2] Claes S J. Corticotropin-releasing hormone (CRH) in psychiatry: from stress to psychopathology [J].AnnMed, 2004, 36(1): 50-61.
[3] Zhang Y, Liu W, Ma C, et al. Endoplasmic reticulum stress contributes to CRH-induced hippocampal neuron apoptosis [J].ExpCellRes, 2012, 318(6): 732-40.
[4] Müller M B, Preil J, Renner U, et al. Expression of CRHR1 and CRHR2 in mouse pituitary and adrenal gland: implications for HPA system regulation [J].Endocrinology, 2001, 142(9): 4150-3.
[5] Boqdan R, Santesso D L, Faqerness J, et al. Corticotropin-releasing hormone receptor type 1 (CRHR1) genetic variation and stress interact to influence reward learning [J].JNeurosci, 2011, 31(37): 13246-54.
[6] Wasserman D, Wasserman J, Rozanov V, et al. Depression in suicidal males: genetic risk variants in the CRHR1 gene [J].GenesBrainBehav, 2009, 8(1): 72-9.
[7] Wasserman D, Sokolowski M, Rozanov V, et al. The CRHR1 gene: a marker for suicidality in depressed males exposed to low stress [J].GenesBrainBehav, 2008, 7(1): 14-9.
[8] 肖复茜, 李洪秀, 隋海娟, 等. 知母皂苷元对高糖引起的体外培养大鼠海马神经元损伤的保护作用 [J]. 中国药理学通报, 2013, 29(1): 107-12.
[8] Xiao F X, Li H X, Sui H J, et al. Protective effect of Sarsasapogenin against hyperglycemia induced neurotoxicity in cultured hippocampal neurons [J].ClinPharmacolBull, 2013, 29(1): 107-12.
[9] Bachis A, Cruz M I, Nosheny R L, et al. Chronic unpredictable stress promotes neuronal apoptosis in the cerebral cortex [J].NeurosciLett, 2008, 442(2): 104-8.
[10] Lucassen P J, Heine V M, Muller M B, et al. Stress, depression and hippocampal apoptosis [J].CNSNeurolDisordDrugTargets, 2006, 5(5): 531-46.
[11] McEwen B S. Mood disorders and allostatic load [J].BiolPsychiatry, 2003, 54(3): 200-7.
[12] Orozco-Cabal L, Pollandt S, Liu J, et al. Regulation of synaptic transmission by CRF receptors [J].RevNeurosci, 2006, 17(3): 279-307.
[13] Hashimoto K, Makino S, Asaba K, et al. Physiological roles of corticotropin-releasing hormone receptor type 2 [J].EndocrJ,2001, 48(1): 1-9.
[14] Paez-Pereda M, Hausch F, Holsboer F. Corticotropin releasing factor receptor antagonists for major depressive disorder [J].ExpertOpinInvestigDrugs, 2011, 20(4): 519-35.
[15] 曾 纯, 严 灿, 徐志伟, 等. 促肾上腺皮质激素释放激素受体在应激反应中的作用研究 [J]. 中国药理学通报, 2006, 22(5): 517-20.
[15] Zeng C, Yan C, Xu Z W, et al. Research on the effect of corticotropin-releasing hormone receptors in stress reaction [J].ClinPharmacolBull, 2006, 22(5): 517-20.
Effects of CP154526,the corticotropin releasing hormone receptor 1 antagonist,on rat hippocampal neuron apoptosis
ZHOU Yi1, LIU Wei2, ZHANG Yue3
(1.DeptofNeurology,theSecondHospitalofHebeiMedicalUniversity,Shijiazhuang050017,China, 2.DeptofPathologyHebeiMedicalUniversity,Shijiazhuang050017,China, 3.DeptofClinicalDiagnostics,HebeiMedicalUniversity,Shijiazhuang050017,China)
Aim To investigate the effects of CP154526, a corticotropin releasing hormone (CRH) receptor 1 antagonist, on the hippocampal neuron apoptosis. Methods Rat hippocampal neurons were primarily cultured. Cell viability was estimated using MTT assays. Neurons were randomly divided into four groups: Normal cultures (Control); CRH-exposed cultures (CRH); CRH and CP154526 co-exposed cultures (CRH+CP); CP154526-exposed cultures (CP). Cell apoptosis was examined by TUNEL or flow cytometry Annexin Ⅴ-PI staining. The protein levels of Bax, Bcl-2 and Caspase-3 were investigated by Western Blotting. Results 10-8mol·L-1CRH decreased cell viability of cultured hippocampal neuron (P<0.05), while 50 mmol·L-1CP154526 significantly increased neuron viability (P<0.05). Compared with Control group, cell apoptotic rate, the ratio of Bax and Bcl-2 and the protein level of Caspase-3 were elevated in hippocampal neuron induced by CRH. Combined with CP154526 reversed the effects of CRH. Application of CP154526 alone had no obvious effects on cell apoptosis. Conclusions A certain concentration of CRH can induce hippocampal neuron apoptosis, and its receptor 1 antagonist CP154526 can effectively reduce the apoptosis and play a neuroprotective role.
CRH; CP154526; hippocampus; neuron; apoptosis; primary culture
时间:2015-3-16 15:41 网络出版地址:http://www.cnki.net/kcms/detail/34.1086.R.20150316.1541.021.html
2014-11-09,
2015-01-23
国家自然科学基金资助项目(No 81302625);河北省高等学校科学技术研究优秀青年基金项目(No Y2012001)
周 毅(1978-),男,硕士,主治医师,研究方向:神经系统疾病,Tel:0311-86265661,E-mail:lwei929@126.com; 张 悦(1978-),女,博士,副教授,研究方向:神经系统疾病,通讯作者,Tel:0311-86265661,E-mail:zhyue515@126.com
10.3969/j.issn.1001-1978.2015.04.013
A
1001-1978(2015)04-0504-06
R-332;R322.81;R329.25;R392.11;R977.11

