麦冬皂苷B对A549细胞株体外黏附、侵袭及迁移的抑制作用及机制研究
陈美娟,赵若琳,郭园园,宁利敏,张 旭
(南京中医药大学,江苏省中医药防治肿瘤协同创新中心,江苏 南京 210023)
麦冬皂苷B对A549细胞株体外黏附、侵袭及迁移的抑制作用及机制研究
陈美娟,赵若琳,郭园园,宁利敏,张 旭
(南京中医药大学,江苏省中医药防治肿瘤协同创新中心,江苏 南京 210023)
目的 探究麦冬皂苷B (ophiopogonin-B, OP-B)抑制非小细胞肺癌细胞株A549黏附、侵袭、迁移的作用及其机制。方法 细胞黏附实验、Transwell小室实验分别检测细胞黏附、迁移和侵袭能力。通过荧光实时定量反转录PCR(qRT-PCR)检测OP-B对A549细胞中MMP-2/9 mRNA表达水平的调控,Western blot法检测细胞中MMP-2/9蛋白及其上游调控蛋白Akt及其磷酸化水平的变化。结果 10 μmol·L-1浓度的OP-B能明显抑制A549细胞黏附、侵袭和迁移,同时能抑制其MMP-2/9 mRNA及蛋白水平的表达,并抑制其上游p-Akt的表达。 结论 OP-B有效抑制A549细胞黏附、侵袭和迁移,其作用与下调MMP-2/9 mRNA和蛋白水平的表达及抑制其上游Akt的磷酸化有关。
麦冬皂苷B; 非小细胞肺癌; 黏附; 侵袭; 迁移; 基质金属蛋白酶-2; 基质金属蛋白酶-9
非小细胞肺癌(non-small cell lung cancer,NSCLC) 是肺恶性肿瘤的主要病理类型,也是全世界范围内癌症致死的主要原因之一。尽管在 NSCLC 的临床和实验肿瘤学方面的研究取得了较大进展,但是其预后仍不理想,目前其5 年生存率仅为11%左右[1]。临床上将近一半的患者在确诊时已进入晚期,并已发生远处脏器的转移[2]。
肿瘤细胞的转移受多因素、多步骤调控,主要包括肿瘤细胞间黏附力降低,与细胞外基质(extracellular matrix, ECM)间黏附力增强,通过降解ECM和基底膜,其迁移、侵袭能力增强,从而易于进入血流或淋巴系统,并最终到达靶器官形成新的肿瘤生长[3]。在此过程中,基质金属蛋白酶(matrix metalloproteinases,MMPs)是促进侵袭和转移的关键蛋白,尤其是MMP-2和MMP-9的高表达能明显促进肿瘤细胞的侵袭和转移。另外,PI3K/Akt信号转导通路在MMP-2和MMP-9靶基因表达中发挥关键调节作用[4]。
麦冬皂苷B(ophiopogonin-B, OP-B)是从中药麦冬中分离提取的一种单体,研究表明其对于多种NSCLC细胞株均具有明显的增殖抑制作用[5]。近年国内外的研究发现,通过抑制PI3K/Akt通路,OP-B能诱导NSCLC、宫颈癌等肿瘤细胞发生自噬[5-6]。但对其在抑制肿瘤细胞侵袭和迁移方面的研究尚未开展。本实验旨在探究OP-B对肺腺癌细胞株A549的黏附、侵袭和迁移能力的影响及其作用机制,为OP-B抑制NSCLC侵袭转移提供实验基础和依据。
1 材料与方法
1.1 材料
1.1.1 细胞株 肺腺癌A549细胞株购自中国科学院上海生命科学院生物化学与细胞生物学研究所。
1.1.2 主要试剂 麦冬皂苷-B购自南京泽朗医药科技有限公司 (ZL20110412B),用二甲亚砜(DMSO)配成10 mmol·L-1浓度的贮液备用,细胞中使用时DMSO的最终浓度小于0.01%。胎牛血清及DMEM/F12培养液购自Gibco公司;胰酶、Ⅰ型胶原蛋白(CollagenⅠ)、牛血清白蛋白(BSA)、凝胶配置试剂盒购自碧云天生物技术研究所;聚偏二氟乙烯膜(PVDF)购自Millipore公司;Transwell小室购自Corning公司;MMP-2、MMP-9、p-Akt (Ser473)、β-actin一抗及羊抗兔、羊抗鼠二抗均购自Cell Signaling公司;TRIzol购自Invitrogen公司;cDNA第一链合成试剂盒购自Fermentas公司;Real time PCR Master Mix (SYBR Green) 购自Toyobo公司。
1.2 方法
1.2.1 细胞培养 将A549细胞培养于含10%胎牛血清的DMEM/F12培养液中,置37℃、体积分数为5% 的CO2培养箱中培养,实验时取对数生长期细胞。
1.2.2 细胞黏附实验 96孔培养板包被:每孔加入CollagenⅠ溶液50 μL,置37℃、5% CO2孵箱中孵育1 h;PBS洗2次,加入3% BSA 0.2 mL,孵育2 h,PBS再洗2次,备用。分别取不同浓度的OP-B(0、5、10 μmol·L-1) 作用细胞24 h,经洗涤、消化后用无血清的DMEM/F12培养基调整细胞浓度为3×108·L-1,分别加入到包被过的96孔板,每孔100 μL,每组设5个平行复孔,37 ℃、5% CO2条件下温育2 h。弃去各孔培养液,PBS冲洗除去未黏附细胞,每孔加50 μL MTT使用液(PBS溶解,1 g·L-1),CO2细胞培养箱温育3 h。吸弃MTT使用液,每孔加DMSO 150 μL,溶解结晶后,酶标仪检测各孔的 OD570值。黏附抑制率(IR)/%= (1-实验组OD值/对照组OD值)×100%。
1.2.3 Transwell小室侵袭实验 Transwell小室纤维膜孔径为8 μm,下室中加入600 μL含10%胎牛血清的培养液,上室加入100 μL不含胎牛血清的培养液,然后按照每毫升1×105个细胞的密度在上室加入OP-B(0、5、10、20 μmol·L-1)处理后的细胞悬液30 μL,置于37 ℃、5% CO2的培养箱中培养72 h,取出滤膜,甲醇固定,姬姆萨染色,显微镜下每张滤膜随机取5个视野(× 200)拍照,并计数穿膜细胞数,取平均数表示肿瘤细胞的侵袭能力。
1.2.4 RNA提取和qRT-PCR检测 使用TRIzol试剂提取细胞总RNA,通过测定OD260/OD280值检验其纯度和浓度。使用Primer Script反转录试剂盒和SYBR Premix Ex Taq进行qRT-PCR分析,检测MMP-2、MMP-9的表达水平,结果用磷酸甘油酸脱氢酶 (GAPDH) 的表达量进行标准化。相应的引物序列见Tab 1。使用 DA7600 进行 qRT-PCR 和数据收集。分析qRT-PCR 的结果并计算其相对于临界循环次数的值,然后转换为相对 GAPDH 的倍数改变,采用2-△△Ct法进行标准化。

Tab 1 qRT-PCR primer
1.2.5 Western blot 检测细胞内相关蛋白变化 取对数生长期细胞消化接种到 6 孔板中,细胞密度为 5×108·L-1。药物处理一定时间后,收集细胞并用 PBS 洗涤 2 次,每孔加入细胞裂解液 200 μL,12 000 r·min-1离心20 min,收集蛋白并定量。取一定量的蛋白,加入 5×电泳上样缓冲液,沸水浴变性 5 min,经 12% 的SDS-聚丙烯酰胺凝胶电泳后,电转移至 PVDF 膜,5% 脱脂奶粉封闭后,加入一抗 4℃孵育过夜、二抗室温孵育 1 h,TBST缓冲液洗涤3次,每次10 min,滴加 ECL发光液置于 BioRad 凝胶成像仪中曝光并采集图像。
1.2.6 统计学分析 应用SPSS 16.0统计软件对数据进行统计学处理。计量资料两组间比较用t检验,多组间比较用单因素方差分析;计数资料组间比较用 Mann-Whitney U 检验。
2 结果
2.1 OP-B对A549细胞黏附能力的影响不同浓度的 OP-B (0、5、10 μmol·L-1)分别作用于细胞 24 h后检测细胞的黏附能力。结果表明,OP-B 作用后,A549细胞的黏附能力逐渐减弱,即药物对细胞的黏附抑制率逐渐升高,并呈浓度依赖性(Tab 2),与OP-B (5 μmol·L-1)组的细胞黏附抑制率相比,各组间差异有统计学意义(P<0.01)。
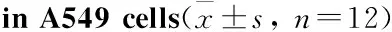

GroupOD570nmTheinhibitionrateofcelladhesion/%Control0.328±0.120OP-B5μmol·L-10.289±0.0111.89OP-B10μmol·L-10.221±0.0432.62**
**P<0.01vsOP-B 5 μmol·L-1group.
2.2 OP-B对A549细胞侵袭迁移能力的影响用带Matrigel胶的Transwell小室实验检测OP-B对A549细胞侵袭能力的影响,结果发现,2.5、5 μmol·L-1的OP-B对A549细胞的侵袭迁移没有明显影响,只有在10 μmol·L-1的浓度下处理细胞 24 h 后,才能明显抑制A549细胞的侵袭和迁移能力(P<0.01)(Fig 1)。
2.3 OP-B对A549细胞中MMP-2和MMP-9基因水平的调控MMPs是一类分解ECM组分的锌蛋白酶,肿瘤细胞通过已存在或新形成的结合位点与ECM结合,进而溶解ECM,最后经ECM的缺损向外扩散。qRT-PCR进一步研究OP-B对A549细胞中MMP-2/9 mRNA表达水平的调控,发现OP-B对A549细胞中MMP-2 和 MMP-9 mRNA表达水平的抑制呈剂量依赖关系,与Control组相比差异有统计学意义(P<0.01)(Tab 3)。
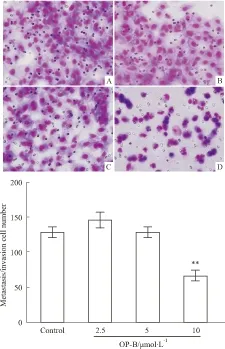
Fig 1 Effects of OP-B on the invasion and metastasis of A549 cells detected by Matrigel contained transwell chamber assay
The upper figure was the metastasis and invasion cells (SP×200); the lower figure was the analysis compared with control group.A: Control group; B~D: 2.5, 5, 10μmol·L-1OP-B treated group.**P<0.01vscontrol group
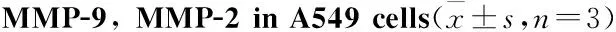

GroupMMP-2(2-ΔΔCT)MMP-9(2-ΔΔCT)Control1.000±0.0111.000±0.024OP-B5μmol·L-10.408±0.037**0.618±0.006**OP-B10μmol·L-10.121±0.004**0.107±0.001**
**P<0.01vscontrol group.
2.4 OP-B对A549细胞中MMP-2和MMP-9蛋白表达水平的影响前面的结果显示10 μmol·L-1浓度的OP-B能明显抑制A549细胞的黏附和侵袭、迁移,为进一步探究OP-B抑制A549细胞黏附、侵袭和迁移的作用机制,进一步用Western blot法检测了MMP-2和MMP-9蛋白的表达。结果表明,与其抑制A549细胞中MMP-2 和MMP-9 mRNA水平的表达相一致,OP-B对MMP-2和MMP-9蛋白的表达抑制呈时间依赖性,同时,对调控迁移的上游蛋白Akt的磷酸化具有明显的抑制作用(Fig 2)。

Fig 2 Effects of OP-B on the expression of p-Akt,Akt, MMP-2 and MMP-9 in A549 cells
3 讨论
肿瘤治疗失败的原因主要是复发和发生重要器官的转移。即使同为Ⅰ期的肿瘤患者,NSCLC患者的术后转移复发风险高于其他肿瘤患者,且预后也明显差于其他肿瘤患者[7]。
临床上,中药在稳定瘤体,防止肿瘤的迁移和复发上普遍具有一定的优势,“周氏克金岩方”在肺癌的临床治疗中同样表现出相关的抑制NSCLC细胞迁移的作用。前期研究发现,麦冬皂苷B是“周氏克金岩方”中代表性的抗癌成分,其对多种NSCLC细胞株均具有明显的增殖抑制作用,并能有效诱导肺鳞癌细胞株 NCI-H157及巨细胞癌细胞株 NCI-H460发生二型程序性死亡[5],但其对肺癌细胞黏附、侵袭及迁移的影响有待研究。
本研究首先通过细胞黏附实验初步发现,OP-B能明显降低A549细胞的黏附能力,并呈浓度依赖性(Tab 2)。肿瘤细胞侵袭/迁移能力的研究方法主要有细胞划痕实验及Transwell 小室实验[8],本研究选择了含Matrigel胶的Transwell小室实验进行药物对A549细胞侵袭、迁移能力影响的观察,结果表明,OP-B在10 μmol·L-1浓度下能有效抑制A549细胞的迁移和侵袭(Fig 1)。
另外,肿瘤转移是一个复杂、多步骤的过程,肿瘤细胞脱离原发灶后,通过降解基底膜,向外浸润、迁移并黏附于血管内皮细胞,然后进入循环系统并停留于远处的血管壁,最终穿过血管侵入ECM形成转移灶[9]。其中,ECM的降解是肿瘤浸润正常组织及开始转移的基本途径。研究表明,在这一过程中MMPs发挥了重要的作用,尤其是MMPs家族成员明胶酶 (MMP-2和MMP-9),由于其能够特异性降解基底膜的主要成分Ⅳ型胶原和ECM,在多种恶性肿瘤的侵袭转移过程中发挥至关重要的作用[10]。
qRT-PCR 和Western blot研究发现,OP-B作用于A549细胞后,不仅降低细胞中MMP-9 和 MMP-2 mRNA水平的表达,而且下调细胞中MMP-2和MMP-9蛋白水平的表达,并呈时间依赖性(Fig 2和Tab 3)。因此,OP-B抑制NSCLC细胞黏附、侵袭和迁移与抑制MMP-2和MMP-9的表达有关。
此外,Akt可以通过激活MMP-9和MMP-2促进肿瘤的侵袭和迁移[11-12]。因此,抑制Akt的表达被作为抑制肿瘤转移的调控靶点,并且研究发现Akt的激活即形成磷酸化的Akt(p-Akt)与NSCLC的转移密切相关,p-Akt的过表达可以提高NSCLC黏附、侵袭和转移能力[13]。本研究表明,OP-B同时能抑制A549细胞中p-Akt的表达(Fig 3)
综上,本实验结果首次证明了OP-B抑制NSCLC细胞A549的黏附、侵袭和迁移,其作用与下调MMP-2和MMP-9 mRNA和蛋白的表达及抑制其上游p-Akt的水平有关。由此表明,OP-B具有较好的抗NSCLC转移作用,为OP-B的进一步药物研发和临床应用提供了实验基础和依据。
[1] Verdecchia A, Francisci S, Brenner H, et al. Recent cancer survival in Europe: a 2000-02 period analysis of EUROCARE-4 data [J].LancetOncol, 2007, 8 (9):784-96.
[2] Coleman M P, Forman D, Bryant H, et al. Cancer survival in Australia, Canada, Denmark, Norway, Sweden, and the UK, 1995-2007 (the International Cancer Benchmarking Partnership-):an analysis of population-based cancer registry data[J].Lancet, 2011, 377 (9760):127-38.
[3] Fried P, Wolf K. Tumour cell invasion and migration: diversity and escape mechanisms [J].NatRevCancer, 2003,3(5):362-74.
[4] Cheng C Y, Hsieh H L, Hsiao L D, et al. PI3-K/Akt/JNK/NF-kappaB is essential for MMP-9 expression and outgrowth in human limbal epithelial cells on intact amniotic membrane [J].StemCellRes, 2012, 9:9-23.
[5] Chen M, Du Y, Qui M, et al. Ophiopogonin B-induced autophagy in on-small cell lung cancer cells via inhibition of the PI3K/Akt signaling pathway [J].OncolRep, 2013, 29(2):430-6.
[6] 许秋菊, 侯莉莉, 胡国强, 等. 麦冬皂苷 B 诱导人宫颈癌 HeLa 细胞自噬的机制 [J]. 药学学报, 2013, 48 (6):855-9.
[6] Xu Q J, Hou L L, Hu G Q, et al. Molecular mechanism of ophiopogonin B induced cellular autophagy of human cervical cancer HeLa cells [J].ActaPharmSin, 2013, 48 (6):855-9.
[7] Kinch M S, Moore M B, Harpole D H. Predictive value of the EphA2 receptor tyrosine kinase in lung cancer recurrence and survival [J].ClinCancerRes, 2003, 9: 613-8.
[8] 胡剑江, 雷洪涛, 侯燕鸣. 肿瘤细胞迁移过程的动态评估方法 [J]. 中国药理学通报, 2010, 26 (1) :128-31.
[8] Hu J J, Lei H T, Hou Y M. A new evaluation method for tumor cell migration process [J].ChinPharmacolBull, 2010, 26 (1):128-31.
[9] Steeg P S. Tumor metastasis: mechanistic insights andclinical challenges [J].NatMed, 2006, 12: 895-904.
[10] Roy R, Yang J, Moses M A. Matrix metalloprotemases as novel biomarkers and potential therapeutic targets in human cancer [J].JClinOncol, 2009, 27:5287-97.
[11] Lu Z, Lu N, Li C, et al. Oroxylin A inhibits matrix metalloproteinase-2/9 expression and activation by up-regulating tissue inhibitor of metalloproteinase-2 and suppressing the ERK1/2 signaling pathway[J].ToxicolLett, 2012, 209 (3) :211-20.
[12] Bauvois B. New facets of matrix metalloproteinases MMP-2 and MMP-9 as cell surface transducers: outside-in signaling and relationship to tumor progression [J].BiochimBiophysActa, 2012, 1825 (1) :29-36.
[13] 祝冰晶, 周向东. PI3K/Akt通路在肺癌转移和耐药中的研究 [J]. 中国肺癌杂志, 2011, 14(8):689-94.
[13] Zhu B J, Zhou X D. Study of the effect of PI3K/Akt pathway in lung cancer metastasis and drug resistance [J].ChinJLungCancer, 2011, 14(8):689-94.
Inhibitory effect of ophiopogonin-B on adhesion,invasion and migration of A549 cellsinvitro
CHEN Mei-juan, ZHAO Ruo-lin, GUO Yuan-yuan, NING Li-min, ZHANG Xu
(NanjingUniversityofChineseMedicine,JiangsuCollaborativeInnovationCenterofTraditionalChineseMedicinePreventionandTreatmentofTumor,Nanjing210023,China)
Aim To explore the inhibitory effects of ophiopogonin-B (OP-B) on cell adhesion, invasion and migration in non-small cell lung cancer (NSCLC) A549 cellsinvitroand its possible mechanism. Methods Cell adhesion assay and transwell chamber assay were used to detect the ability of cell adhesion, migration and invasion. qRT-PCR was used to detect the mRNA levels of MMP-2 and 9. Meanwhile, Western blot assay was performed to determine the protein levels of MMP-2/9 and p-Akt. Results OP-B significantly inhibited the ability of cell adhesion, invasion and migration in A549 cells at the concentration of 10 μmol·L-1(P<0.01). Meanwhile, it inhibited the mRNA and protein levels of MMP-2 and MMP-9 and down-regulated the phosphorylation of Akt (P<0.01). Conclusion OP-B inhibits cell adhesion, invasion and migration in A549 cells through down-regulation of the mRNA and protein expression of MMP-2/ 9, and the inhibitory effect on the expression of p-Akt.
ophiopogonin-B; non-small cell lung cancer; adhesion; invasion; migration; matrix metalloproteinase-2; matrix metalloproteinase-9
时间:2015-4-15 15:44 网络出版地址:http://www.cnki.net/kcms/detail/34.1086.R.20150415.1545.015.html
2015-01-08,
2015-01-29
江苏省自然科学基金资助项目(No BK20131415);江苏省高校优势学科建设工程项目(PAPD);欧盟第七框架项目(No PIRSES-GA-2013-612589)
陈美娟(1977-),女,博士,副教授,研究方向:中医药抗肿瘤作用及机制研究, E-mail:mjchen9680@sina.com; 张 旭(1968-),女,博士,教授,研究方向:中医药抗肿瘤作用及机制研究,通讯作者,E-mail:zhangxu@njutcm.edu.cn
10.3969/j.issn.1001-1978.2015.05.014
A
1001-1978(2015)05-0660-05
R282.71;R284.1;R329.25;R734.202.2;R977.3

