产前应激对成年子代大鼠缺血性卒中后细胞凋亡的影响*
王凌星, 黄红红 ,陈雅芳, 蔡鸿潮, 钱家强
(福建医科大学附属第二医院神经内科, 泉州 362000)
产前应激对成年子代大鼠缺血性卒中后细胞凋亡的影响*
王凌星, 黄红红△,陈雅芳, 蔡鸿潮, 钱家强
(福建医科大学附属第二医院神经内科, 泉州 362000)
目的:研究产前应激对雄性子代大鼠大脑中动脉缺血/再灌注后神经功能的影响。方法:SD孕鼠随机进行产前应激处理(孕期每日3次限制活动)和无产前应激处理,并对其雄性子代大鼠采用线栓法制备大脑中动脉局灶性脑缺血(MCAO)模型,共分为假手术组、产前应激+假手术组、MCAO模型组、产前应激+MCAO组(n=10)。于再灌注24 h后进行神经功能评分,并检测脑梗死面积、神经细胞凋亡情况和凋亡相关蛋白表达。结果:产前应激+MCAO组子代大鼠神经功能评分、脑梗死面积百分比、TUNEL阳性细胞、半胱氨酸天冬氨酸蛋白酶3(Caspase 3)和活化的Caspase 3蛋白表达均较MCAO组显著增加(P<0.05),而B淋巴细胞瘤-2(Bcl-2)蛋白表达较MCAO组减少(P<0.05)。结论:产前应激可能通过促进子代大鼠脑缺血/再灌注后神经细胞凋亡,加重神经功能缺损。
产前应激;子代大鼠; 脑缺血; 调亡
妊娠期应激是一种常见的宫内不良环境,可能来自生活或工作事件,包括战争、自然灾害、失业、家庭或婚姻的不和谐、家人或配偶的死亡等因素。在动物实验中已发现产前应激会引起成年子代对不利刺激的高反应性[1], 并且新生儿期的应激会加重子代成年对脑缺血性损害的易感性[2],提示围产期不良因素与成年缺血性卒中的愈后存在一定的关系。而产前应激对子代脑缺血性卒中的影响及机制尚不明确。本研究通过使用大鼠产前应激模型和子代大
鼠缺血/再灌注模型,检测产前应激对子代脑梗死面积、神经功能缺损和细胞凋亡的影响,并探讨潜在机制,从而明确产前应激对子代脑缺血/再灌注的影响,为治疗提供理论依据。
1 材料与方法
1.1 实验动物与分组
健康SD雌性12周龄大鼠20只,体重200~250 g,健康雄性12周龄大鼠9只,体重300~350 g,购自上海斯莱克实验动物有限公司。动物饲养条件:光照7∶00-19∶00,温度为22℃±1℃,自由摄取食物和水。大鼠按雌:雄1∶1比例随机合笼,以发现阴栓为妊娠第0天。孕鼠按随机数字表法分为产前应激处理和无产前应激处理。所有孕鼠均自然分娩,仔鼠每窝随机留8只饲养,以避免奶水摄入不足对新生仔鼠生长的影响。子代大鼠满3周后断乳,仅保留雄性子代大鼠(3~4只/窝)。雄性子代大鼠于2月龄(体重约250~300 g)时建立大脑中动脉局灶性脑缺血(middle cerebral artery occlusion model ,MCAO)模型。实验共分四组:假手术组、产前应激+假手术组、MCAO组、产前应激+MCAO组(n=10)。
1.2 动物模型
1.2.1 产前应激模型 参考文献方法建立产前应激模型[3]:于妊娠第15~21天,每日3次(每天10∶00、14∶00和18∶00)被限制在塑料质地的圆柱形装置内(直径7 cm,长19 cm),每次45 min。无产前应激处理的孕鼠于整个妊娠期均饲养于塑料笼内不被干扰。除应激处理外,孕鼠均不受其他打扰。
1.2.2 MCAO模型 采用右侧颈外动脉插入线栓法[4]建立MCAO模型,大鼠分别于右侧大脑中动脉缺血90 min,将栓线向外轻轻拉出,制造再灌注模型。动物清醒后具有右眼Horner征,提尾时左侧前肢屈曲内收者为研究对象,并剔除有蛛网膜下腔出血者。假手术组采用同样的手术过程,但线栓插入较浅,未造成大脑中动脉闭塞。
1.3 神经功能评分
各组大鼠分别于再灌注后24 h,参照Longa评分标准[4]进行神经功能评分。0分:无明显神经功能缺损;1分:不能完全伸直对侧前爪;2分:行走时向对侧转圈;3分:行走时向对侧倾倒;4分:不能自发行走,意识丧失。
1.4 HE染色
于再灌注24 h,各组取5只大鼠,10%水合氯醛麻醉后,4%多聚甲醛灌注内固定,断头取脑,石蜡包埋。切片行常规HE染色检测脑梗死情况,并在普通光镜下观察脑组织形态学改变。取视交叉后3 mm处切面(病变最大切面),采用NIH图像软件测量梗死面积,脑梗死严重程度以横截面上脑梗死面积占整个脑组织截面面积百分比代表[5, 6]。
1.5 细胞凋亡检测
取视交叉后3 mm处脑组织块,采用TUNEL法检测神经细胞凋亡,具体步骤按试剂盒(北京中杉金桥生物技术有限公司)说明书进行,细胞核中出现黄褐色颗粒者为TUNEL染色阳性,即为凋亡细胞。每张切片在镜下(×400)于缺血侧额顶叶皮质随机采集5个视野,采用Image Pro-plus 6.0图像分析软件计数凋亡细胞,取平均值。
1.6 Western blot检测
于再灌注24 h,各组取5只大鼠,10%水合氯醛麻醉后,低温开颅取缺血侧纹状体及周边皮质,假手术组区与手术组相对应的脑区,液氮冻存。提取总蛋白,BCA法测定蛋白浓度,10%聚丙烯酰胺凝胶电泳(SDS-PAGE)分离后,转印到硝酸纤维素膜,5%脱脂奶粉封闭后分别加入一抗:Caspase 3(Cell Signaling Technology,USA,1∶500);cleaved Caspase 3(Cell Signaling Technology,USA,1∶500);Bcl-2(Santa Cruz Inc.,1∶200);β-肌动蛋白(β-actin,北京博奥森生物制剂有限公司,1∶2 000),4℃过夜,洗涤后加入辣根过氧化酶标记的二抗孵育。ECL显影,扫描后用凝胶成像处理系统(美国SYNGENE公司)进行吸光度分析,以目的条带吸光度与β-actin条带吸光度之比表示目的蛋白的相对表达量。
1.7 统计学处理

2 结果
2.1 各组神经功能缺损评分
假手术组,产前应激+假手术组子代大鼠均为0分,无神经功能缺损;产前应激+MCAO组(2.8±0.6)和MCAO组(2.0±0.7),子代大鼠于麻醉清醒后出现不同程度神经功能缺损。与MCAO组比较,产前应激+MCAO组子代大鼠神经功能评分显著增加(P<0.05)。
2.2 脑梗死面积测定
假手术组及产前应激+假手术组均未见脑梗死灶(图1A、图1B)。HE染色后可见MCAO组梗死局限在皮质及皮质下(图1C),产前应激+MCAO组梗死相对弥散,尚累及胼胝体和尾状壳核(图1D)。产前应激+MCAO组梗死面积百分比(27.62±2.69)%明显大于MCAO组(17.28±2.07)%(P<0.05)。
2.3 脑组织HE染色
光镜下可见假手术组和产前应激+假手术组额顶叶皮质神经细胞形态正常,排列整齐(图2A、图2B);MCAO组同一部位的神经细胞排列紊乱,大部分神经细胞丧失正常细胞形态,细胞体积缩小,出现核固缩、组织疏松、细胞质淡染(图2C);产前应激+MCAO组神经细胞结构不清,排列疏松,细胞呈三角形或长条形,细胞质空泡状,核固缩,可见大量筛状空泡样结构(图2D)。
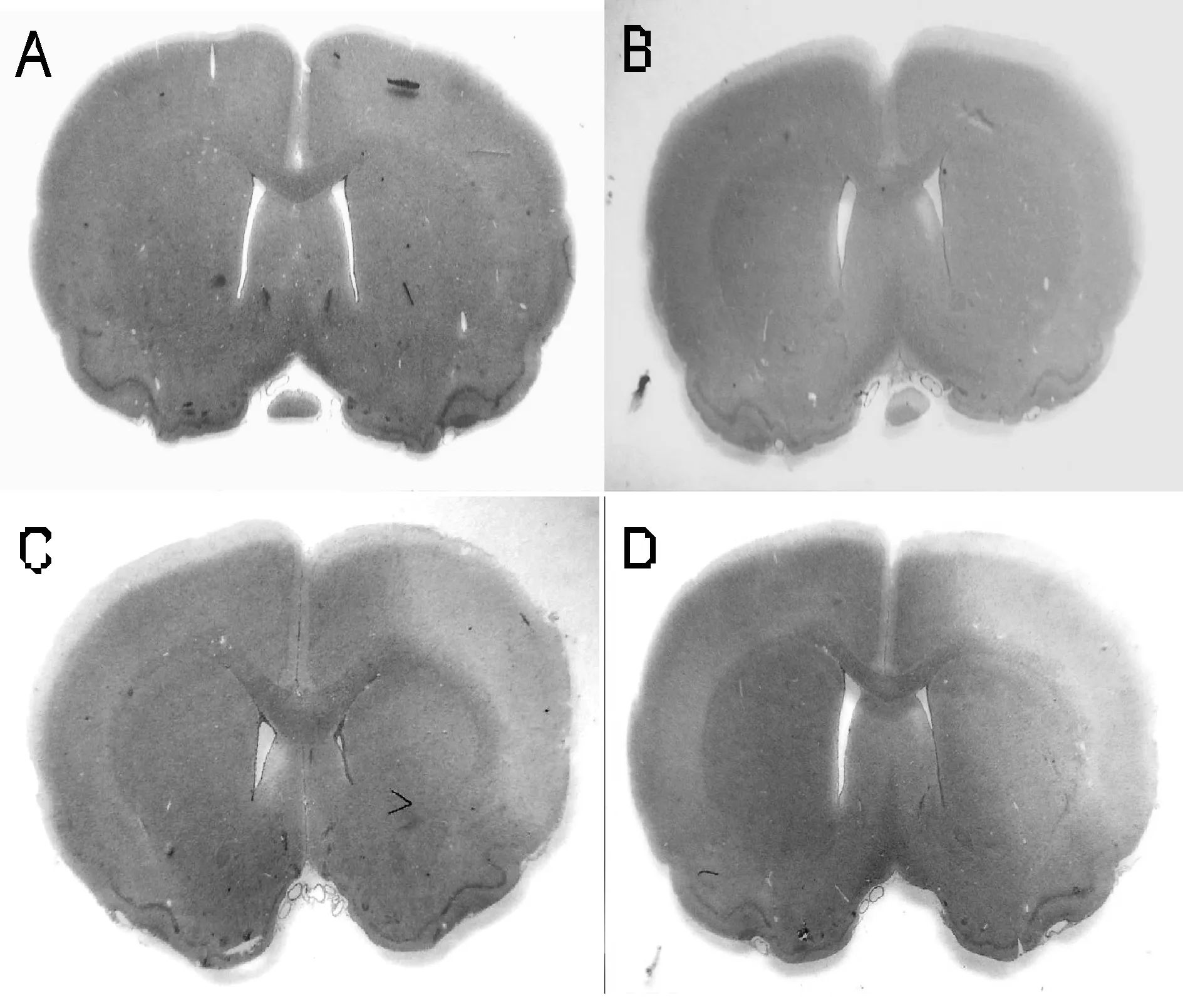
Fig. 1 Representative photographs of infarct volume after transient MCAO(HE) A: Sham group; B: Prenatal stress+sham group; C: MCAO group; D: Prenatal stress+MCAO group; MCAO: Middle cerebral artery occlusion model

Fig. 2 Representative light micrographs of HE-stained brain sections obtained from four experimental groups after transient MCAO (Scale bar= 100 μm) A: Sham group; B: Prenatal stress+sham group; C: MCAO group; D: Prenatal stress+MCAO group; MCAO: Middle cerebral artery occlusion model
2.4 神经细胞凋亡计数
光镜下假手术组和产前应激+假手术组子代大鼠皮质神经细胞几乎全为TUNEL阴性反应细胞(图3A、图3B);在MCAO组可见散在TUNEL阳性反应细胞,即凋亡细胞,核呈棕色,部分细胞体积缩小且形态不规则,核固缩深染,呈深棕色(图3C),MCAO组凋亡阳性细胞数明显高于假手术组和产前应激+假手术组(表1,P<0.01);产前应激+MCAO组TUNEL阳性细胞显著增加(图3D,表1,P<0.01)。
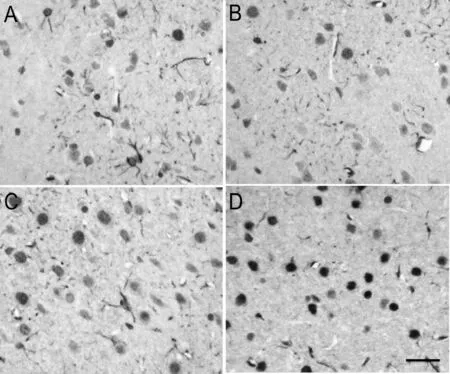
Fig. 3 Representative photomicrographs of brain sections obtained from four experimental groups after transient MCAO (TUNEL,Scale bar=100 μm) A: Sham group; B: Prenatal stress+sham group; C: MCAO group; D: Prenatal stress+MCAO group; MCAO: Middle cerebral artery occlusion model
2.5 Western blot检测Caspase 3、cleaved Caspase 3和Bcl-2蛋白表达情况
假手术组和产前应激+假手术组子代大鼠缺血侧皮质区有少量Caspase 3和cleaved Caspase 3蛋白表达,MCAO组、产前应激+MCAO组Caspase 3和cleaved Caspase 3蛋白表达增加,与假手术组和产前应激+假手术组比较差异有统计学意义(P<0.05),产前应激+MCAO组Caspase 3和cleaved Caspase 3蛋白表达也较MCAO组增加(P<0.05)。MCAO组、产前应激+MCAO组Bcl-2蛋白表达较假手术组和产前应激+假手术组减少(P<0.05);产前应激+MCAO组Bcl-2蛋白表达也较MCAO组减少 (图4,表1,P<0.05)

Fig. 4 Expression of Caspase 3, cleaved Caspase 3 and Bcl-2 in four experimental groups after transient MCAO A: Sham group; B: Prenatal stress+sham group; C: MCAO group; D: Prenatal stress+MCAO group; MCAO: Middle cerebral artery occlusion model


GroupTUNEL-positivecells(number/field)CleavedCaspase3Caspase3Bcl-2Sham4.2±1.30.15±0.050.11±0.040.69±0.06Prenatalstress+sham4.4±1.10.24±0.040.18±0.050.70±0.07MCAO15.2±2.8*#0.51±0.07*#0.29±0.05*#0.59±0.06*#Prenatalstress+MCAO23.6±2.3*#△0.80±0.10*#△0.56±0.06*#△0.50±0.05*#△
MCAO: Middle cerebral artery occlusion
*P<0.05vssham group;#P<0.05vsprenatal stress+sham group;△P<0.05vsMCAO group
3 讨论
卒中是由于脑血管的不正常而出现的突发、局灶神经功能缺损。在中国,卒中是死亡和致残的首要原因[7]。大约50%~70%卒中患者最终生活可自理,而15%~30%遗留永久性瘫痪。因此,卒中是常见且能对患者及其家庭产生严重影响的疾病,对这些病人的愈后进行预测并寻找相关影响因素具有极其重要的意义。已有研究表明,产前不良环境,如妊娠期缺氧可能使子代具有不利的卒中后神经功能恢复[8]。本实验发现产前应激+MCAO组较之MCAO组具有明显的神经功能缺损评分和更大的脑梗死面积,提示产前应激会加重子代大鼠脑缺血再灌注后的神经损伤,进一步证明围产期不良事件会产生持久反应,影响子代缺血性卒中的预后。
本实验中,产前应激+假手术组或假手术组子代大鼠均未见明显神经细胞形态学改变且仅有少量凋亡细胞,而产前应激+MCAO组和MCAO组均出现明显细胞形态改变和细胞凋亡,产前应激+MCAO组较之MCAO组更显著,这说明产前应激虽未直接引起子代大鼠神经细胞损伤,但会使神经细胞具有易损伤性,从而使子代大鼠脑缺血再灌注后的神经细胞损伤加重,并促进细胞凋亡。已有研究表明[9]细胞凋亡在脑缺血再灌注后的细胞死亡中起重要作用,因此我们推测在本实验中,细胞凋亡很可能是产前应激加重子代大鼠脑缺血再灌注损伤的主要环节。
脑缺血会引起缺血区域细胞的快速死亡。脑部缺血通过内部和外部途径引起Caspase 3活化,并裂解重要的DNA修复酶—多聚二磷酸腺苷核糖聚合酶(poly ADP-ribose polymerase,PARP),最终引起DNA片段化和细胞死亡[10]。动物和人类实验均证实了卒中后存在Caspase 3表达和效应增加,Caspase 3的活化在凋亡过程中具有重要作用[9, 11]。实验性缺血性动物模型表明消除和抑制Caspase 3可通过减小脑梗死面积和延长治疗时间窗而发挥明显的神经保护作用[12]。本研究中,我们观察到MCAO组子代大鼠大脑中动脉缺血再灌注后皮质Caspase 3和cleaved Caspase 3的表达增加,而cleaved Caspase 3是Caspase 3的活化形式,这说明缺血再灌注导致大脑局部活化Caspase 3表达增加并诱导细胞凋亡,且在产前应激+MCAO组这两个指标表达均较MCAO组明显增加,提示产前应激很可能是通过促进活化Caspase 3表达加剧细胞凋亡,从而加重脑缺血再灌注后的神经功能缺损。
与此同时,细胞可以通过启动生存途径拮抗卒中引起的凋亡。Bcl-2蛋白是重要的抗凋亡蛋白,可通过与Bax蛋白结合减少线粒体膜的通透性而抑制线粒体凋亡途径[13]。但自然启动的Bcl-2蛋白并不足以挽救缺血的脑组织和促进功能转归。研究表明通过基因转移使Bcl-2过表达可以抑制缺血半暗带凋亡并减少神经元丢失[14]。本实验中,MCAO组Bcl-2蛋白表达减少,这和既往的研究一致[15],而产前应激+MCAO组Bcl-2蛋白表达较MCAO组减少,提示产前应激可能通过减少脑缺血再灌注后凋亡抑制蛋白Bcl-2表达而促进凋亡,进而增加神经细胞损伤和梗死面积,影响神经功能恢复。
总之,产前应激对子代大鼠脑缺血再灌注后神经功能的影响与局部凋亡相关蛋白表达的改变有关,可能通过改变子代大鼠脑缺血再灌注后Caspase 3和Bcl-2蛋白表达,促进局部神经细胞凋亡,加重神经功能缺损,并可能改变子代大鼠缺血性卒中的预后。
[1] Chen F, Kan H, Hobbs G,etal. p38 MAP kinase inhibitor reverses stress-induced myocardial dysfunction in vivo [J].JApplPhysiol, 2009, 106(4): 1132-1141.
[2] Mcpherson RJ, Mascher-denen M, Juul SE. Postnatal stress produces hyperglycemia in adult rats exposed to hypoxia-ischemia [J].PediatrRes, 2009, 66(3): 278-282.
[3] Yeh CM, Huang CC, Hsu KS. Prenatal stress alters hippocampal synaptic plasticity in young rat offspring through preventing the proteolytic conversion of pro-brain-derived neurotrophic factor (BDNF) to mature BDNF [J].JPhysiol, 2012, 590(Pt4): 991-1010.
[4] Longa EZ, Weinstein PR, Carlson S,etal. Reversible middle cerebral artery occlusion without craniectomy in rats [J].Stroke, 1989, 20(1): 84-91.
[5] 管玉青, 陆兵勋. 改良神经功能检测评价实验性脑梗死病变的范围 [J]. 南方医科大学学报, 2009, 29(1): 114-117.
[6] 张 琪, 陈晓光, 杨春晓, 等. 核转录因子КB抑制剂缓解大鼠局部脑缺血后脑损伤[J]. 中华老年心脑血管病杂志, 2010, 12(8): 748-750.
[7] Wen W, Shu XO, Gao YT,etal. Environmental tobacco smoke and mortality in Chinese women who have never smoked: prospective cohort study [J].BMJ, 2006, 333(7564): 376.
[8] Wang L, Cai R, Lv G,etal. Hypoxia during pregnancy in rats leads to the changes of the cerebral white matter in adult offspring [J].BiochemBiophysResCommun, 2010, 396(2): 445-450.
[9] Zhang P, Zhang Y, Zhang J,etal. Early Exercise Protects against Cerebral Ischemic Injury through Inhibiting Neuron Apoptosis in Cortex in Rats [J].IntJMolSci, 2013, 14(3): 6074-6089.
[10]Broughton BR, Reutens DC, Sobey CG. Apoptotic mechanisms after cerebral ischemia [J].Stroke, 2009, 40(5): e331-339.
[11]Rami A, Sims J, Botez G,etal. Spatial resolution of phospholipid scramblase 1 (PLSCR1), caspase-3 activation and DNA-fragmentation in the human hippocampus after cerebral ischemia [J].NeurochemInt, 2003, 43(1): 79-87.
[12]Le DA, Wu Y, Huang Z,etal. Caspase activation and neuroprotection in caspase-3- deficient mice after in vivo cerebral ischemia and in vitro oxygen glucose deprivation [J].ProcNatlAcadSciUSA, 2002, 99(23): 15188-15193.
[13]Adams JM, Cory S. Life-or-death decisions by the Bcl-2 protein family [J].TrendsBiochemSci, 2001, 26(1): 61-66.
[14]Zhao H, Yenari MA, Cheng D,etal. Bcl-2 overexpression protects against neuron loss within the ischemic margin following experimental stroke and inhibits cytochrome c translocation and caspase-3 activity [J].JNeurochem, 2003, 85(4): 1026-1036.
[15]Li Z, Pang L, Fang F,etal. Resveratrol attenuates brain damage in a rat model of focal cerebral ischemia via up-regulation of hippocampal Bcl-2 [J].BrainRes, 2012,1450: 116-124.
The effects of prenatal stress on the cell apoptosis after MCAO in adult offspring rats
WANG Ling-xing, HUANG Hong-hong△, CHEN Ya-fang, CAI Hong-chao, QIAN Jia-qiang
(Department of Neurology, the Second Affiliated Hospital of Fujian Medical University, Quanzhou 362000, China)
Objective: To evaluate the effects of prenatal stress on neurological functions after middle cerebral artery occlusion (MCAO) in adult offspring rats. Methods: Pregnant rats were randomly assigned to prenatal stress treatment, which was exposed to restraint three times daily in the last week of pregnancy, and no prenatal stress treatment. Adult male offspring rats were subjected to transient focal cerebral ischemia by MCAO. They were randomly divided into four groups: sham group, prenatal stress + sham group, MCAO group and prenatal stress + MCAO group (n=10). After 24 hours of reperfusion, the neurological deficits were evaluated. The infarct size, cell apoptosis and expression of Caspase 3, cleaved Caspase 3 and Bcl-2 were detected. Results: Compared with MCAO group, the neurological deficits, infarct size and apoptotic cells in prenatal stress + MCAO group were increased significantly (allP<0.05). The expressions of Caspase 3 and cleaved Caspase 3 were much greater in prenatal stress + MCAO group than those of MCAO group, while the expression of Bcl-2 was significantly decreased in prenatal stress + MCAO group compared with MCAO group (allP<0.05). Conclusion: Prenatal stress might exacerbate neurological deficits in the offspring rats after MCAO by increasing cell apoptosis.
prenatal stress; offspring rat; cerebral ischemia; apoptosis
福建省自然科学基金项目(2015J01449);省教育厅项目(JB13067);泉州市技术研究与开发项目(2012Z35);福建医科大学附属第二医院苗圃基金资助(2012MP65)
2014-12-22 【修回日期】2015-06-10
R73-3
A
1000-6834(2015)05-427-05
10.13459/j.cnki.cjap.2015.05.012
△【通讯作者】Tel: 13600766682; E-mail: minghuaxin@139.com

