尖吻蝮蛇毒抑瘤组分Ⅰ对血管内皮细胞迁移活性的影响*
李 曙, 金 鑫, 龙雪峰, 贾金礼, 张根葆, 洪 云
(1. 皖南医学院病理生理学教研室, 2. 药理学教研室, 3. 临床医学院, 4. 弋矶山医院超声医学科, 安徽 芜湖 241002)
尖吻蝮蛇毒抑瘤组分Ⅰ对血管内皮细胞迁移活性的影响*
李 曙1, 金 鑫2, 龙雪峰3, 贾金礼1, 张根葆1, 洪 云4△
(1. 皖南医学院病理生理学教研室, 2. 药理学教研室, 3. 临床医学院, 4. 弋矶山医院超声医学科, 安徽 芜湖 241002)
目的:观察尖吻蝮蛇毒抑瘤组分Ⅰ(AAVC-Ⅰ) 对人脐静脉内皮细胞(HUVECs)迁移活性的影响,探讨AAVC-Ⅰ抑制血管生成的可能机制。方法:体外培养HUVECs,分别用AAVC-Ⅰ(0、20、40、80 μg/ml)处理细胞后再孵育24 h。划痕实验和趋化小室实验观察AAVC-Ⅰ对内皮细胞迁移活性的影响;采用RT-PCR、Western blot法检测药物作用前后P选择素(P-selectin)和细胞间粘附因子(ICAM-1)mRNA和蛋白水平的变化。结果:与正常组HUVECs比较,AAVC-Ⅰ各浓度组细胞迁移能力都有不同程度降低,P-selectin和ICAM-1 mRNA表达均明显下降。结论:AAVC-Ⅰ可能通过下调P-selectin和ICAM-1 mRNA和蛋白水平抑制内皮细胞迁移活性。
蝮蛇毒抑瘤组分; 人脐静脉内皮细胞; 迁移
血管内皮细胞是血管内壁形成的重要组成部分,其迁移活性影响血管的生成[1],而血管生成在生理和病理活动中发挥重要的作用,尤其在肿瘤的发生发展中至关重要[2,3]。因此抑制血管内皮细胞迁移生成血管是治疗肿瘤的重要靶点,已成为寻找抗癌药的重要方向。
蛇毒是含有多种生物活性蛋白的混合物,研究证明蛇毒具有广泛的生物学活性。目前已经从蛇粗毒中成功的分离出多种酶类和肽类物质,这些物质被证实除了具有抗栓、止血、镇痛作用外,还具有抗肿瘤的作用[4]。近年已有报道,一种名为Salmosin的蝮蛇毒抑瘤成分主要通过干扰内皮细胞粘附过程
阻止血管生成起到抗瘤作用[5]。以往本课题组以尖吻蝮蛇蛇毒为对象,提取、分离和纯化出蛇毒抑瘤活性物质 (component I from agkistrodon acutus venom,AAVC-Ⅰ)[6],具有明显地抑制肿瘤细胞增殖活性[7,8]。为了深入了解该蛇毒组分抗肿瘤增殖的可能特性,本实验以人血管内皮细胞(human umbilical vein endothelial cells, HUVECs)为靶细胞,观察AAVC-Ⅰ对内皮细胞迁移的作用,及其抑制内皮细胞生成血管的可能机制。
1 材料与方法
1.1 材料
HUVECs(上海吉凯基因化学技术有限公司),AAVC-Ⅰ(皖南医学院蛇毒研究所,纯度99%),细胞培养基DMEM、胎牛血清(Hyclone公司),0.25%EDTA胰酶(碧云天生物技术),Transwell小室(Corning公司),鼠抗 GAPDH抗体、兔抗P-selectin抗体、兔抗ICAM-1抗体(BOSTER生物公司),HRP标记羊抗兔IgG/ HRP标记羊抗鼠IgG(ZSGB生物公司)。
1.2 方法
1.2.1 细胞培养 将原代培养的HUVECs接种于25 cm2的培养瓶内,37℃、5% CO2培养箱内培养。弃去培养基,当生长至90%融合时,PBS冲洗3次,加入0.25%胰蛋白酶消化传代,2~5代生长良好的细胞用于后续实验。
1.2.2 划痕实验 将1 ml的细胞悬液接种于12孔细胞培养板中,使每孔含有2.8×105cells,37℃、5% CO2培养箱内培养24 h,用枪头在铺满细胞的孔板上划痕。水平和垂直的划十字形,去除划痕导致脱落的细胞,显微镜下拍照,测量划痕宽度,随机分为四组:空白组,不加任何处理因素;AAVC-Ⅰ低浓度组(20 μg/ml);AAVC-Ⅰ中浓度组(40 μg/ml);AAVC-Ⅰ高浓度组(80 μg/ml)组;放入培养箱培养24 h,取出拍照。计算细胞划痕愈合率,划痕愈合率=(0 h划痕面积-24 h划痕面积)/0 h划痕面积×100%[9]。
1.2.3 Transwell小室实验 每孔上室(即BD小室中)加入2×104cells,用300 μl无血清培养液重悬,下室(即24孔板中)加入680 μl含血清培养液,在37℃培养箱中孵育36 h,用棉签擦掉上层小室内HUVEC,将小室放入,固定液,室温固定 15 min之后,用 0.1%结晶紫染色 20 min,用 PBS 洗4次,晾干,显微镜下拍照、计数。按照公式计算加药对细胞侵袭的抑制率:抑制率%=(空白组-给药组) /空白组×100%[10]。
1.2.4 PCR检测P-selectin和ICAM-1 mRNA的表达Trizol一步法提取总RNA,逆转录为cDNA,以cDNA作为模板,进行PCR扩增,采用凝胶分析系统分析,条带强度用积分光密度值(IOD)表示(积分光密度=平均光密度×发光面积)。GAPDH引物上下游:5-CCACTAGGCGCTCACTGTTC-3,5-ATGGAATTTGCCATGGGTGGA-3;ICAM-1引物上下游:5-CAACCTCAGCCTCGCTATGG-3,5-AACAACTTGGGCTGGTCA CA-3;p-selectin引物上下游:5-ACATCAAGAGTCCGTCAGCC-3,5-CAGAAGCCAAGCATTCCAGC-3
1.2.5 Western印迹检测法检测P-selectin和ICAM-1 蛋白的表达 细胞培养、分组,24 h后,各组均采用一步提取法提取总蛋白,-80℃冰箱保存,SDS-PAGE电泳(10%)。NC膜放入封闭缓冲液室温封闭1 h;孵育一抗,4℃过夜;孵育二抗,37℃×1 h;最后用PBS漂洗3次,每次5 min;采用ECL化学发光法显色,拍照、显影。自动图像分析仪对蛋白条带扫描、分析。
2 结果
2.1 划痕实验结果
HUVECs培养、划痕后,与空白组比较,实验组分别用20、40和80 μg/ml AAVC-Ⅰ培养24 h,爬行速度降低,迁移距离明显缩短,划痕愈合率低于空白组(P<0.05,图1,见彩图页Ⅰ),且浓度越高,抑制效果越明显。
Tab. 1 Migratory ability of HUVECS after treated by AAVC-Ⅰobserved by scratch assay

GroupMigratoryability(%)Blank82.6±6.53AAVC-I20μg/ml55.4±6.18*AAVC-I40μg/ml41.5±4.39**AAVC-I80μg/ml29.7±2.18**
AAVC-I:Component I from agkistrodon acutus venom; HUVECs: Human umbilical vein endothelial cells
*P<0.05,**P<0.01vsblank group
2.2 内皮细胞侵袭能力的变化
通过对Transwell小室侵袭实验结果的观察,AAVC-Ⅰ处理后穿过人工基底膜的HUVECs比未经处理的细胞少,差异具有统计学意义(P<0.05,P<0.01,表2,图2,见彩图页Ⅰ)。可见AAVC-Ⅰ对HUVECs细胞体外的侵袭力具有抑制作用。
Tab. 2 Image of HUVECS invasion after treated by AAVC-Ⅰ

GroupInhibilityrateofinvasive(%)Blank 100AAVC-I20μg/ml72.3±8.31*AAVC-I40μg/ml57.4±6.59**AAVC-I80μg/ml48.8±6.02**
AAVC-I: Component I from Agkistrodon acutus venom; HUVECs: Human umbilical vein endothelial cells
*P<0.05,**P<0.01vsblank group
2.3 AAVC-Ⅰ对人脐静脉HUVECs细胞P-selectin和ICAM mRNA表达水平的影响
通过对RT-PCR检测结果分析,与空白组比较,AAVC-Ⅰ各浓度组内皮细胞中P-selectin和ICAM-1 mRNA表达水平均有不同程度的下降,差异都具有统计学意义(P<0.05,P<0.01,表3)。
2.4 AAVC-Ⅰ对人脐静脉HUVECs细胞P-selectin和ICAM-1蛋白表达水平的影响
通过Western blot检测结果分析,与空白组比较,AAVC-Ⅰ各浓度组内皮细胞中P-selectin和ICAM-1蛋白表达水平均有不同程度的下降,差异具有统计学意义(P<0.05,P<0.01,表4)。
Tab. 3 Expression of P-selectin and ICAM-1 mRNA in HUVECS in all groups
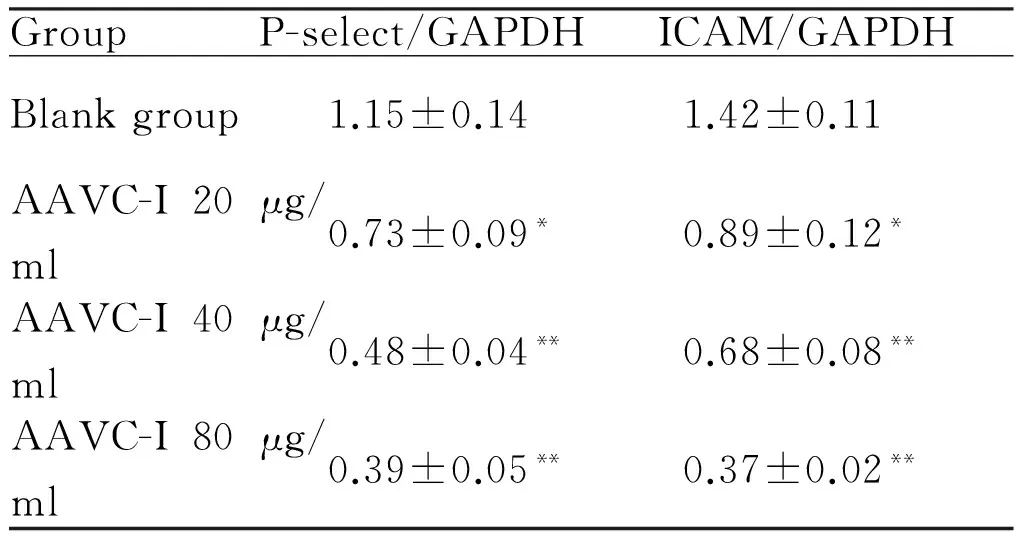
GroupP-select/GAPDHICAM/GAPDHBlankgroup1.15±0.141.42±0.11AAVC-I20μg/ml0.73±0.09*0.89±0.12*AAVC-I40μg/ml0.48±0.04**0.68±0.08**AAVC-I80μg/ml0.39±0.05**0.37±0.02**
AAVC-1: Component I from agkistrodon acutus venom; HUVECs: Human umbilical vein endothelial cells
*P<0.05,**P<0.01vsblank group
Tab. 4 Protein expression of P-selectin and ICAM-1 in HUVECs in all groups

GroupP-select/GAPDHICAM/GAPDHBlankgroup0.86±0.060.82±0.04AAVC-I20μg/ml0.59±0.07*0.76±0.06AAVC-I40μg/ml0.27±0.02**0.48±0.03**AAVC-I80μg/ml0.19±0.03**0.35±0.03**
AAVC-1: Component I from agkistrodon acutus venom; HUVECs: Human umbilical vein endothelial cells
*P<0.05,**P<0.01vsblank group
3 讨论
内皮细胞迁移活性在多种生理活动中起着重要的作用,研究发现内皮细胞迁移是毛细血管和微静脉的新毛细血管性血管生成的关键[11],同时内皮细胞增殖及迁移活性失调可直接影响心血管疾病[12,13]和肿瘤[2,3]发生发展,尤其以肿瘤最为突出。其生长过程需要持续的血管生成来为其输送血液及提供营养物质,因而内皮细胞迁移活性异常,导致新生血管加快,最终有利于心血管疾病和肿瘤的发生、发展[14,15]。选择素家族是一类异亲型结合Ca2+依赖的细胞粘着分子,能与特异糖基识别并结合,P-选择素是粘附分子选择素家族的重要成员,分布在血管内皮、血小板上,主要参与介导白细胞与内皮细胞的起始粘附,在内皮细胞迁移活性中起着重要的作用。Morbidelli等[16]证明P-选择素能促进内皮细胞迁移。ICAM-1属于免疫球蛋白超家族,其分布很广[17],在肿瘤转移和侵袭中起着重要作用[18],且在血管内皮细胞上的表达最强。内皮细胞中ICAM-1的表达增强,促进白细胞与内皮细胞之间的黏附和内皮细胞的迁移,最终诱导血管生成。
因此了解内皮细胞功能与脏器损伤的关系, 使人们能更好掌握某些疾病发生发展。近年来也开发出多种以内皮细胞为靶点的血管生成抑制剂,并在临床肿瘤治疗中取得较好疗效。蛇毒是一类天然混合毒素,含有许多活性成分,已有报道在蝮蛇毒、蝰蛇毒中含有抗血管生成活性物质,最近Kim DS等[19-21]从蝮蛇中提取的名为Salmosin的抑瘤成分能够在体外抑制血小板聚集和肿瘤的生长、转移,且发现与抗肿瘤内血管生成有一定关系;同时通过对该成分调节金属蛋白酶-9和金属蛋白酶组织抑制因子-1的转录表达进行研究,对其抗肿瘤侵袭转移机制进行初步实验研究。这些都表明蛇毒中的活性成分是开发靶向抗肿瘤药物的重要生物资源。本课题组前期从皖南尖吻蝮蛇中纯化的AAVC-Ⅰ抑瘤成分可以在体外明显抑制ADP诱导的血小板聚集、肿瘤生长[6,22]。同时实验结果表明,AAVC-Ⅰ能够有效的抑制肿瘤(K562/A549)细胞的增殖,药物浓度和作用时间呈依赖关系。但该成分能否靶向作用于内皮细胞抑制血管生成,抑肿瘤细胞的增殖值得进一步探讨。
本实验以HUVECs细胞作为靶细胞,通过划痕实验和Transwell小室侵袭实验研究发现,HUVEC细胞具有较强的迁移活性,AAVC-Ⅰ可降低HUVEC细胞迁移活性,并具有浓度依赖性。并且RT-PCR和Western blot实验证明AAVC-Ⅰ可能通过降低P-selectin 和ICAM-1 mRNA和蛋白表达水平抑制内皮细胞迁移活性及血管生成,从而抑制肿瘤的发生发展。这些结果一定程度上提示了该抗瘤组分对肿瘤细胞生物学特性具有一定的影响。
[1] Pasyk KA, Jakobczak BA. Vascular endothelium: recent advances[J].EurJDermatol, 2004, 14(4): 209-213.
[2] Bertelsen LB, Hagensen M, Busk M,etal. In vivo bio-distribution and homing of endothelial outgrowth cells in a tumour model[J].NuclMedBiol, 2014, 41(10): 848-855.
[3] Cabebe E, Wakelee H. Role of anti-angiogenesis agents in treating NSCLC: focus on bevacizumab and VEGFR tyrosine kinase inhibitors[J].CurrTreatOptionsOncol, 2007, 8(1): 15.
[4] Vyas V K, Brahmbhatt K, Bhatt H,etal. Therapeutic potential of snake venom in cancer therapy: current perspectives[J].AsianPacJTropBiomed, 2013, 3(2): 156-162.
[5] Kang IC, Lee YD, Kim DS. A novel disintegrin salmosin inhibits tumor angiogenesis[J].CancerRes, 1999, 59(15): 3754-3760.
[6] 张根葆, 张 毅, 孔 岩, 等. 五步蛇毒蛋白 C 激活剂的纯化与活性分析[J]. 蛇志, 2008, 16(4): 249-251.
[7] Conlon JM, Prajeep M, Mechkarska M,etal. Peptides with in vitro anti-tumor activity from the venom of the Eastern green mamba. Dendroaspis angusticeps (Elapidae) [J].JVenomRese, 2014, 5: 16-21.
[8] Park MH, Son DJ, Kwak DH,etal. Snake venom toxin inhibits cell growth through induction of apoptosis in neuroblastoma cells[J].ArchPharmRes, 2009, 32(11): 1545-1554.
[9] Liang CC, Park AY, Guan JL In vitro scratch assay: a convenient and inexpensive method for analysis of cell migration in vitro[J].NatProtoc, 2007, 2(2): 329-333.
[10]Sato Y,Rifkin DB.Autocrine activities of basic fibroblast growth factor:regulation of endothelial cell movement,plas-minogen activator synthesis,and DNA synthesis[J].JCellBiol, 1988, 107(3): 1199-1205.
[11]Ann Hoeben, Bart Landuyt, Martin,etal. Vascular endothelial growth factor and angiogenesis[J].PharmacolRev, 2004, 56(4): 549-580.
[12]Coppens V, Heremans Y, Leuckx G,etal. Human blood outgrowth endothelial cells improve islet survival and function when co-transplanted in a mouse model of diabetes[J].Diabetologia, 2013, 56(2): 382-390.
[13]Ruan C, Shen Y, Chen R,etal. Endothelial progenitor cells and atherosclerosis[J].FrontBiosci(LandmarkEd), 2013, 18: 1194-1201.
[14]Lutsenko S V, Kiselev S M, Severin S E. Molecular mechanisms of tumor angiogenesis[J].Biochemistry(Mosc), 2003, 68(3): 286-300.
[15]郭建友, 霍海如, 姜廷良. 内皮细胞功能及其异质性研究的进展[J]. 中国临床药理学, 2006, 10(10): 1081-1085.
[16]Morbidelli L, Brogelli L, Granger H J,etal. Endothelial cell migration is induced by soluble P-selectin[J].LifeSci, 1998, 62(1): PL7-11.
[17]Pietruczuk M, Pietruczuk A, Pancewicz S,etal. ICAM-1: structure, biological role and clinical significance[J].PolMerkurLekarski, 2004, 17(101): 507-511.
[18]Arteta B, Lasuen N, Lopategi A,etal. Colon carcinoma cell interaction with liver sinusoidal endothelium inhibits organ-specific antitumor immunity through interleukin-1-induced mannose receptor in mice[J].Hepatol, 2010, 51(6): 2172-2182.
[19]Kim JT, Lee DH, Chung KH,etal. Inhibitory effects of salmosin, a disintegrin, on posterior capsular opacification in vitro and in vivo[J].ExpEyeRes, 2002, 74(5): 585-594.
[20]Kim SI, Kim KS, Kim HS,etal. Inhibitory effect of the salmosin gene transferred by cationic liposomes on the progression of B16BL6 tumors[J].CancerRes, 2003, 63(19): 6458-6462.
[21]Kim DS, Jeon OH, Lee HD,etal. Integrin alphavbeta3-mediated transcriptional regulation of TIMP-1 in a human ovarian cancer cell line[J].BiochemBiophysResCommun, 2008, 377(2): 479-483.
[22]周 兵, 张根葆, 段 婷, 等. 尖吻蝮蛇毒抑瘤组分Ⅰ通过促进半胱天冬酶3表达诱导K562/A02 细胞凋亡[J]. 中国实验血液学杂志, 2012, 20(2): 273-276.
Effect of AAVC-I on the migration of human umbilical vein endothelial cells
LI Shu1, JIN Xin2, LONG Xue-feng3, JIA Jin-li1, ZHANG Gen-bao1, HONG Yun4△
(1. Department of Pathophysiology, 2. Department of Pharmacology, 3. Department of Clinical Medicine, 4. Department of Ultrasonography, Yijishan Hospital, Wannan Medical College, Wuhu 241002, China)
Objective: To investigate the effect of component I from agkistrodon acutus venomon (AAVC-I) the migration of human umbilical vein endothelial cells (HUVECs), and to elucidate the possible anti-angiogenic mechanism of AAVC-I . Methods: The effect of AAVC-I on the migration of HUVECs which was cultivated in vitro and treated with AAVC-1 at four concentrations: 0、20、40、80 μg/ml, was observed by methods of scratch wound-healing and Transwell assay. The expression level of mRNA and protein of P-selectin and intercellular cell adhension molecule-Ⅰ(ICAM-1) were examined by RT-PCR and Western blot assay. Results: Compared with the blank group, the migration ability of HUVECs in each AAVE-I treated group was reduced in a dose-dependent manner, and the expression level of the mRNA and protein of P-selectin and ICAM-1 were decreased. Conclusion: AAVC-I inhibits the migration of endothelial cell, which is acted by down-regulation of the expression content of mRNA and protein of P-selectin and ICAM-1.
component I from agkistrodon acutus venomon; human umbilical vein endothelial; migration
校重点科研基金项目(wk2014ZF06);安徽省自然科学基金项目(1408085QH169);省大学生创新训练计划(AH20 1410368138)
2014-01-05 【修回日期】2015-02-25
R73-3
A
1000-6834(2015)05-407-04
10.13459/j.cnki.cjap.2015.05.007
△【通讯作者】Tel: 0553-3932476; E-mail: yxx2003@126.com

