IQQA(R)-Liver系统在超声引导腹腔镜辅助下肝肿瘤射频消融术中的应用
龚昭 夏辉 周程 曾志武 杨光耀
IQQA(R)-Liver系统在超声引导腹腔镜辅助下肝肿瘤射频消融术中的应用
龚昭 夏辉 周程 曾志武 杨光耀
目的 回顾分析IQQA(R)-Liver系统在超声引导腹腔镜辅助下肝肿瘤射频消融术中的应用体会。 方法 回顾性分析2013年1月至12月期间完成的59例超声引导腹腔镜辅助下肝肿瘤射频消融术病人的临床资料,术前均经IQQA(R)-Liver影像解读分析系统进行三维定量分析,根据每个瘤体进行模拟RFA穿刺点、进针角度、进针路径以及进针深度,同时模拟消融热场范围,计算全肝体积、预估毁损体积和残余功能肝体积并进行对比,综合评价IQQA(R)-Liver系统在RFA术前治疗方案规划及并发症预防中的指导作用。结果 59例病人经IQQA(R)-Liver影像解读分析系统重建,得到了清晰的肝脏、肿瘤和肝内脉管系统的三维图像,并按模拟设计方案完成RFA术,术后59例病人均出现血清转氨酶升高,术后第1天达最高水平,血清天冬氨酸转氨酶(AST)及丙氨酸转氨酶(ALT)水平分别为(181±62.9) U/L及(265±53.1) U/L,于术后1周内恢复正常范围。其中23例有发热症状,最高39.3 ℃,术后1周均恢复正常。术后均未出现大出血、胆漏、胃肠道烧灼、穿孔、膈肌损伤、肝性脑病、肝衰竭等并发症。术后第3天CDFI及CEUS评估所有瘤体首次完全消融率达到89.04%,术后1个月复查CTA所有病灶二次完全消融率达到100%,随访3~12个月无局部原位复发。术后第3天Child-Pugh评分有5例病人出现降级,其中3例病人由A级降至B级,2例病人由B降至C级。术后1个月对比预估RFA体积与实际RFA体积差异无统计学意义(P=0.99)。结论 IQQA(R)-Liver系统对肝脏肿瘤病人进行有效、精确、个体化的术前评估,对所有治疗方案的制定具有良好的指导意义。
IQQA(R)-Liver系统;三维重建;超声引导;腹腔镜;肝肿瘤;射频消融术
随着精准肝脏手术理念[1]的提出,基于肝脏计算机体层摄影血管造影术(computed tomography angiography,CTA)进行的三维重建技术IQQA(R)-Liver系统目前已广泛应用于临床肝脏手术术前规划及肝脏储备功能的评估。IQQA(R)-Liver系统能从三维结构上任意角度地显示肝内管道系统的走行、肿瘤位置及其与周围血管的毗邻关系,据此手术者可以制订最适宜的消融治疗路径及方案,提高消融治疗的安全性和精确性,为精准手术治疗提供明确的指导意义。IQQA系统辅助应用于肝脏手术治疗已有较多的报道,但对于辅助射频治疗仍鲜有报道。现将IQQA(R)-Liver系统在本院肝脏肿瘤射频消融(radio frequency ablation,RFA)治疗过程中的应用经验阐述如下。
资料与方法
一、一般资料
2013年1~12月,在我院肝胆外科临床诊断为肝脏肿瘤中共有59例病人行腹腔镜辅助下RFA术,具体情况见表1。
包括原发性肝癌不适宜手术者27例(31个病灶)、肝转移癌32例(42个病灶),所有病灶均行超声引导腹腔镜辅助下RFA治疗。肿瘤直径约为1.5~6.1 cm,平均(3.4±1.3)cm;男性31例,女性28例;年龄40~87岁,平均(63.9±15.9)岁;肝功能Child-Pugh分级A级42例,B级17例,C级0例;其中14例(23.7% )为原发肝癌手术切除后复发。
二、方法
完善血常规、肝功能、凝血功能、肿瘤标记物、肝炎病毒载量测定、肝脏CT增强检查,其余按术前常规检查进行准备。
IQQA(R)-Liver系统应用与手术规划,利用IQQA(R)-Liver系统在CTA基础上行三维重建,将病人的CT肝脏多期扫描图导入美国 EDDA 公司所产IQQA(R)-Liver系统中进行研究,使用三维可视化工具依次对肝脏肿瘤及肝脏的体积、门静脉、肝静脉、肝动脉进行二维描记与三维重建,分析肿瘤、血管、肝叶的三维关系,并通过手动分割、标注工具等对其进行标记。依据重建后的肝静脉及门静脉系统对肝脏进行肝段分割。系统自动提取肝实质、病灶、肝动脉、门静脉、肝静脉部分图像信息,重建肝实质、病灶及肝内各管道空间结构,同时对肝脏透明化处理以清晰显示肝脏肿瘤的位置、大小以及与邻近血管的位置关系。
据重建的三维立体影像进行以下操作:① 对所有拟行RFA的病例进行评估筛选,将距离门静脉和肝静脉主干及其主要分支≤1.0 cm的肿瘤剔除RFA的治疗范围。② 结节MPR分析:IQQA系统中对病灶进行MR分析,叠加肋骨影像后,根据病灶的位置、三维形态、肋间隙分布、软件模拟选择穿刺最佳进针点、进针角度、进针路径以及进针深度。③ 根据射频电极理论消融范围(单针电极消融直径2.0 cm,集束电极消融直径3.0 cm),在保证射频范围覆盖病灶边缘至少大于0.5~1 cm治疗原则前提下,结合肋间隙与邻近血管的空间位置分布选择合适的布针方案。
术前应用IQQA(R)-Liver系统计算肿瘤体积、预消融体积及所占全肝体积的百分比。
三、手术方案
首先完成术前三维重建及RFA手术规划,明确肝脏病灶情况(位置、毗邻),设计RFA穿刺最佳进针点、进针角度、进针路径、进针深度及穿刺次数,并模拟三维立体肿瘤损毁区,保证肿瘤周边至少5 mm肝组织安全灭活(图1、2)。本研究使用美国RADIONICS公司生产的冷循环超能射频肿瘤治疗系统(Cool-tip RF System),采用射频脉冲发送方式,输出功率150~200 W,每次治疗肿瘤针消时间为12 min,病灶部位温度60~90 ℃。
采用静脉及吸入复合全身麻醉。麻醉后,在经皮超声实时引导下按照术前IQQA系统辅助制定的RF消融治疗方案将射频针穿入肝脏,达到既定肿瘤消融点后,逐渐增大消融功率,消融温度缓慢增加,术中B超动态观察消融情况,每次射频时间为12 min,消融结束后退针,进行针道消融,减少术后出血和针道种植。部分肿瘤较大者按术前模拟进行集束针多点穿刺复合消融,以达到完全的消融效果(图3)。消融完成后,彩色多普勒超声再次扫查肿瘤,观察肿瘤区域有无血流信号,进一步确定肿瘤是否完全消融(术中超声可见病灶回声增高,达到以覆盖肿瘤及周围5~10 mm的肝组织为良好治疗效果)。
完成RFA治疗后,在脐上缘切口置入10 mm穿刺器,维持CO2的气腹压通常不超过10 mmHg,腹腔镜下直视观察肝脏表面穿刺点是否存在活动性出血或胆漏情况、是否存在邻近脏器热损伤,对于浅表肿瘤可直视下评估其消融范围及效果。检查明确无明显肝脏表面穿刺点活动性出血及胆漏后,撤气腹,缝闭戳孔,结束手术。
四、术后处理
术后3 d予以彩色多普勒超声(Color doppler flow imaging, CDFI)及超声造影(Ultrasonic contrast, CEUS)检查局部消融效果。CEUS完全灭活:病灶完全呈低回声区;病灶不完全灭活或残留:病灶内部或周边部分可出现增强。CDFI完全灭活:未探及彩色血流信号;病灶不完全灭活或残留:病灶内部或周边可探及少量彩色血流信号。未完全消融者评估肝功能后可再次行RFA治疗。
术后1个月复查肝脏CTA,应用IQQA(R)-Liver系统重建肿瘤消融后立体结构,并计算肿瘤实际消融体积及其所占全肝体积的百分比。
五、数据处理

结 果
一、一般情况
本组59例病人共73个癌肿病灶均完成RFA治疗。单病灶RFA平均时间为23 min,平均总手术时间为55 min。所有病例术前病理诊断或临床诊断均为肝恶性肿瘤(原位癌或转移癌)。
23例病人有不同程度发热,其中6例超过39 ℃,11例发热时间超过3 d,均于术后1周内恢复正常。59例病人术后均出现血清转氨酶升高,术后第1天达最高水平,血清天冬氨酸转氨酶(AST)及丙氨酸转氨酶(ALT)水平分别为(181±62.9) U/L及(265±53.1) U/L,于术后1周内逐渐恢复正常范围。术后均未出现大出血、胆漏、胃肠道烧灼、穿孔、膈肌损伤、肝性脑病、肝衰竭等并发症。住院时间3~9 d,平均6.26 d。
二、消融率评价
术后3 d CDFI及CEUS检查,9个病灶显示不完全消融,平均直径为4.83 cm。余64病灶均完全消融。单次消融成功率达到89.04%。 对未完全消融者进行二次RFA治疗,CEUS及CDFI显示消融完全。(表1)

表1 术后病灶完全消融情况[病灶个数(%)]
术后1个月所有病人CTA扫描见RFA治疗区呈低密度影,局部未见强化,延迟后未见填充,病灶完全坏死率达100%(图4)。随访3~12个月,无一例发生消融部位原位复发,6例发现肝内远处新发病灶。
三、肝功能评估及容积评估
术后第3天,对所有病人进行Child-Pugh评分, A级39例,B级18例,C级2例,其中3例病人评分由A降至B,2例病人由B降至C级。所有病人均无明显肝性脑病和肝衰竭发生(包括2例降为C级者)。
术后肝脏体积(1056.1±105.7) cm3,肿瘤体积(191.9±72.0) cm3,所占百分比为17.7%,预RFA体积(255.6±77.5) cm3,所占百分比为23.8%;实际RFA体积(265.1±80.2) cm3,所占百分比为25.1%,术后实际RFA体积与术前预估RFA体积对比,P=0.99,差异无统计学意义。
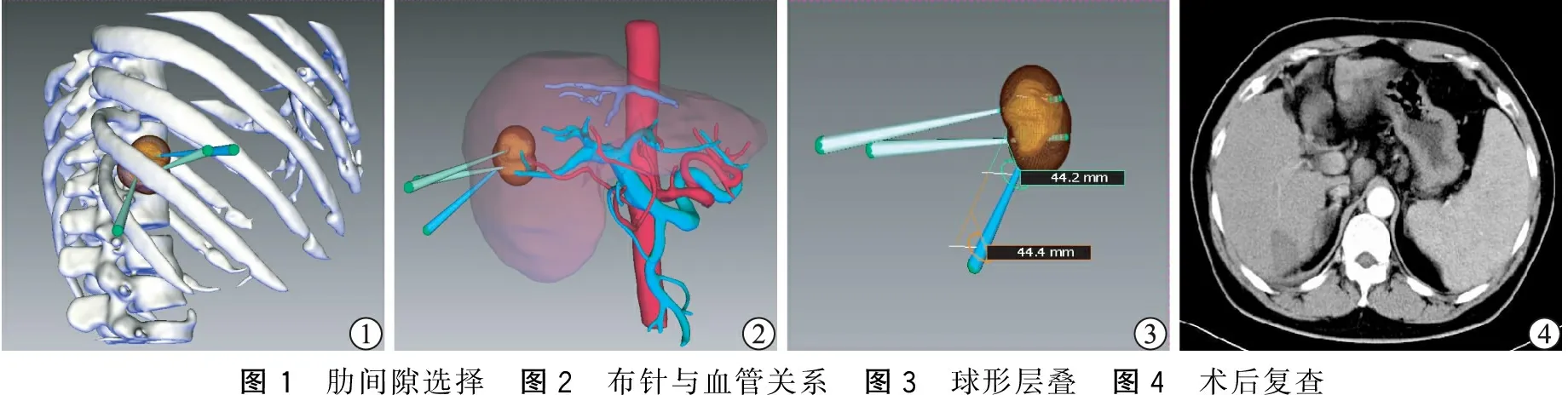
图1 肋间隙选择 图2 布针与血管关系 图3 球形层叠 图4 术后复查
讨 论
随着计算机技术的快速发展,肝脏外科逐渐由传统经验外科模式向现代精准外科模式转变。基于数字外科平台的肝脏三维定量分析及模拟手术设计系统则是实现肝脏精准手术操作的基础。大量的临床实践[2-4]证明,IQQA(R)-Liver三维定量分析及模拟手术设计系统可进行客观的术前手术治疗规划,辅助肝脏病灶的精准切除,最大程度地保留功能性肝体积的同时实现创伤最小化。但将上述模拟系统用于规划指导肝脏射频消融的报道并非多见。
胆汁瘤主要是RF术中损伤胆管所致,一般发生概率为0.05~8%[5]。研究[6]表明若消融距胆管小于3 mm,会导致胆管损毁严重而产生并发症。而当射频针距离胆管5~10 mm时,则安全性较高[7]。现普遍认为[8]紧邻大血管的病灶因“热沉积效应”不适合射频治疗。而且,消融该类型的病灶还存在电极针的直接穿刺和热效应的间接传递相关的血管损伤风险。借用IQQA(R)-Liver系统的三维重建功能,能精确判断病灶与重要血管、胆管的距离,指导术前合理的甄选RFA适应病例,本研究中所有59例经该系统评估入选RFA适应证的病人均未发生胆道狭窄、胆漏及胆汁瘤、大血管损伤或术后出血表现。
有研究显示,对直径≤3 cm的肿瘤RFA疗效等同于手术切除,但是直径3~5 cm甚至>5 cm的肝脏肿瘤RFA治疗效果不及手术。其原因主要考虑肿瘤体积较大,形态欠规则,布针不当及消融区微气泡的产生对影像学引导下瘤体边界判断的失误等因素所致。而术前IQQA(R)-Liver系统可以模拟设计出合理的RFA穿刺点、进针角度、路径和深度,精确界定瘤体边缘及RFA治疗的安全范围,指导改善受微气泡影响后B超等影像学对肿瘤消融区边界的判断,按既定消融计划提高了瘤体完全率。Lu等[9]统计直径<3 cm的肝脏肿瘤,RFA能达到88%的完全消融率,Livraghi等[10]报道3~5 cm直径者完全消融率在50%~70%,而>5 cm的肿瘤则不到50%。我们的研究结果显示,术后第3天CDFI及CEUS评估所有瘤体首次完全消融率达到89.04%,术后1个月复查CTA所有病灶二次完全消融率达到100%,随访3~12个月无局部原位复发。
据统计,RFA术后出血和针道种植的发生率均为0.3%~0.5%[11-13]。多项回顾性分析指出肝包膜下病灶是RFA术后出血、针道种植及局部复发的高危因素[14-15]。对于接近或紧靠包膜下的靶病灶,术前应用IQQA(R)-Liver系统可准确地判断瘤体边缘与肝包膜的空间位距,设计入路时选择经过相对厚层的肝实质后抵达病灶,再配合术中缓慢退针和针道消融,以降低出血及针道种植概率。我科RFA术后即常规行腹腔镜探查,观察肝脏表面穿刺点及RF消融范围,可于直视下评估瘤体组织毁损塌陷及活动性出血情况。我们的数据显示,术后观察3 d至1个月,无出血及针道转移病例。
IQQA(R)-Liver系统另一突出优势还在于可为手术方案的制定提供十分重要的量化信息,诸如全肝体积、病灶体积、功能肝体积等[16]。在模拟肝RF消融治疗的基础上,计算术后残余功能肝体积,结合术前肝功能Child-Pugh分级,可以更加准确地预估术后残余肝功能。本研究术后实际消融体积与预估体积对比差异无统计学意义(P>0.05),证明IQQA(R)-Liver系统预消融评估对实际操作有统计学指导意义。虽然对比手术前后Child-Pugh评分有5例病人存在降级,但无一例出现肝性脑病或肝衰竭。而且,所有病人单次消融体积均小于30%,彻底避免了术后急性肾功能不全或肾衰竭的发生。
伴随医学模式的转变,计算机科学、热学、物理学等多种学科在医学领域中的进一步应用为外科循证医学的发展提供了强有力的技术指引。我们认为:合理的运用计算机辅助手术规划系统同样可以对肝脏肿瘤的射频消融治疗起到良好的指导效果。
1 董家鸿,黄志强.精准肝切除——21世纪肝脏外科新理念.中华外科杂志,2009,47:1601-1605.
2 王松平,李建生,马金良,等.三维重建技术在精准肝切除中的临床应用.世界华人消化杂志,2014,22:2169- 2174.
3 杨世忠,张文智,蔡守旺,等.计算机辅助手术规划系统在精准肝切除中的应用价值.中华消化外科杂志,2010,9:31-34.
4 JH T,FH Y,ML Z,et al.Evaluation of computer-assisted quantitative volumetric analysis for pre-operative resectability assessment of huge hepatocellular carcinoma.Asian Pacific journal of cancer prevention: APJCP, 2013,14:3045-3050.
5 Ogawa T,Kawamoto H,Kobayashi Y,et al.Prevention of biliary complication in radiofrequency ablation for hepatocellular carcinoma-Cooling effect by endoscopic nasobiliary drainage tube.Eur J Radiol,2010,73:385-390.
6 刘念洲,马宽生,高峻,等.射频消融术后胆管损伤的病理学研究.消化外科,2006,5:223-226.
7 马宽生,董家鸿.特殊部位肝脏肿瘤的射频消融术.肝胆外科杂志,2007,15:321-323.
8 de Baere T,Deschamps F,Briggs P,et al.Hepatic malignancies: percutaneous radiofrequency ablation during percutaneous portal or hepatic vein occlusion. Radiology,2008,248:1056-1066.
9 Lu DS,Yu NC,Raman SS,et al.Radiofrequency ablation of hepatocellular carcinoma: treatment success as defined by histologic examination of the explanted liver.Radiology,2005,234:954-960.
10Livraghi T,Goldberg SN,Lazzaroni S,et al.Hepatocellular carcinoma: radio-frequency ablation of medium and large lesions.Radiology,2000,214:761-768.
11Akahane M,Koga H,Kato N,et al.Complications of percutaneous radiofrequency ablation for hepatocellular carcinoma: imaging spectrum and management. Radiographics,2005,25:S57-68.
12de Baere T,Risse O,Kuoch V,et al.Adverse events during radiofrequency treatment of 582hepatic tumors.Am J Roentgenol,2003,181:695-700.
13Livraghi T,Solbiati L,Meloni MF,et al.Treatment of focal liver tumors with percutaneous radio-frequency ablation: complications encountered in a multicenter study. Radiology,2003,226:441-451.
14Yang B,Zou J,Xia J,et al.Risk factors for recurrence of small hepatocellular carcinoma after long-term follow-up of percutaneous radiofrequency ablation.Eur J Radiol,2011,79:196-200.
15Liu SY,Lee KF,Lai PB.Needle track seeding: a real hazard after percutaneous radiofrequency ablation for colorectal liver metastasis.World J Gastroenterol,2009,15:1653-1655.
16苏占亮,季倩,王浩,等.IQQA(R)-Liver系统肝脏辅助规划手术方案与实际手术的相关性.中华肝胆外科杂志,2014,20:294-298.
Application of IQQA(R)-Liver system for percutaneous ultrasound-guided radiofrequency ablation in the laparoscopic treatment of hepatocellular carcinoma
GongZhao,XiaHui,ZhouCheng,ZengZhiwu,YangGuangyao.
DepartmentofHepatobiliarySurgery,FirstMunicipalHospital,Wuhan430022,China
ZhouCheng,Email:cheng.zhou@whyyy.com
Objective To summarize the experiences of using IQQA(R)-Liver system for percutaneous ultrasound-guided radiofrequency ablation (RFA) in the laparoscopic treatment of hepatocellular carcinoma (HCC). Methods During January-December 2013, the clinical data of 59 HCC patients were retrospectively collected and analyzed. Three-dimensional quantitative analysis and RFA simulation of IQQA(R)-Liver system were performed. The RFA planning included puncture site, angle, pathway and depth. And virtual ablation range was plotted by IQQA system while the volumes of whole liver, virtual ablation liver and residual liver were calculated and compared. Results Three-dimensional images of liver, tumor and intrahepatic vasculature were delineated distinctly by IQQA system. According to the simulated operative plan of IQQA system, 59 patients
RFA. There were no such complications as intraperitoneal bleeding, bile duct injury, diaphragm injury, intestinal perforation, hepatic encephalopathy or liver failure, Postoperative fever up to 39.3 C developed in 23 cases. And high serum levels of enzymes, including alanine aminotransferase (265±53.1 U/L) and aspartate aminotransferase (181±62.9 U/L), recovered within 1 week. And 89.04% lesions were completely ablated at Day 3 day post-operation on color Doppler flow imaging and contrast-enhanced ultrasound while 100% was achieved on computed tomography angiograph after 1 month. No recurrence occurred during a follow-up period of 3-12 months. At Day 3 post-operation, degradation appeared in 5 cases. Three of them descended from Child A to Child B and two degraded from B to C. No significant difference existed between actual RFA volume and virtual RFA volume at 1 month post-operation (P=0.99). Conclusions IQQA(R)-Liver system may benefit RFA operative planning because of efficient, accurate and individualized preprocedural evaluations.
IQQA (R)-Liver system; 3-dimensional reconstruction; Ultrasound-guided,Laparoscopy; Hepatic carcinoma; Radiofrequency ablation; Surgical planning
·论 著·(肝脏肿瘤专题)
湖北省自然科学基金项目(2014CFC1042)
430022 武汉,武汉市第一医院肝胆外科
周程,Email: cheng.zhou@whyyy.com
R657.4+6
A
10.3969/j.issn.1003-5591.2015.02.008
2015-03-03)

