长链非编码RNA的调控机制及其在原发性肝癌中的研究进展
常磊 刘志苏
· 综 述·
长链非编码RNA的调控机制及其在原发性肝癌中的研究进展
常磊 刘志苏
长链非编码RNA(long non-coding RNA,lncRNA)是近年来生命科学领域研究的热点,它是指一类转录本长度超过200 nt的非蛋白编码序列。近年来的研究表明,lncRNA具有基因调控的功能。某些lncRNA在肿瘤中的表达也是失调的,可以在转录前、转录、转录后及表观遗传学等多个层面发挥作用,本文就lncRNA生物学特点和调控机制及其在原发性肝癌中的研究进展作一综述。
长链非编码RNA;调控;原发性肝癌
经典的中心法则“DNA-RNA-蛋白质”揭示基因的信息储存于编码蛋白质的基因组中。传统研究中,蛋白质一直是研究细胞功能的“主角”。而RNA仅是基因和蛋白质之间的媒介物质。在过去的几十年里,编码蛋白的基因一直是研究疾病的首选物质。然而,随着科学技术的进步,这种研究格局逐渐被打破。最新的编码数据库显示:编码蛋白质的转录本仅占人类基因组转录本的2.94%[1]。基因组和转录组测序证据表明:复杂的机体功能可能受一系列来自于基因组非编码区的短链或者长链非编码RNA(long non-coding RNA,lncRNA)的调控[2]。因此,这种在细胞中广泛存在却不被熟知的物质——lnc RNA成为当前研究的热点。
lncRNA是一组转录本长度超过200个核苷酸序列的RNA分子,它们本身并不编码任何蛋白或者只是编码很短的多肽类分子[3]。lncRNA最初被认为是基因组转录的“暗物质”,RNA聚合酶Ⅱ转录的副产物,不具备任何生物学功能。然而近几年的研究表明,lncRNA参与了X染色体沉默,基因组印记以及染色质修饰,转录激活及转录干扰,核内运输、蛋白功能调节[4-7]等多种重要的调控过程,且越来越多的证据表明lncRNA参与调控了机体各种生理病理调控。近年来,关于lncRNA的研究突飞猛进,本文就lncRNA的生物学特点、调控机制及其在肝癌中的研究进展等方面作一综述。
一、lncRNA生物学特点
大部分LncRNA都具有保守的二级结构,以剪切的形式定位于亚细胞结构中,这种保守性和特异性表明lncRNA是具有生物学功能的[8]。但相对于microRNA和蛋白质来说,lncRNA功能更加难以确定,因为目前并不能仅依据其序列或结构来预测它们的功能。根据lncRNA在基因上相对于编码区(coding sequence,CDS)的位置,可以将其分为以下5种类型[9]:①正义;②反义;③双向;④内含子间;⑤基因间。这种位置关系对于预测lncRNA功能有着很大的帮助。(图1)
lncRNA有多种来源,目前的研究认为其来源可能有以下几种[10]:①基因CDS区中断转变为lncRNA;②两个未转录的基因与一个独立的基因并列而产生即染色质重组;③非编码基因复制过程中反移位产生;④局部串联复制子产生邻近的lncRNA;⑤转座子插入基因中产生。
二、lncRNA的调控机制
截止目前,lncRNA的功能还不是完全清楚,不能单纯依靠其高级结构或者序列预测其功能。lncRNA调控基因表达的机制多种多样,它本身就可以作为转录控制因子,或者作为协同控制因子参与基因转录的调控。近年来的研究表明:lncRNA调控基因表达的可能机制如下[11]:①在基因CDS区上游启动子区域发生转录,进而干扰下游基因的表达(如酵母中的SER3基因);②与编码蛋白基因的转录本形成互补双链,干扰其mRNA的剪切;③干扰RNA聚合酶Ⅱ的活性、介导染色质重塑、组蛋白修饰等来影响下游基因的表达;④通过与编码基因的转录本形成互补双链,在Dicer酶作用下产生内源性的siRNA,调控基因的表达;⑤结合特异性蛋白,并调节其活性,进而调节基因的表达;⑥与蛋白质结合形成复合物进而调控基因的表达;⑦结合特异性蛋白,改变后者的细胞定位;⑧作为siRNA、piRNA的前体物质发挥作用。(图2)

图1 lncRNA在基因组上的位置示意图 一般而言根据lncRNA在基因座上与编码基因的位置关系,lncRNA在基因组上有5种位置,转录和编码基因相同方向为正义型(A)、与编码基因转录相反为反义型(B)、双向型(C)、位于内含子之间的为内含子间型(D)、位于编码基因间的为基因间型(E)
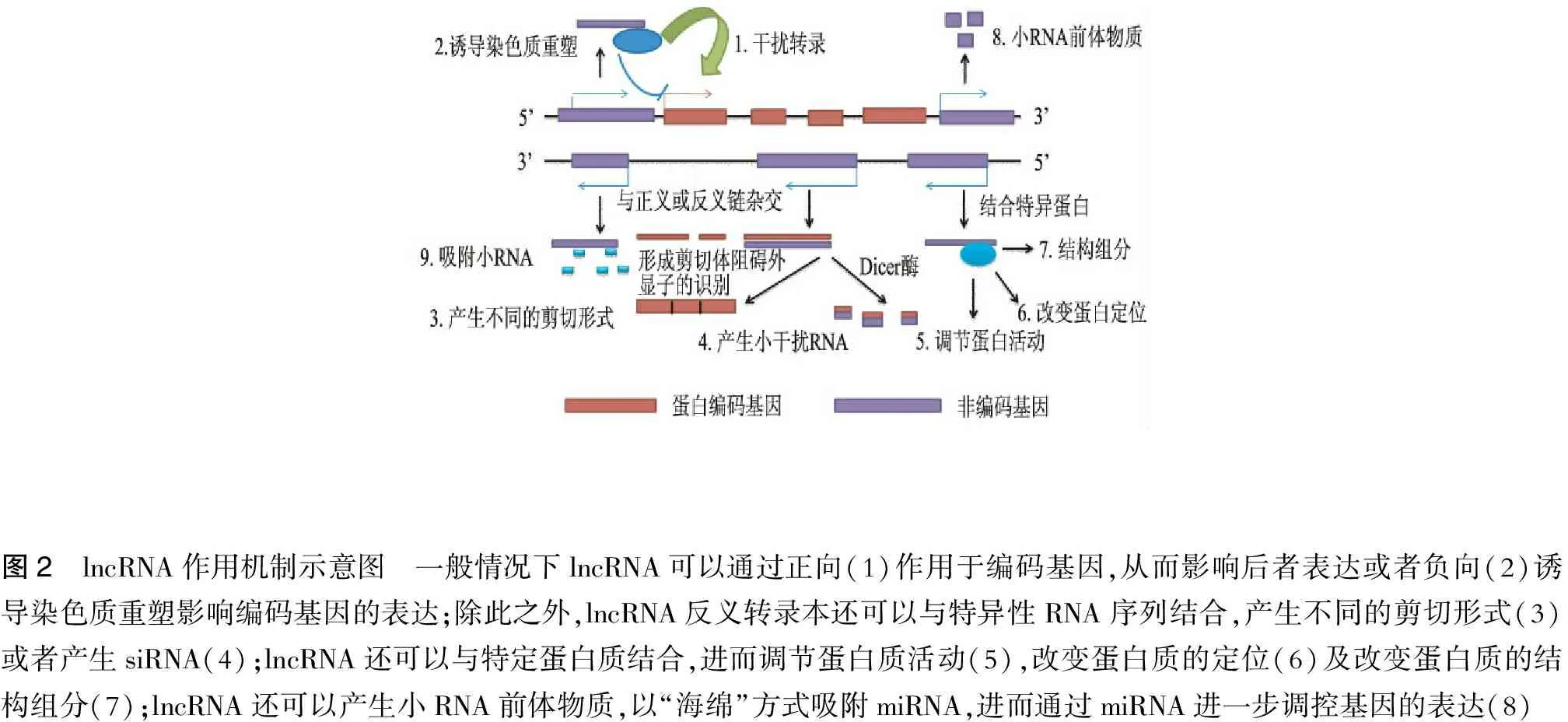
图2 lncRNA作用机制示意图 一般情况下lncRNA可以通过正向(1)作用于编码基因,从而影响后者表达或者负向(2)诱导染色质重塑影响编码基因的表达;除此之外,lncRNA反义转录本还可以与特异性RNA序列结合,产生不同的剪切形式(3)或者产生siRNA(4);lncRNA还可以与特定蛋白质结合,进而调节蛋白质活动(5),改变蛋白质的定位(6)及改变蛋白质的结构组分(7);lncRNA还可以产生小RNA前体物质,以“海绵”方式吸附miRNA,进而通过miRNA进一步调控基因的表达(8)
总体来说lncRNA可以通过以下三个层面来调控基因的表达。
1.表观遗传学调控 表观遗传学是指研究的基因发生了可遗传的改变,而DNA序列不发生改变。表观遗传学的机制主要包括DNA甲基化、组蛋白乙酰化[12]。研究表明:lncRNA可以在表观遗传学层面实现对基因表达的调控。lncRNA招募染色质重构复合体到特定位点进而介导相关基因的表达沉默。例如来源于HOXC基因座的lncRNA HOTAIR,它能够招募染色质重构复合体Polycomb抑制复合物(Polycomb repressive complex 2,PRC2)并将其定位到HOXD位点,进而诱导HOXD位点的表观遗传学沉默[13]。同样,Xist,Air,Kcnq1ot1这些lncRNA都能够通过招募相应的重构复合体,利用其中的甲基转移酶如EZH2或者G9a等实现表观遗传学沉默[14]。有研究显示:人类组织中大约有20%的lncRNA与PRC2复合物有相互作用[15],这表明PRC2复合物功能的实现在一定程度上依赖于lncRNA的调节。
2.转录调控 lnvRNA可以通过多种形式在转录水平上实现对基因表达的调控。lncRNA的转录能够干扰邻近基因的表达,如酵母中,SER3 基因会受到其上游lncRNA-SRG1的转录的干扰[16];lncRNA能够通过封阻启动子区域来干扰基因的表达,DHFR上游的一个lncRNA能够和DHFR的启动子区域形成 RNA-DNA3螺旋结构,进而抑制转录因子TFIID的结合,从而抑制DHFR的基因表达[17];lncRNA能够与RNA结合蛋白作用,并将其定位到基因启动子区,从而调控基因的表达。例如,CCND1启动子上游一个lncRNA能够调节RNA结合蛋白TLS的活性,进而调控CCND1的表达[18];lncRNA能够调节转录因子的活性,如lncRNA Evf2能够与转录因子Dlx2形成转录复合体从而激活Dlx6的表达[19];lncRNA也能够通过调节基本转录因子来实现调控基因的表达,例如,Alu RNA能够通过抑制RNA聚合酶Ⅱ来实现广谱的基因抑制[20]。lncRNA也可以将转录因子募集到邻近的靶基因启动子上,调控其表达,受p53抑制的一长链非编码RNA(lincRNA-21)可以与hnRNP-K相互作用,引导hnRNP-K在基因组上定位,从而调控其靶基因的转录,进而影响p53调控的凋亡过程[21]。
3.转录后调控 lncRNA同样可以在转录后水平调节基因的表达。lncRNA能够与相应的mRNA特异性结合形成双链结构,进而调控基因的表达。E盒结合锌指蛋白2(zinc finger E-box binding protein-2, ZEB2)反义链RNA能够与前者的mRNA内含子区域5’端剪切位点形成双链结构,从而抑制内含子的剪切。该区域含有ZEB2蛋白表达所需的核糖体结合位点,以此来提高ZEB2蛋白的表达[22]。阿尔兹海默症的研究中的lncRNA-BACE1AS能够在外界压力的刺激下,增加BCAE1mRNA的稳定性(通过防止BACE1受到核酸酶降解的方式)[23]。缺氧诱导因子-α(hypoxia inducible factor α,HIFα)的反义转录本αHIF包括5’aHIF-1α和3’aHIF-1α两种。3’aHIF-1α缺乏5’帽端和polyA尾结构,通过暴露其AU富集区作用于HIF1αmRNA的3’非编码区来调控其mRNA的表达。αHIF可以诱导HIF-1αmRNA的降解,可以作为乳腺癌评估预后的分子标志[24]。
LncRNA除了通过mRNA调控基因的表达外,还可以通过调控mRNA前体的剪切及mRNA的翻译两种方式调控基因的表达。转移相关性肺腺癌转录因子1(Metastasis-associated lung adenocarcinoma transcript1,MALAT1)是一种研究较深入的lncRNA。MALAT1与肿瘤细胞的转移密切相关,且可作为早期非小细胞肺癌独立的预后指标[25]。MALAT1与丝氨酸/精氨酸(SR)剪切因子相互作用,并调控剪接因子在剪接斑点中的分布和磷酸化水平,从而改变mRNA前体的选择性剪接模式。最新的RNA序列分析显示:许多lncRNA可以在胞质内调控mRNA的翻译。lncRNA-p21是p53基因依赖转录过程中的阻遏剂。lncRNA-p21可以调节下游基因上转录复合物的定位,通过核内不均一核糖核蛋白-K(heterogenous nuclear ribnucleoprotein K,hnRNP-K)影响p53依赖的凋亡过程[26]。Ying等[27]发现RNA结合蛋白HuR能与lncRNA-p21结合形成复合物,该复合物能够招募let-7/Ago2,抑制JUNB和CTNNB1基因的mRNA的转录。
三、lncRNA在肝癌中的研究状况
肝细胞癌(hepatocellular carcinoma,HCC)在亚洲和非洲是导致癌症死亡因素中的主要原因。HCC每年导致全世界约662 000病人死亡,这其中大约有一半人数来自于中国。HCC发病机制很复杂。高危因素主要有HBV、HCV感染;黄曲霉素B1感染;酒精性脂肪肝等等。多种信号通路也参与了HCC的发生发展,如Raf/MAPK/ERK通路、PI3K/Akt/mTOR通路、WNT-b-catenin通路、Jak/Stat通路等等[28]。然而近几年的研究表明,lncRNA的表达具有组织特异性,在癌组织中异常表达。在HCC中一些lncRNA表达是失调的,后者的异常表达也与HCC的发生、发展、转移、诊断和预后息息相关。
Braconi等[29]通过微阵列分析发现:肝细胞癌中,有约3%的lncRNA表达下调,其中MEG3表达下调尤其显著,约为210倍。qPCR显示,与正常肝细胞株比较,MEG3在不同的肝癌细胞株中表达亦明显减少。过表达MEG3后,肝癌细胞生长明显受到抑制,且凋亡增加。该研究还发现,miR-29a通过甲基转移酶1来调控MEG3的表达。Yang等[30]利用lncRNA芯片分析了5例乙型肝炎病毒相关性肝癌病人癌组织与癌旁组织中差异表达的lncRNA,发现差异表达的lncRNA有174条,且具有组织特异性。运用生物信息学软件分析了其中一条lncRNA-HEIH。发现HEIH可作为判断肝癌复发和预后的独立危险因素。进一步研究还发现HEIH能够调控细胞周期且在G0/G期阻滞中起着关键的作用,lncRNA-HEIH通过抑制EZH2的靶基因来调控肝癌细胞的生长。Lai等[31]研究发现lncRNA MALAT-1在肝癌组织及肝癌细胞株中表达均上调。且表达水平与肝癌肝移植后复发的风险呈正相关。MALAT-1可作为一个独立的因素判断肝癌的复发。细胞实验发现抑制MALAT-1后癌细胞的活力、运动能力、侵袭能力均降低。该研究认为MALAT-1在肝癌的发生发展中发挥着重要作用,有可能成为治疗肝癌新的靶点。Huang等[32]使用 lncRNAs 芯片技术筛选到一批在 HBx 转基因小鼠肝脏组织中比野生型小鼠发生显著差异的 lncRNAs,并且用实时定量 PCR 技术扩大样本量对它们在不同年龄和性别的转基因和野生型小鼠肝脏组织中的表达量进行了验证。证实了HBx确实可以影响机体的 lncRNAs 表达,说明 HBV 感染者可能有着其特异的lncRNAs 表达谱,而这些差异表达的 lncRNAs可能与肿瘤的发生密切相关。同时研究还发现HBx 诱导下调的 lncRNA-AK050349,可以与Vimentin 蛋白发生相互结合并影响其结构,从而改变正常的细胞骨架结构,在体内外促进肿瘤的增殖和迁移。H19基因能够编码一长2.3 kb的lncRNA,后者广泛表达于母系等位基因中,且在生长发育过程中的基因组印迹中扮演重要角色[33]。胰岛素样生长因子(insulin-like growth factor 2,IGF2)和H19是人类11号染色体上两个位置邻近的印迹基因。有学者研究发现IGF2和H19在肝癌中等位表达,在肝癌发生发展的表观遗传过程发挥着重要作用,但是具体的分子机制仍然不清楚(Expert Rev Mol Med, 2002, 4:1-19.)。2004年,Manoharan等[34]采用DNA微阵列数据库分析了临床病人的肝癌组织,发现H19和IGF2的不平衡转录和肝癌的发展过程密切相关。lncRNA-HULC(highly up-regulated in liver cancer)是一长度为1 600核苷酸序列的非编码RNA,也是第一个被报道在肝癌中特异性升高的lncRNA[35]。文献报道HULC在肝癌细胞中受cAMP反应元件结合蛋白(cAMP responsive element binding protein,CREB)的调控,除此之外HULC还可能起着内在“海绵”的作用,吸附生物体内一些microRNA如miR-372,抑制后者的活性。乙型肝炎病毒X蛋白(HBX)和肝癌的发生发展密切相关,在肝癌组织中,HULC和HBX呈负相关,此外HBX还可以促进肝癌细胞株HepG2及正常肝细胞株L02中HULC表达上调。进一步研究表明,HBX促进HULC表达上调后通过抑制p18来促进肝癌细胞的增殖[36]。microRNA可以作为肝癌诊断和治疗的生物标志已经得到公认,同样近年来的研究显示lncRNA也可以作为特定肿瘤的生物标志。HULC也可以在肝癌病人的血浆中检测到,且HULC的表达和病人体内HBV含量呈正相关。母系表达基因3(maternally expressed gene,MEG3)也参与肝癌的发展。MEG3是一种印迹基因,位于人类14号染色体上,MEG3编码一大约1700nt的非编码RNA,有12个转录本,很多癌组织中MEG3表达上调,MEG3通过累积p53蛋白、激活p53下游基因来促进癌细胞的生长[37]。然而在肝癌细胞和组织中,MEG3表达是下调的,且和启动子甲基化密切相关。过表达实验证实:MEG3能够抑制癌细胞生长、诱导凋亡[38]。Yuan等[39]发现一种在肝癌中与微血管侵犯密切相关的lncRNA即肝癌相关微血管侵袭因子(microvascular invasion in HCC,MVIH)。MVIH在肝癌中过表达,并且可以通过抑制磷酸甘油酸激酶1(phospho-glycerate kinase 1,PKG1)的分泌促进肿瘤细胞的生长及肿瘤间质微血管的形成。Yuan等[40]最近发现一种与HCC 上皮间质转化(Epithelial mesenchymal transformation,EMT)密切相关的一种lncRNA-activated by TGF-β (lncRNA-ATB),该研究发现在HCC中,lncRNA-ATB在HCC组织中表达较癌旁组织明显升高,且和患者预后呈明显相关关系。lncRNA-ATB可以通过竞争性结合miRNA-200s,从而通过后者影响EMT关键转录因子ZEB1、ZEB2的表达来调控EMT过程。该研究进一步发现,lncRNA-ATB可以结合白细胞介素-11(interleukin-11,IL-11)mRNA,自分泌IL-11,通过STAT3信号通路来影响肿瘤细胞侵袭转移过程中在器官中的定植能力。
四、结语与展望
近年来,关于lncRNA的研究进展如火如荼,但相对于编码蛋白的基因及microRNA来说,lncRNA的研究还仅仅出于初步探索阶段。伴随着更多高通量筛查技术的发展,如Microarray芯片杂交技术,新一代高通量测序技术,结合生物信息学预测工具,人们将能够更快更有效率地发现那些具有重要调控功能的lncRNA[39]。lncRNA可在多个层面调节基因的表达及体内病理生理过程。目前lncRNA在肝癌中的研究也主要集中在功能学方面, 相信随着新一代分子生物学技术的进步lncRNA在肝癌发生、发展过程中的作用机制会逐步得到阐明,为肝癌的诊断和治疗提供新的靶点和契机。
1 Derrien T, Johnson R, Bussotti G, et al. The GENCODE v7 catalog of human long noncoding RNAs: analysis of their gene structure, evolution, and expression. Genome Res,2012,22:1775-1789.
2 Mattick JS. RNA regulation:a new genetics?.Nat Rev Genet ,2004,5:316-3 23.
3 Mattick JS. Long noncoding RNAs in cell and developmental biology. Semin Cell Dev Biol,2011,22:327.
4 Tsai MC, Spitale RC, Chang HY. Long intergenic noncoding RNAs: new links in cancer progression. Cancer Res,2011,71:3-7.
5 Pandey RR, Mondal T, Mohammad F, et al. Kcnqlot1 antisense noncoding RNA mediates lineage-specific transcriptional silencing through chromatin-level regulation. Mol Cell,2008,32:232-246.
6 Vafiadaki E, Arvanitis DA, Pagakis SN, et al. The anti-apoptotic protein HAX-1 interacts with SERCA2 and regulates its protein levels to promote cell survival. Mol Biol Cell,2009,20:306-318.
7 Prensner JR, Chinnaiyan AM. The emergence of lncRNAs in cancer biology. Cancer Discov,2011,1:391-407.
8 Derrien T, Johnson R, Bussotti G, et al. The GENCODE v7 catalog of human long noncoding RNAs: analysis of their gene structure, evolution, and expression. Genome Res,2012,22:1775-1789.
9 Wilusz JE, Sunwoo H, Spector DL.Long noncoding RNAs: functional surprises from the RNA world. Genes Dev,2009,23:1494-1504.
10Ponting CP,Oliver PL, Reik W.Evolution and functions of long noncoding RNAs. Cell,2009,136:629-641.
11Wu HA, Bernstein E. Partners in imprinting: noncoding RNA and polycomb group proteins. Dev Cell,2008,15:637-638.
12Bird A. Perceptions of epigenetics. Nature,2007,447:396-398.
13Rinn JL, Kertesz M, Wang JK, et al.Functional demarcation of active and silent chromatin domains in human HOX loci by noncoding RNAs. Cell,2007,129 :1311-1323.
14Wu HA, Bernstein E. Partners in imprinting: noncoding RNA and polycomb group proteins.Dev Cell,2008,15:637-638.
15Pandey RR, Mondal T, Mohammad F, et al. Kcnq1ot1 antisense noncoding RNA mediates lineage-specific transcriptional silencing through chromatin-level regulation. Mol Cell,2008,32:232-246.
16Thebault P, Boutin G, Bhat W, et al. Transcription regulation by the noncoding RNA SRG1 requires Spt2-dependent chromatin deposition in the wake of RNA polymerase II. Mol Cell Biol,2011,31:1288-1300.
17Martianov I, Ramadass A, Serra BA, et al. Repression of the human dihydrofola te reductase gene by a non-coding interfering transcript. Nature,2007,445:666-670.
18Kurokawa R. Promoter-associated long noncoding RNAs repress transcription through a RNA binding protein TLS.Adv Exp Med Biol,2011,722:196-208.
19Feng J, Bi C, Clark BS, et al.The Evf-2 noncoding RNA is transcribed from the Dlx-5/6 ultraconserved region and functions as a Dlx-2 transcriptional coactivator. Genes Dev,2006,20:1470-1484.
20Holdt LM, Hoffmann S, Sass K,et al.Alu elements in ANRIL non-coding RNA at chromosome 9p21 modulate atherogenic cell functions through trans-regulation of gene networks.PLoS Genet,2013,9:e1003588.
21Huarte M, Guttman M, Feldser D,et al.A large intergenic noncoding RNA induced by p53 mediates global gene repression in the p53 response.Cell,2010,142:409-419.
22Beltran M, Puig I, Pena C, et al. A natural antisense transcript regulates Zeb2/Sip1 gene expression during Snail1-induced epithelial-mesenchymal transition. Genes Dev,2008,22:756-769.
23Wu P, Zuo X, Deng H, et al. Roles of long noncoding RNAs in brain development, functional diversification and neurodegenerative diseases. Brain Res Bull,2013,97:69-80.
24Bertozzi D, Iurlaro R, Sordet O, et al. Characterization of novel antisense HIF-1alpha transcripts in human cancers. Cell Cycle,2011,10:3189-3197.
25Schmidt LH, Spieker T,Koschmieder S,et al.The long noncoding MALAT-1 RNA indicates a poor prognosis in non-small cell lung cancer and induces migration and tumor growth.Thorac Oncol,2011,6:1984-1992.
26Huarte M,Guttman M,Feldser D, et al.A large intergenic noncoding RNA induced by p53 mediates global gene repression in the p53 response. Cell,2010,142:409-419.
27Ying L,Chen Q,Wang Y,et al.Upregulated MALAT-1 contributes to bladder cancer cell migration by inducing epithelial-to-mesenchymal transition. Mol Biosyst,2012,8:2289-2294.
28Aravalli RN,Cressman EN,Steer CJ.Cellular and molecular mechanisms of hepatocellular carcinoma: an update. Arch Toxicol,2013,87:227-247.
29Braconi C,Kogure T,Valeri N,et al. microRNA-29 can regulate expression of the long non-coding RNA gene MEG3 in hepatocellular cancer. Oncogene,2011,30:4750-4756.
30Yang F,Zhang L,Huo XS,et al.Long noncoding RNA high expression in hepatocellular carcinoma facilitates tumor growth through enhancer of zeste homolog 2 in humans. Hepatology,2011,54:1679-1689.
31Lai M C, Yang Z, Zhou L,et al. Long non-coding RNA MALAT-1 overexpression predicts tumor recurrence of hepatocellular carcinoma after liver transplantation.Med Oncol,2012,29:1810-1816.
32Huang JF, Guo YJ, Zhao CX, et al. Hepatitis B virus X protein (HBx)-related long noncoding RNA (lncRNA) down-regulated expression by HBx (Dreh) inhibits hepatocellular carcinoma metastasis by targeting the intermediate filament protein vimentin. Hepatology,2013,57:1882-1892.
33Hitchins MP, Moore GE. Genomic imprinting in fetal growth and development. Expert Rev Mol Med,2002,4:1-19.
34Manoharan H,Babcock K,Pitot HC.Changes in the DNA methylation profile of the rat H19 gene upstream region during development and transgenic hepatocarcinogenesis and its role in the imprinted transcriptional regulation of the H19 gene. Mol Carcinog,2004,41:1-16.
35Panzitt K,Tschernatsch MM, Guelly C,et al. Characterization of HULC, a novel gene with striking up-regulation in hepatocellular carcinoma, as noncoding RNA. Gastroenterology, 2007,132:330-342.
36Wang J, Liu X, Wu H, et al. CREB up-regulates long non-coding RNA, HULC expression through interaction with microRNA-372 in liver cancer. Nucleic Acids Res,2010, 38:5366-5383.
37Zhang X, Rice K, Wang Y,et al.Maternally expressed gene 3 (MEG3) noncoding ribonucleic acid: isoform structure, expression, and functions. Endocrinology,2010,151:939-947.
38Qin R, Chen Z, Ding Y, et al. Long non-coding RNA MEG3 inhibits the proliferation of cervical carcinoma cells through the induction of cell cycle arrest and apoptosis. Neoplasma,2013,60:486-492.
39Yuan SX, Yang F, Yang Y, et al. Long noncoding RNA associated with microvascular invasion in hepatocellular carcinoma promotes angiogenesis and serves as a predictor for hepatocellular carcinoma patients' poor recurrence-free survival after hepatectomy. Hepatology,2012,56:2231-2241.
40Yuan JH, Yang F, Wang F, et al. A long noncoding RNA activated by TGF-beta promotes the invasion-metastasis cascade in hepatocellular carcinoma. Cancer Cell,2014,25:666-681.
Regulatory mechanism of long non-coding RNA and advances of hepatocellular carcinoma
ChangLei,LiuZhisu.
DepartmentofHepatobiliary&PancreaticSurgery,ZhongnanHospital,WuhanUniversity,Wuhan430071,China
Correspondingauthor:LiuZhisu,Email:liuzs53@sina.com
Long non-coding RNA (lncRNA) has been a focal point of biomedical researches in recent years. Long noncoding RNAs (lncRNAs) are a class of transcripts of over 200 nucleotides with limited protein coding potential. Recent researches have shown that lncRNA played a key role in gene regulation. Some abnormally expressed lncRNAs could regulate gene expression at the levels of pretranscription, transcription, post-transcription and epigenetics. This review summarized the biological characteristics, regulatory mechanisms and advances of hepatocellular carcinoma.
Long non-coding RNA; Regulation; Hepatocellular carcinoma
430071 武汉,武汉大学中南医院肝胆胰外科
刘志苏,Email:liuzs53@sina.com
R657.3
A
10.3969/j.issn.1003-5591.2015.01.018
2014-12-18)

