三环芳烃菲在浆态床内的催化加氢转化及动力学研究
周 凌,赵 静,张德祥
(华东理工大学 能源化工系 煤气化及能源化工教育部重点实验室,上海 200237)
三环芳烃菲在浆态床内的催化加氢转化及动力学研究
周 凌,赵 静,张德祥
(华东理工大学 能源化工系 煤气化及能源化工教育部重点实验室,上海 200237)
采用振荡式浆态床反应器研究了NiMo催化剂作用下的菲催化加氢行为及其动力学,考察了反应温度和氢初压对菲催化加氢反应的影响。实验结果表明,提高反应温度和氢初压均有利于菲催化加氢反应,在反应温度380 ℃、氢初压9 MPa、反应时间30 min的条件下,菲催化加氢转化率可达80.34%。菲催化加氢反应符合Langmuir-Hinshelwood机理,菲和H2均为分子状态吸附,催化加氢反应过程中的表面反应为控制步骤,由此推导的反应动力学方程与实验数据十分吻合,并同时用统计检验法验证了机理假设的合理性。由实验数据求得菲在浆态床内催化加氢的活化能为25.99 kJ/mol。
浆态床反应器;菲;催化加氢;镍钼催化剂;动力学
我国对汽油和柴油等燃料的需求量与日俱增,但我国的能源现状是多煤、少油、缺气,故煤液化油[1-4]和煤焦油[5-6]等煤基油的利用受到关注。煤基油中的主要典型产物是多环芳烃,它严重影响煤基发动机燃料油的品质和性能。随着环保法规的日趋严格,油品的清洁化已成为当务之急;同时,由于原油资源不断减少以及原油的重质化,煤基油作为石油的补充来源,如何降低煤基油中芳烃的含量更是刻不容缓。催化加氢工艺是炼油行业重要的二次加工工艺之一,它能将低价值的重馏分油转化为高价值的各种石油化工产品,且操作灵活[7-8]。
菲是煤液化油中的主要产物之一,同时也是高温煤焦油中的第二大组分,含量为4%~6%(w)[9],低温煤焦油中也存在大量的菲同系物[6]。菲的部分加氢产物(二氢菲(DHP)、四氢菲(THP)和八氢菲)可作为煤液化过程中的供氢剂,其中,DHP是最活泼的供氢剂[10]。氢菲也是高级喷气飞机的燃料[11]。对菲在连续流动固定床反应器上的加氢转化报道较多[12-14],对浆态床上的菲催化加氢报道较少;对菲加氢催化剂和反应条件的研究[15-18]较多,对菲催化加氢动力学的研究较少。
本工作以菲为多环芳烃的模型化合物,以正十二烷为溶剂,在振荡式浆态床上使用NiMo催化剂,考察了反应条件对菲催化加氢转化率及产物分布的影响;根据加氢转化结果,建立了菲催化加氢动力学模型,推导出催化加氢动力学方程并进行验证,为多环芳烃的催化加氢研究提供基础数据。
1 实验部分
1.1 原料及催化剂
实验所用试剂包括二硫化碳(AR)、液体石蜡(CP)和正十二烷(纯度99%)。原料菲由阿拉丁试剂有限公司提供,纯度为95%。实验所用加氢催化剂为NiMo催化剂,其理化性质见表1。

表1 NiMo催化剂的理化性质Table 1 Properties of the NiMo catalyst
1.2 实验方法
NiMo催化剂的硫化:将NiMo催化剂、液体石蜡、二硫化碳按一定比例加入搅拌式高压反应釜中,氢初压7 MPa,反应温度从室温升至230 ℃,恒温3 h,再升至330 ℃,恒温1 h,反应结束,冷却至室温后,开釜,洗出催化剂,抽滤,100 ℃下干燥1 h,密封保存。
将原料菲、溶剂正十二烷及硫化态NiMo催化剂按相应的比例加入振荡式浆态床中,加盖密封[19];充入N2,检查气密性,确认气密性良好后,用N2置换3次,再用H2置换3次,然后充入H2至所需压力;将浆态床迅速插入已加热至设定温度的盐浴中,浆态床极快地加热至所需反应温度,可忽略传热的时间,从此时开始计算反应时间,浆态床上下振荡的振幅为5 cm,振荡频率为400 r/min。
1.3 产物分析
使用Agilent 7980A GC/5975C型气相色谱/质谱进行GC/MS分析,HP-5毛细管柱和FID检测,利用面积归一化法定量。分析条件:载气为N2,流量0.7 mL/min,进样口温度310 ℃,气相色谱和质谱连接口温度220 ℃;程序升温起始温度60 ℃,保持2 min,以3 ℃/min的升温速率加热至280 ℃;电离源为EI,电离能量70 eV,离子源温度280 ℃。
1.4 内外扩散的消除
浆态床反应器包含气、液、固三相,固相一般为固体催化剂颗粒,悬浮于液相中,H2以气泡形态进入液相,溶解在液相中再传递到固体颗粒表面进行反应[20]。与固定床反应器相比,浆态床反应器的催化剂粒径较小,一般为几十微米,催化剂有效因子高;另外,由于颗粒处于流化状态,传热和传质效果大幅增强[21]。本实验采用振荡式浆态床反应器,故可以消除内外扩散的影响。
2 结果与讨论
2.1 工艺条件对菲催化加氢性能的影响
2.1.1 反应温度对菲催化加氢性能的影响
反应温度对菲催化加氢转化率的影响见图1。由图1可见,随反应温度的升高,菲催化加氢转化率的增幅变缓。当反应温度从320 ℃升至380℃时,菲催化加氢转化率提高了9.51百分点,达到80.34%。温度对菲催化加氢转化率的影响程度较小。
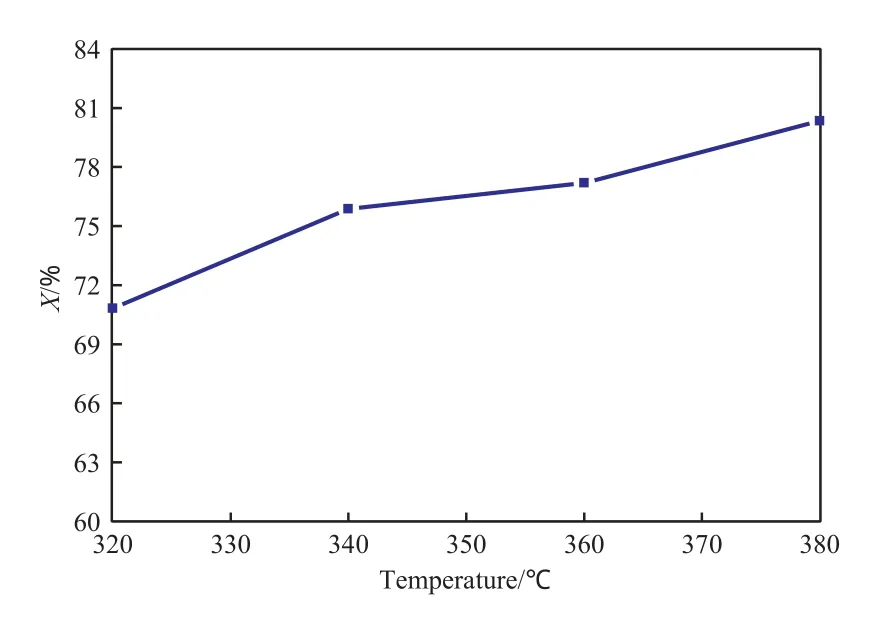
图1 反应温度对菲催化加氢转化率的影响Fig.1 Effect of reaction temperature on the conversion of phenanthrene in the catalytic hydrogenation(X).Reaction conditions:9 MPa,30 min.
菲催化加氢产物选择性随反应温度的变化见图2。通过GS/MS分析液相产物的组成,反应产物为DHP、THP、不对称八氢菲(1,10-OHP)、对称八氢蒽(1,8-OHA)和联苯。由图2可看出,随反应温度的升高,THP、1,10-OHP、1,8-OHA和联苯的选择性均略有增加,DHP的选择性明显减小。这说明在320~380 ℃内升高反应温度对菲催化加氢反应有利。

图2 反应温度对菲催化加氢产物选择性的影响Fig.2 Effects of reaction temperature on the selectivities to the hydrogenation products.Reaction conditions referred to Fig.1.Tetrahydrophenanthrene(THP);Sym-octahydroanthracene (1,8-OHA);Dihydrophenanthrene(DHP);Asym-octahydrophenanthrene(1,10-OHP);Biphenyl
在本实验条件下,菲催化加氢产物可分为加氢产物(DHP,THP,1,10-OHP)、异构化产物(1,8-OHA)和裂化产物(联苯)。随反应温度的升高,菲催化加氢反应程度加深,加氢反应倾向于两环加氢,反应物中未检测到全氢菲,故菲的完全加氢较困难,这与文献报道结果[22-23]一致。液相产物中检测到的单环芳烃只有联苯,且联苯的总体选择性较低(约2%),这是由于本实验所用催化剂的载体为γ-Al2O3,呈弱酸性,裂化性能较弱[17]。
2.1.2 氢初压对菲催化加氢性能的影响
氢初压对菲催化加氢反应的影响见图3。由图3可知,菲催化加氢转化率随氢初压的增大而增加。这是由于菲催化加氢反应是体积缩小的反应,提高压力对加氢平衡有利;且反应压力高,提高了氢及菲向催化剂表面及内部扩散的推动力,有利于提高转化率。
氢初压对菲催化加氢产物选择性的影响见图4。由图4可知,氢初压从4 MPa升至9 MPa,1,10-OHP和1,8-OHA的选择性均增加,当氢初压大于8 MPa后,1,8-OHA选择性的增幅更快。相反,DHP和THP的选择性随氢初压的增加而减小,这是由于氢初压的提高促进了加氢反应,导致DHP和THP的不稳定性加剧,趋向于两环继续加氢。联苯的选择性随氢初压的提高而减小,这是由于裂化反应是体积增大的反应,氢初压的提高不利于联苯的生成。H2对催化加氢反应过程的影响较广,作为一种反应物,H2几乎参与了催化加氢的所有反应,氢分压的高低不但对反应速率产生作用,同时也是影响产品质量的重要因素;H2能促使某些反应朝着特定的方向进行,从而改变产物的分布特征。氢初压从一定程度上反映了催化加氢过程中氢压的大小。氢初压越大,菲催化加氢的程度越深。
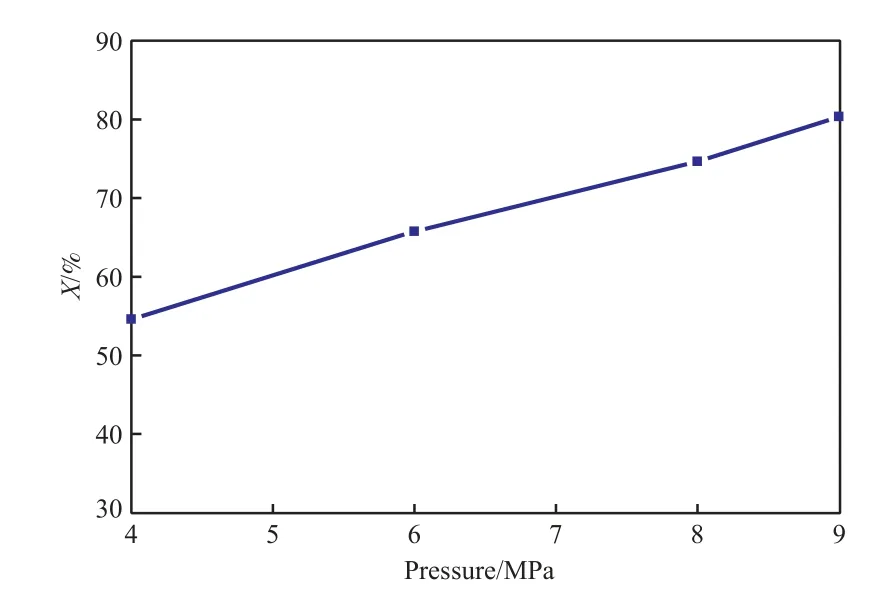
图3 氢初压对菲催化加氢转化率的影响Fig.3 Effect of initial hydrogen pressure on the conversion of phenanthrene.Reaction conditions:380 ℃,30 min.
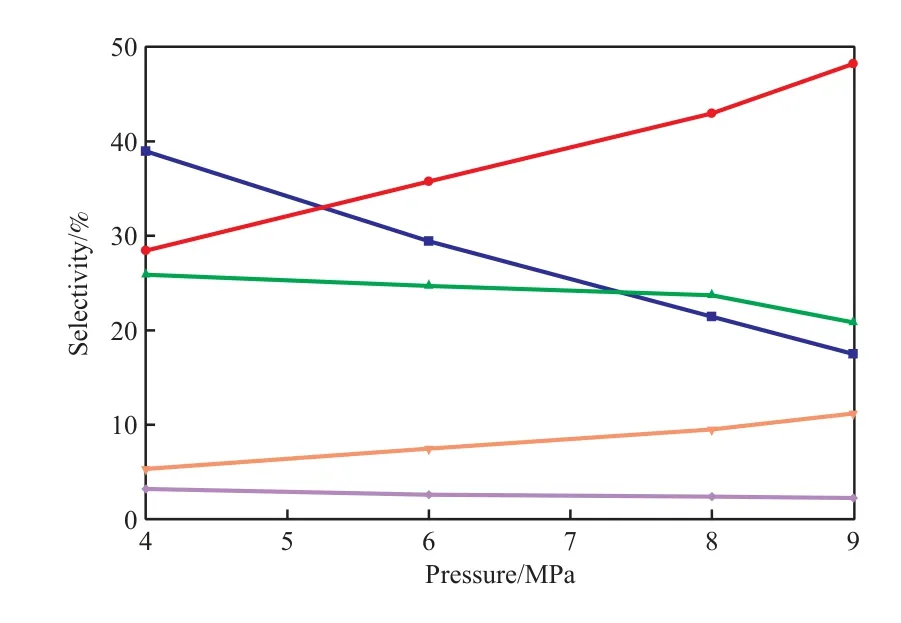
图4 氢初压对菲催化加氢产物选择性的影响Fig.4 Effects of initial hydrogen pressure on the selectivities to the hydrogenation products.Reaction conditions referred to Fig.3.THP;1,8-OHA;DHP;1,10-OHP;Biphenyl
2.2 菲催化加氢反应机理及动力学方程
在密闭浆态床反应体系中,因H2大量过剩,符合Langmuir-Hinshelwood机理的动力学方程[24]的形式为:
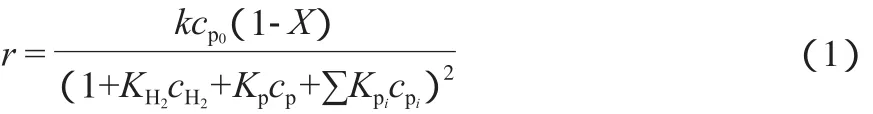
式(1)产生于Langmuir-Hinshelwood机理,对该机理(见图5)做如下说明:1)菲在NiMo催化剂的活性位上是强吸附,同时,H2是超过量的,且菲和H2均是分子吸附;2)菲和H2为取得催化活性位而竞争,吸附和脱附是迅速的,很快达到平衡,且支配全反应速率的主要因素是发生在两个吸附组分之间的表面反应。
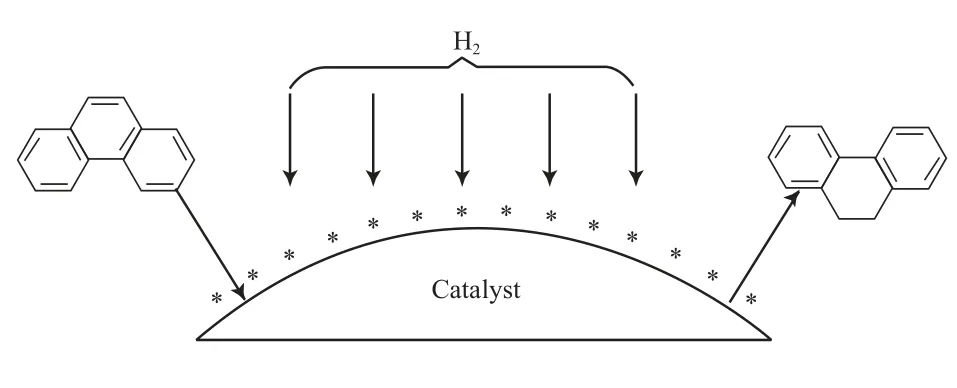
图5 菲催化加氢机理的示意图Fig.5 Mechanism of the phenanthrene hydrogenation.* Active sites on the catalyst surface.

菲的吸附:
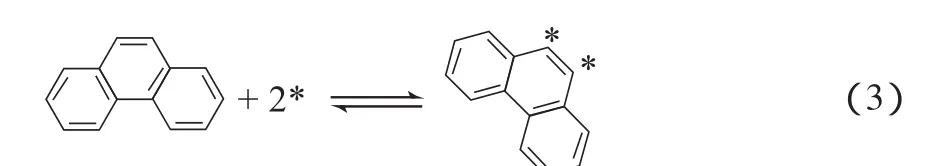
H2的吸附:
表面反应:

DHP的脱附:

考虑到菲和反应产物的吸附项与H2的吸附项相比均很小以及菲和产物之间结构上的相似性和数量的互补性,可以用零反应时菲的吸附项来近似代替菲和反应产物的吸附项[25],因此可将式(1)简化为:

在实验条件下,液相本体中溶解的H2浓度(cH2)不可测,故无法求得KH2,因此将KH2cH2看作一个整体,记为K′H2,将式(6)简化为:
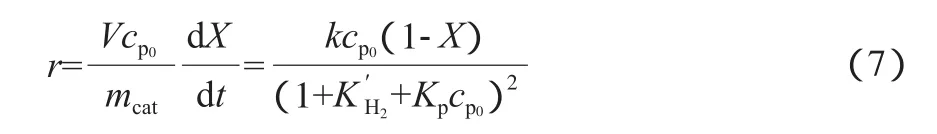
为了求解上述动力学方程,采用四阶变步长的Runge-Kutta方法,并以式(8)为目标优化求解函数,使用Matlab编程求解可得动力学参数。不同的温度和时间下菲催化加氢的转化率见表2,由实验数据求解的动力学参数见表3。

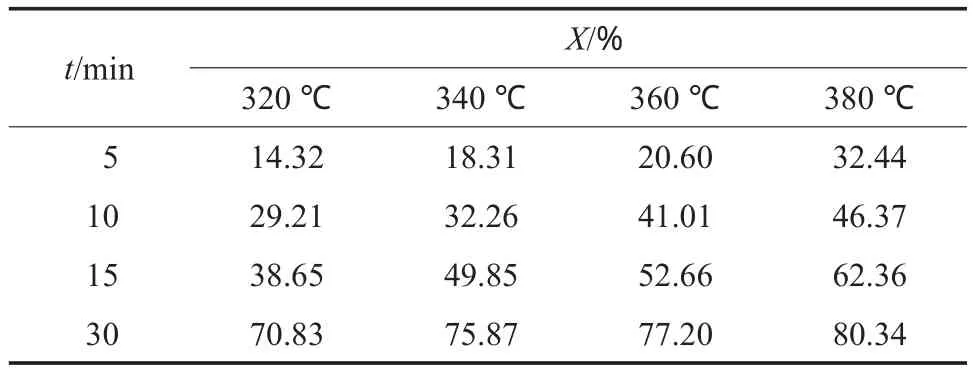
表2 不同的温度和时间下菲催化加氢的转化率Table 2 Conversion of phenanthrene under different reaction temperature and time
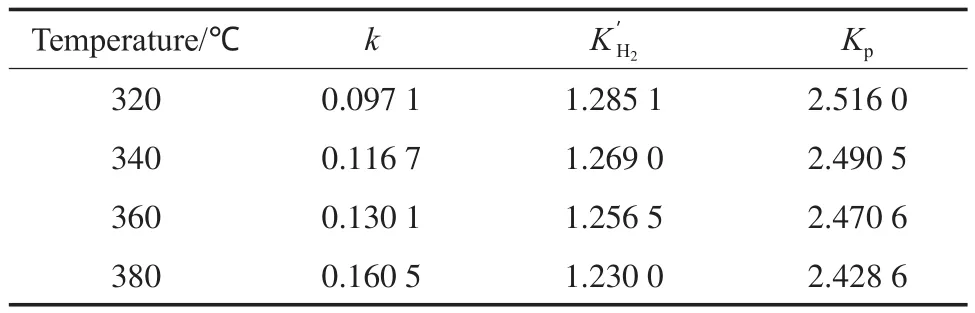
表3 模型动力学参数的估计值Table 3 Estimated kinetics parameters

将各温度下的动力学参数代入动力学方程(7),可得到不同温度下菲催化加氢的转化率,根据模型计算值和实验值得到的不同温度下的动力学曲线见图6。由图6可见,两者十分接近。为考察动力学方程的适用性,对方程进行统计检验,检验结果见表5。表5中ρ2为决定性指标量。

表4 指数前因子、活化能和吸附热Table 4 Pre-exponential factor,apparent activation energy and adsorption heat
A,B,C:pre-exponential factor;Ea:activation energy;Qp:adsorption heat of phenanthrene;Q′H:adsorption heat of hydrogen.
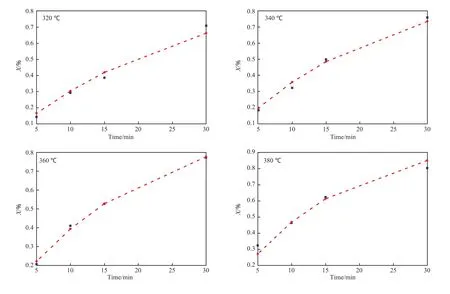
图6 不同温度下菲催化加氢实验值与模型计算值的比较Fig.6 Comparison between the experimental and calculated values at different temperature.Experimental value;Calculated value
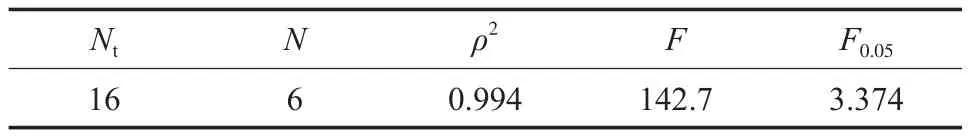
表5 动力学模型统计量Table 5 Statistics of the kinetic model
一般认为,ρ2>0.9和F>10F0.05时模型合适[26]。由表5可见,选择模型的ρ2=0.994,F=142.7,F远大于10F0.05(33.74),所以推导的动力学方程式是合适的,由此计算的动力学参数也是可信的。
3 结论
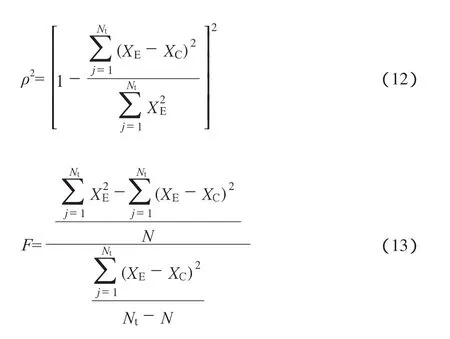
1)在浆态床和NiMo催化剂反应体系中,升高反应温度和氢初压均有利于菲催化加氢反应,提高转化率。在反应温度380 ℃、氢初压9 MPa、反应时间30 min的条件下,菲催化加氢转化率为80.34%。由于NiMo催化剂为弱酸性金属催化剂,故菲很难发生开环裂化反应,主要发生加氢及异构化反应。
2)根据实验条件下反应产物分布数据,建立了动力学模型,并由实验数据计算动力学参数。实验数据与模型计算值的对比结果表明,菲和H2在NiMo催化剂上均以分子态吸附,控制步骤为表面反应,符合Langmuir-Hinshelwood机理,实验值与模型计算值十分吻合。由此求得菲在浆态床内催化加氢的活化能为25.99 kJ/mol。
符 号 说 明
A,B,C 指数前因子
cH2溶解于液相本体中的H2浓度,mol/L
cp反应中菲的浓度,mol/L
cp0零反应时菲的浓度,mol/L
cpi产物i的浓度,mol/L
Ea活化能,kJ/mol
F 方差检验
F0.05显著性水平为5%时相应自由度下的F表值KH2H2的吸附常数
Kp菲的吸附常数
Kpi产物i的吸附常数

k 反应速率常数
mcat实验用催化剂的质量,g Nt实验次数
N 参考个数
Qp菲的吸附热,kJ/mol

R 气体常数,J/(mol·K)r 反应速率,mol/(g·min)T 反应温度,K
t 反应时间,min
V 反应混合物的体积,L X 菲催化加氢转化率,% ρ2决定性指标量
下角标
E 实验值
C 计算值
[1] 黄珏,张德祥,高晋生,等. 云南先锋褐煤液化轻质油的分析[J]. 石油化工,2008,37(11):1206 - 1210.
[2] 黄珏,张德祥,高晋生,等. 神华煤液化轻质油的分离、分析及优化处理[J]. 石油化工,2010,39(8):936 - 940.
[3] 蔺华林,张德祥,高晋生,等. 神华煤直接液化循环油的分析表征[J]. 燃料化学学报,2007,35(1):104 - 108.
[4] 蔺华林,张德祥,高晋生,等. 煤液化油模型分子结构的研究[J]. 石油化工,2007,36(5):513 - 518.
[5] 潘晓磊,杜开欢,张德祥,等. 不同沉积环境煤的低温煤焦油的性质表征[J]. 石油化工,2011,40(7):785 - 789.
[6] 李少冰,徐国财,李德飞,等. 快速热解低温煤焦油的初步分析[J]. 化学工程师,2009,168(9):62 - 63.
[7] Leite L,Benazzi E,Marchal-Georfe N. Hydrocraking of Phenanthrene over Bifunctional Pt Catalysts[J]. Catal Today,2001,65:241 - 247.
[8] 王志合,胡长禄,翁惠新,等. 渣油加氢处理反应动力学模型的建立[J]. 华东理工大学学报,2007,33(4):470 -474.
[9] 水恒福,张德祥,张超群. 煤焦油分离与精制[M]. 北京:化学工业出版社,2007:7 - 9.
[10] Mcmillen D F,Malhotra R,Esther N S. The Case for Induced Bond Scission During Coal Pyrolysis[J]. Fuel,1989,68(3):380 - 386.
[11] 张聪琳,吴倩,李佟茗. 菲加氢裂化催化剂的初步研究[J].化工时刊,2009,23(8):4 - 7.
[12] Beltramone A R,Resasco D E,Alvarez W E,et al. Simultaneous Hydrogenation of Multiring Aromatic Compounds over NiMo Catalyst[J]. Ind Eng Chem Res,2008,47(19):7161 - 7166.
[13] Atsushi I,Jeayoung L,Franck D,et al. Elucidation of Retarding Effects of Sulfur and Nitrogen Compounds on Aromatic Compounds Hydrogenation[J]. Energy Fuels,2003,17(5):1338 - 1345.
[14] Qian W,Yoda Y,Hirai Y,et al. Hydrodesulfurization of Dibenzothiophene and Hydrogenation of Phenanthrene on Alumina-Supported Pt and Pd Catalysts [J]. Appl Catal,A,1999,184(1):81 - 88.
[15] 李会峰,刘峰,刘泽龙,等. 菲在不同加氢催化剂上的转化[J]. 石油学报:石油加工,2011,27(1):20 - 25.
[16] Wada T,Kaneda K,Murata S. Effect of Modifi er Pd Metal on Hydrocracking of Polyaromatic Compounds over Ni-Loaded Y-Type Zeolite and Its Application as Hydrodesulfurization Catalyst[J]. Catal Today,1996,31(1/2):113 - 120.
[17] Kun W,Jun G,Demin H,et al. The Infl uences of Reaction Conditions on Phenanthrene Hydrogenation over NiW/Al2O3Catalyst[J]. Adv Mater Res,2012,512/515:2200 - 2206.
[18] Benazzi E,Leite L,Marchal G N. Hydrocracking of Phenanthrene over Pt/SiO2-Al2O3,Pt/H-Y,Pt/H-β and Pt/H-ZSM-5 Catalysts:Reaction Pathway and Products Distribution[J]. Stud Surf Sci Catal,2000,130:2495 - 2500.
[19] 黄珏. 煤直接液化轻质油的芳烃分离与液化产物再加氢行为研究[D]. 上海:华东理工大学,2011.
[20] 陈茂涛. 二甲醚一步法合成技术研究进展[J]. 应用化工,2001,30(3):1 - 3.
[21] 郭坤宇,王铁峰,邢楚填,等. 浆态床反应器流体力学行为研究及工业应用[J]. 化工学报,2014,65(7):2454 -2464.
[22] Stanislaus A,Cooper B H. Aromatic Hydrogenation Catalysis:A Review [J]. Catal Rev Sci Eng,1994,36(1):75 - 123.
[23] Lemberton J L,Guisnet M. Phenanthrene Hydrconversion as a Potential Test Reaction for the Hydrogenation and Cracking Properties of Coal Hydroliquefaction Catalysts[J].Appl Catal,1984,13:181-192.
[24] 林正国,李奕绯. 高Thiele模的Langmuir-Hinshelwood型动力学方程的有效因子计算[J]. 计算机与应用化学,1990,7(3):185 - 191.
[25] 刘旭光,谢克昌,巩志建,等. 以环己烷为溶剂菲的催化加氢裂解动力学研究[J]. 燃料化学学报,1989,17(2):168 - 174.
[26] 郭世卓,徐泽辉,周飞,等. 环戊烯水合反应本征动力学的研究[J]. 石油炼制与化工,2004,35(9):34 - 37.
(编辑 王 萍)
Kinetics of Catalytic Hydrogenation of Phenanthrene in Slurry Bed
Zhou Ling,Zhao Jing,Zhang Dexiang
(Department of Chemical Engineering for Energy Resources,Key Laboratory of Coal Gasifi cation and Energy Chemical Engineering of Ministry of Education,East China University of Science and Technology,Shanghai 200237,China)
The catalytic hydrogenation of phenanthrene on the NiMo catalyst and its kinetics were investigated in a vibrated slurry bed reactor. The effects of reaction temperature and initial hydrogen pressure on the catalytic hydrogenation were researched,which showed that their increases were benefi cial to the catalytic hydrogenation of phenanthrene. The conversion of phenanthrene reached 80.34% under the conditions of initial hydrogen pressure 9 MPa,380 ℃ and 30 min. It was indicated that,the catalytic hydrogenation reaction of phenanthrene accorded with the Langmuir-Hinshelwood mechanism,phenanthrene and hydrogen were adsorbed on the catalyst surface in molecular state and surface reactions were the control steps in the reaction process. The reaction kinetics equation agreed with the experimental data well. The rationality of the mechanism hypothesis was verifi ed by statistical test. The activation energy of the catalytic hydrogenation is 25.99 kJ/mol under the test conditions.
slurry bed reactor;phenanthrene;catalytic hydrogenation;nickel-molybdenum catalyst;kinetics
1000 - 8144(2015)06 - 0705 - 07
TQ 522.64
A
2015 - 01 - 12;[修改稿日期] 2015 - 01 - 27。
周凌(1990—),男,江苏省张家港市人,硕士生,电话 18818201013,电邮 billzl@126.com。联系人:张德祥,电话 021 -64252367,电邮 zdx@ecust.edu.cn。
国家重点基础研究发展规划项目(2011CB201304)。

