2,4-二氯苯氧乙酸磁性印迹聚合物的制备与吸附性能*
徐 莉,徐小艳,许志锋,黄健文
(1.华南农业大学材料与能源学院,广东广州510642;2.华南农业大学食品学院,广东广州510642;3.衡阳师范学院化学与材料科学系,湖南衡阳421008)
分子印迹是一种制备对特定的模板分子具有专一识别性能聚合物的技术,分子印迹聚合物 (molecularly imprinted polymer,MIP)有可预见的选择性和高度的稳定性,主要应用于色谱分离、固相萃取剂、生物传感器、催化等方面[1-9]。
磁性分子印迹聚合物具有磁性纳米粒子的磁学性能以及MIP的良好分子识别性能,可以在外加磁场作用下实现简单分离,使MIP的应用领域得到进一步拓展[10-12]。
本文以一种广泛使用的阔叶杂草除草剂2,4-二氯苯氧乙酸 (2,4-D)为模板分子,以Fe3O4为磁性粒子,采用油酸包覆的方法,在Fe3O4表面涂上分子印迹聚合物层,从而制得对2,4-D具有特异性识别的磁性分子印记聚合物。通过热重分析仪以及透射电镜对Mag-MIPs进行了表征,采用紫外分光光度法测定了磁性印迹聚合物对模板分子的吸附性能。以Mag-MIPs为固相萃取材料,对模拟水样中的2,4-D进行了分析检测。
1 实验药品
2,4-二氯苯氧乙酸 (2,4-D),天津市大茂化学试剂厂;二甲基丙烯酸乙二醇酯 (EGDMA)、油酸,天津大茂试剂厂;MAA,上海凌峰试剂公司;β-CD,上海博奥生物技术有限公司;偶氮二异丁腈 (AIBN),天津市福晨化学试剂厂;聚乙烯吡咯烷酮 (PVP),国药集团化学试剂有限公司;FeCl3·6H2O和FeCl2·7H2O,广州化学试剂厂;其它试剂均为分析纯。
2 实验方法
2.1 磁性分子印迹聚合物的制备
Fe3O4纳米粒子采用共沉淀法制备[10],磁性分子印迹聚合物的制备参考文献 [11]的方法。将58.5 mg 2,4-D溶解于15 mL二甲基亚砜中,加入0.68 mL MAA,超声搅拌30 min。另取一烧杯加入1.1 g Fe3O4、1 mL油酸和3.4 mL EGDMA,超声搅拌30 min。再将搅拌后的2,4-D溶液加入其中,超声搅拌30 min,得到预聚合溶液。
将上述预聚合溶液倒入250 mL三颈烧瓶中,加入溶有0.2 g PVP的75 mL DMSO/H2O溶液(V(DMSO)∶V(H2O)=9∶1)以及 0.1 g AIBN,60℃水浴恒温搅拌下反应24 h。用磁铁分离出反应产物,并用甲醇洗涤至无油状液滴,置于60℃真空干燥箱中真空过夜,得黑色粉末状固体。加入甲醇/乙酸溶液 (V(甲醇)∶V(乙酸)=9∶1)洗脱至紫外检测无模板分子,得到相应的模板聚合物(magnetic imprinted polymers,Mag-MIPs)。不加入模板分子2,4-D,其它步骤与前述步骤相同,制得相应的空白聚合物 (magnetic non-imprinted polymers,Mag-NIPs),其制备示意图见图1。
2.2 分子印迹聚合物的表征
采用日本电子公司的TEM-1200EX透射电镜观察样品形态,日本岛津Shimadzu UV-2800紫外分析仪测定样品对模板分子的吸附性能,日本岛津Shimadzu DTG-60热重分析仪对样品进行热失重分析。
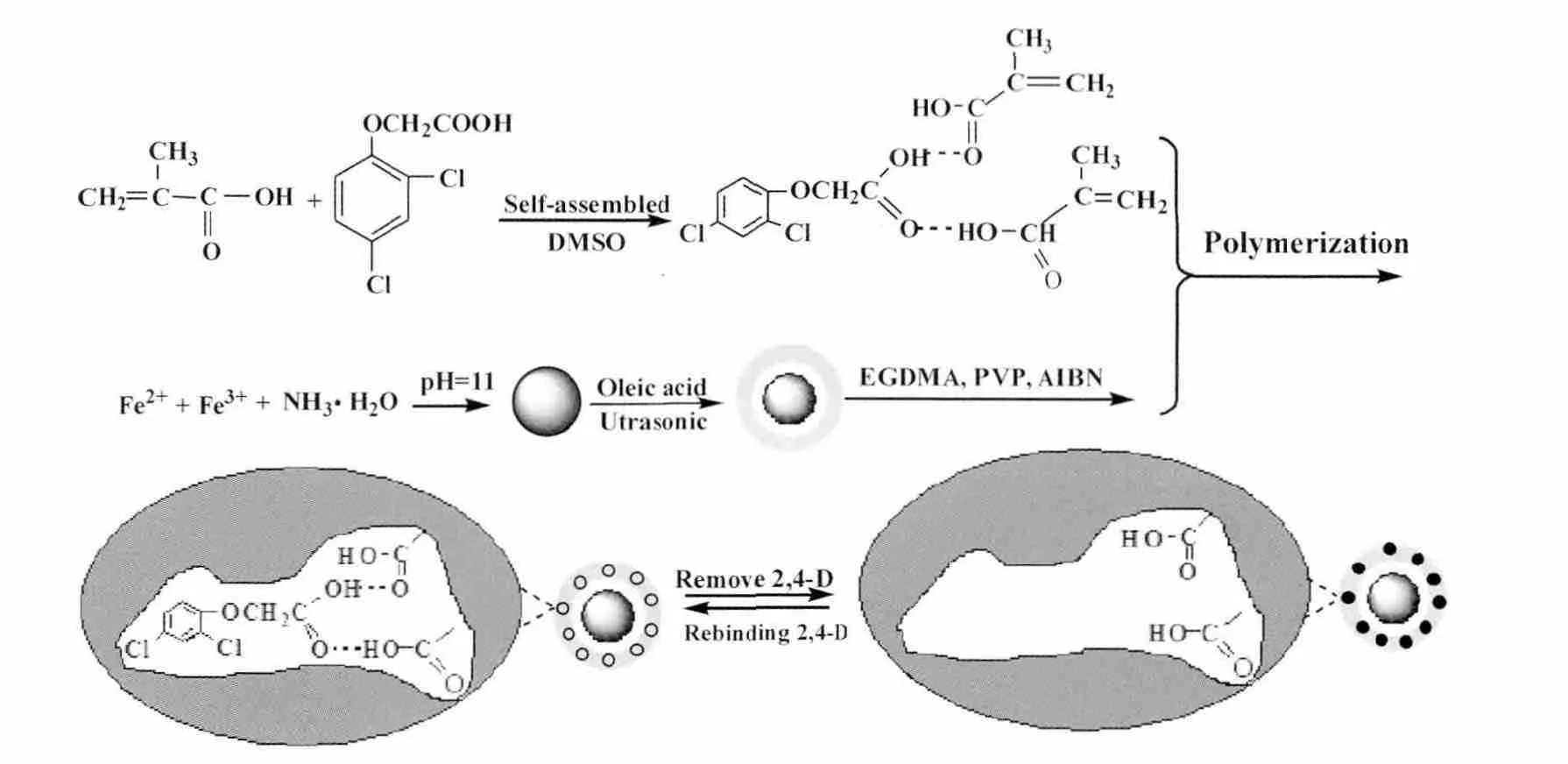
图1 磁性分子印迹聚合物的制备示意图Fig.1 Schematic representation of polymerization of 2,4-D Mag-MIPs
2.3 Mag-MIPs对模板分子的固相萃取性能研究
2.3.1 磁性分子印迹聚合物的吸附性能 分别准确称取Mag-MIPs和Mag-NIPs各10 mg,分别置于50 mL离心管中,加入10 mL质量浓度为50~400 mg/L的2,4-D甲醇溶液,25℃恒温震荡24 h。取出样品,磁铁分离出上层清液,用紫外光谱测定其在284 nm处吸光度值A,计算其吸附量。
2.3.2 Mag-MIPs对2,4-D的固相萃取性能 在宁荫湖 (华南农业大学校内)取一定量的湖水,进行抽滤处理后,置于4℃的冰箱中保存。加入一定量的2,4-D,配得质量浓度为50和200 μg/L的模拟水样。称取一系列50 mg Mag-MIPs置于锥形瓶中,分别加入250 mL的模拟水样,震荡2 h后,用磁铁吸附Mag-MIPs,除去溶剂,加入2 mL甲醇洗涤2次,震荡30 min,除去溶剂。加入3mL甲醇/乙酸 (V(甲醇)∶V(乙酸)=9∶1)溶液洗脱2次,收集洗脱液。使用旋转蒸发仪将溶剂蒸除后加入3 mL甲醇溶解。采用高效液相色谱检测甲醇溶液中2,4-D的含量。色谱条件:色谱柱为Hypersil ODS(250 mm ×4 mm,5 μm);流动相为甲醇/磷酸溶液 (V(甲醇)∶V(φ=0.1%磷酸)=35∶65);流速为1 mL/min;检测波长为282 nm;进样量为 20 μL。
3 结果与讨论
3.1 磁性分子印迹聚合物的表征
对Fe3O4和Mag-MIPs(图2)进行了透射电镜表征,从透射电镜图可知,Mag-MIPs粒子基本呈现有规则的球形,粒径约在10 nm左右。由图可知,Fe3O4粒子聚集现象明显,而Mag-MIPs的聚集程度明显下降。可能是由于乳液聚合过程中PVP起到了明显的分散作用。

图2 Fe3O4(a),Mag-MIP(b)的透射电镜图Fig.2 TEM images of Fe3O4(a),Mag-MIPs(b)
采用热重分析仪在氮气保护下对 Fe3O4和Mag-MIPs进行热失重分析,以研究分子印迹聚合物在磁性粒子上的附着情况。结果如图3所示,Fe3O4在700℃内失重为4.32%,Mag-MIPs的失重主要发生在260~470℃,失重率40.1%,其原因主要是分子印迹聚合物的分解造成。与Fe3O4的失重比较,Mag-MIPs的失重明显,表明约有40%的MIPs包覆在Fe3O4表面。
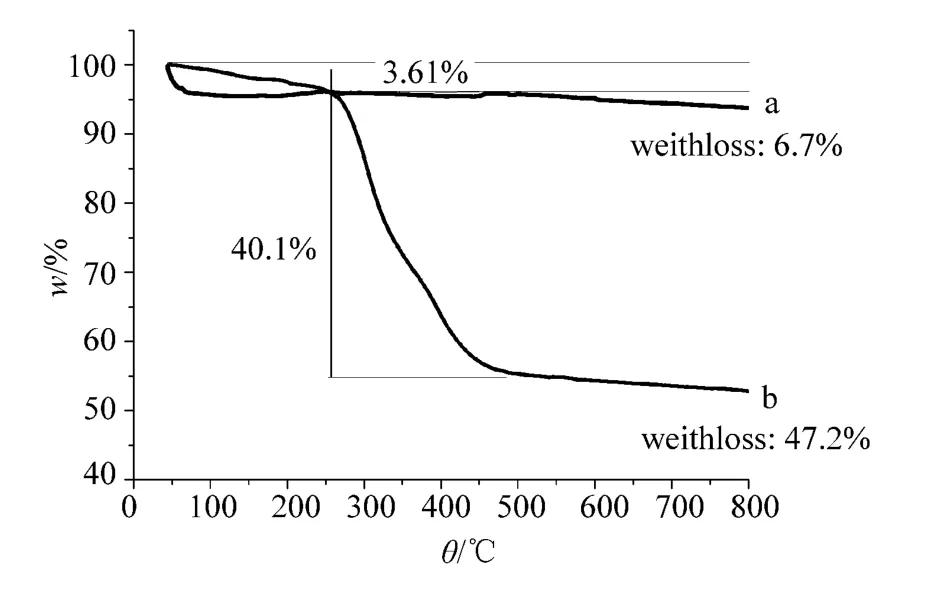
图3 Fe3O4(a)and Mag-MIPs(b)的热失重曲线图Fig.3 TG curves of Fe3O4(a)and Mag-MIPs(b)
采用振动样品磁强计对磁性印迹聚合物的磁学性能进行了表征,图4为Mag-MIPs的磁滞回线示意图,由图可知,Mag-MIPs的饱和磁化强度为14.79 emu/g,说明Mag-MIPs具有磁分离特性,可以利用磁铁对Mag-MIPs进行分离,从而使操作更为简便。三幅插入照片分别表示Mag-MIPs在溶液中的静置状态 (1)、分散状态 (2)、被磁铁吸附后的状态 (3)。
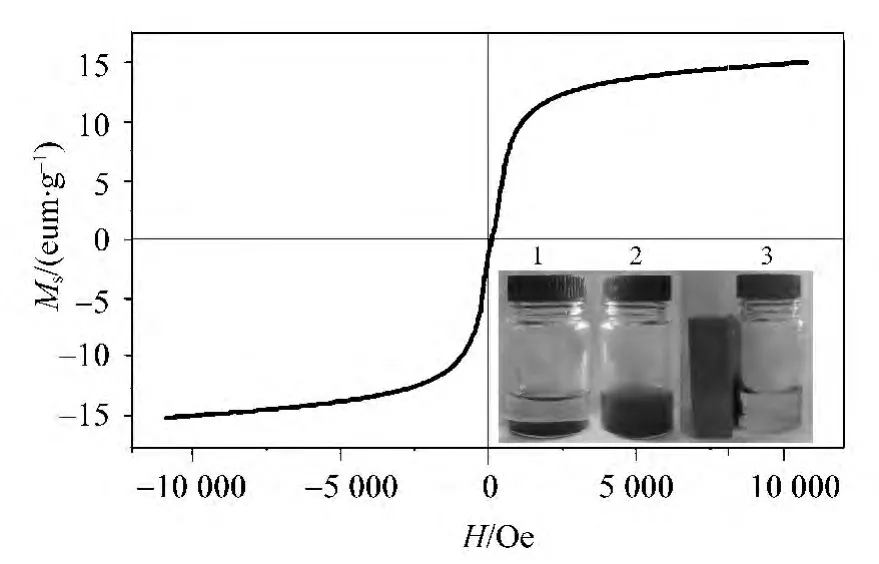
图4 Mag-MIPs在25℃时的磁滞回线Fig.4 Magnetic hysteresis loops of Mag-MIPs at 25℃
3.2 结合实验
利用紫外可见分光光度计测定吸附后的吸光度A,计算得出吸附平衡质量浓度ρt(mg/L)。设样品的起始质量浓度为ρ0(mg/L),样品溶液体积为V(L),Mag-MIPs或Mag-MIPs用量为m(g)。按如下公式计算吸附量Qt(mg/g),并以ρo为横坐标,以Qt为纵坐标作图可得等温吸附曲线[13-14],如图5所示。
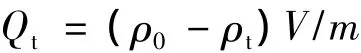
吸附结果如图5所示,在一定质量浓度范围内,Mag-MIPs对底物的吸附量随底物质量浓度增大而增大,由图中可知Mag-MIPs吸附量在一定质量浓度下始终大于Mag-NIPs的吸附量,说明Mag-MIPs对印迹分子具有特异性吸附能力。
3.3 固相萃取的吸附分析
3.3.1 标准曲线测定 在相应的高效液相色谱条件下,以2,4-D甲醇溶液浓度c为横坐标,以峰面积A为纵坐标,得出相应的标准曲线方程。A=-38.08023+7.56971c,R2为0.99932。
3.3.2 固相萃取分析 采用磁性分子印迹聚合物Mag-MIPs作为固相萃取材料,一方面具有磁性材料在分离回收方面的优势,本实验在进行固相萃取实验时,不是采用传统的固相萃取柱,而是将Mag-MIPs置于250 mL锥形瓶中,通过磁铁控制Mag-MIPs的分离回收。另一方面由于分子印迹聚合物对模板分子的特异吸附性能,使得分子印迹的固相萃取条件变得简单。由于氢键作用使得模板分子与Mag-MIPs之间具有较强的特异性结合能力,在去除干扰性杂质和洗脱模板分子时变得容易,不再需要用大量溶剂进行筛选。结果表明,采用2×2.0 mL的甲醇为洗涤剂,2×3.0 mL的甲醇/乙酸(V(甲醇)∶V(φ=5%乙酸)=9∶1)溶液为洗脱剂,能有效地对2,4-D进行分离与富集。
实验表明,不同质量浓度样品在采用Mag-MIPs处理后,2,4-D的峰形明显,检测变得相对容易。图6分别是标准溶液 (a),Mag-MIPs对50 μg·L-1的水样处理前 (b)和处理后 (c)样品的HPLC 分析图,以及 Mag-NIPs对 50 μg·L-1模拟水样进行处理后样品的HPLC图谱 (d)。从样品处理前后的谱图可以看出,所制得的Mag-MIPs对湖水有一定的净化作用。以50 μg·L-1模拟湖水为例,处理前由于受到基质的干扰,与标准样品相同保留时间内出现的峰形复杂 (图b箭头所示之处),很难对目标分析物进行分离与分析检测,用Mag-MIPs处理样品后,由于减少了杂质的干扰,2,4-D变得更加容易检测,且峰面积有显著的增加,Mag-MIPs对目标分析物的富集倍数最高可达到125倍。而采用Mag-NIPs处理水样或未经任何处理进行直接检测均无法检出。
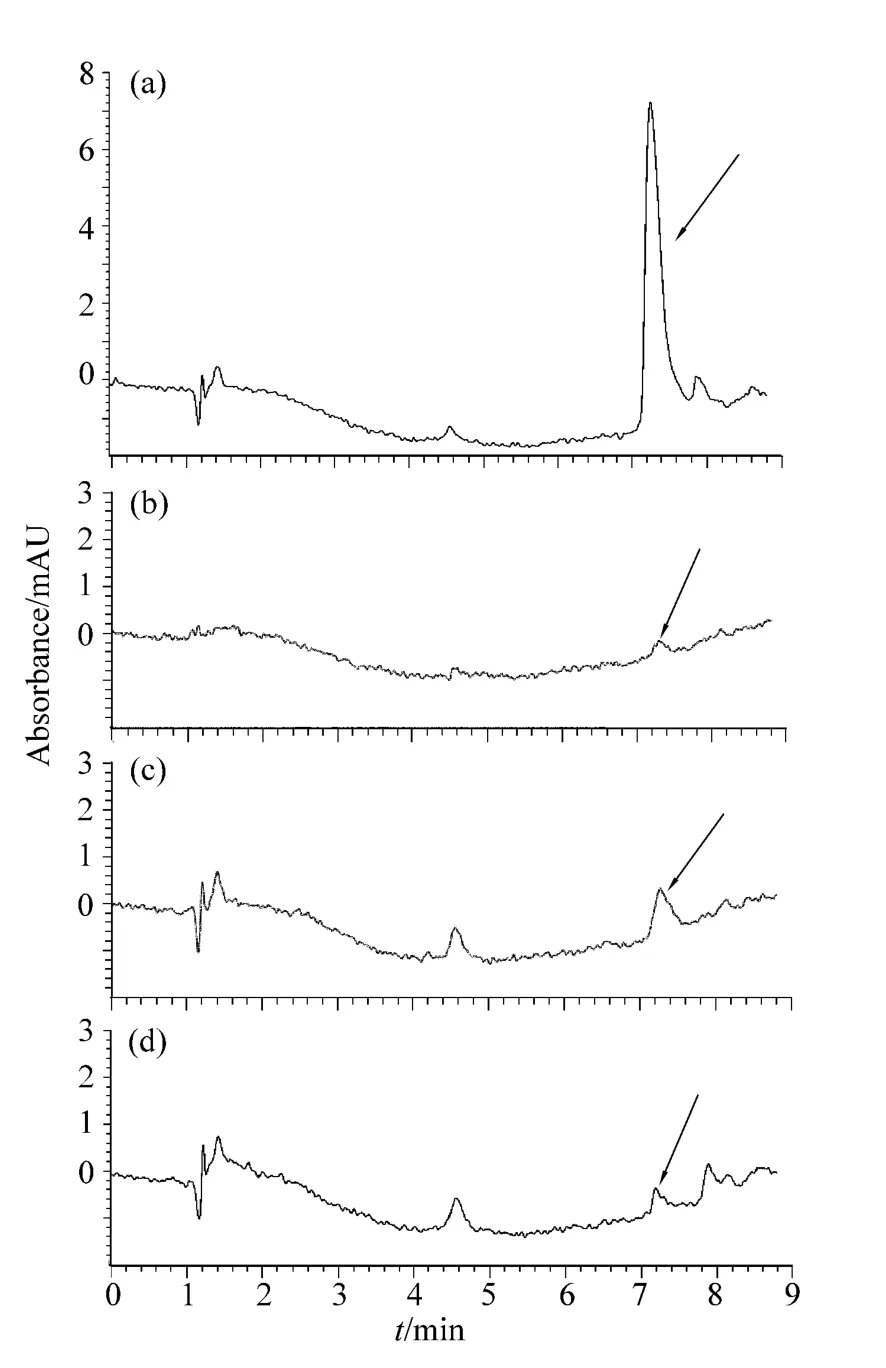
图6 标准溶液(a),含2,4- D 50 μg·L-1的水样(b)及分别采用Mag-MIPs、Mag-NIPs对水样进行处理后的洗脱溶液(c,d)Fig.6 The chromatogram of standard solution(a),water sample with 50 μg·L-12,4- D(b),elution sample after a clean-up by Mag-MIPs-SPE(c),the water sample afer a clean-up by Mag-NIPs-SPE(d).The arrow indicated the peak of 2,4- D
当加标样品质量浓度为 200 μg·L-1的湖水时,回收率31.4% ~34.1%,相对平均偏差为2.78%(n=3)。当加标样品质量浓度为50 μg·L-1的湖水时,回收率91.7% ~110.4%,相对平均偏差为7.38%(n=3)。当加标样品质量浓度过大时,样品中2,4-D的量超过Mag-MIPs对模板分子的吸附能力,也间接表明了Mag-MIPs对模板分子有一定的结合容量。
4 结论
以2,4-二氯苯氧乙酸为模板分子,甲基丙烯酸 (MAA)为功能单体,采用油酸包覆的方法制得对2,4-二氯苯氧基乙酸具有特异性识别的纳米磁性分子印记聚合物 (Mag-MIPs)。热重分析表明,MIPs包覆率为40%左右;紫外吸附实验表明Mag-MIPs对模板分子具有较好的吸附效果,且Mag-MIPs可用磁铁加以分离。以Mag-MIPs为固相萃取材料,能有效的对模拟水样中的2,4-D进行分离纯化,表明Mag-MIPs在样品的分离与分析检测方面具有良好的应用前景。
[1]LIU J,DENG Q,YANG K,et al.Macroporous molecularly imprinted monolithic polymer columns for protein recognition by liquid chromatography[J].J Sep Sci,2010,33:2757-2761.
[2]BAGGIANI C,GIRAUDI G,TROTTA F,et al.Chromatographic characterization of a molecular imprinted polymer binding cortisol[J].Talanta,2000,51:71-75.
[3]ZHU Q H,HE J F,FENG J Y.Optimization of the process parameters of synthesis of vinblastine imprinted polymer[J].Euro Poly J,2007,43:4043-4051.
[4]TAMAYO F G,TURIEL E,MART'IN-ESTEBAN A.Molecularly imprinted polymers for solid-phase extraction and solid-phase microextraction:Recent developments and future trends[J].J Chromatogr:A,2007,1152:32-40.
[5]CHEN Y,FENG T,LI G K,et al.Molecularly imprinted polymer as a novel solid-phase microextraction coating for the selective enrichment of trace imidazolinones in rice,peanut,and soil[J].J Sep Sci,2015,38:301-308.
[6]LI J P,LI Y P,ZHANG Y,et al.Highly sensitive molecularly imprinted electrochemical sensor based on the double amplification by an inorganic Prussian blue catalytic polymer and the enzymatic effect of glucose oxidase[J].Anal Chem,2012,84:1888-1893.
[7]LIU P,ZHANG X H,XU W,et al.Electrochemical sensor based on a carbon nanotube-modified imprinted sol-gel for selective and sensitive determination of β2-agonists[J].Sensor Actuat:B,2012,163:84-89.
[8]TONG K,XIAO S,LI S,et al.Molecular recognition and catalysis by molecularly imprinted polymer catalysts:thermodynamic and kinetic surveys on the specific behaviors[J].J Inorg Organomet P,2008,18:426-433.
[9]WULFF G.Enzyme-like catalysis by molecularly imprinted polymers[J].Chem Rev,2002,102:1-27.
[10]ZHANG X P,CHEN L G,XU Y,et al.Determination of β-lactam antibiotics in milk based on magnetic molecularly imprinted polymer extraction coupled with liquid chromatography-tandem mass spectrometry[J].J Chromatogr:B,2010,878:3421-3426.
[11]GUO W L,HU W,PAN J M,et al.Selective adsorption and separation of BPA from aqueous solution using novel molecularly imprinted polymers based on kaolinite/Fe3O4composites[J].J Chem Engin,2011,171:603-611.
[12]LUO X B,ZHAN Y C,HUANG Y N,et al.Removal of water-soluble acid dyes from water environment using a novel magnetic molecularly imprinted polymer[J].J Hazard Mater,2011,187:274-282.
[13]ZHANG Z H,YANG X,ZHANG H B,et al.Novel molecularly imprinted polymers based on multi-walled carbon nanotubes with binary functional monomer for the solid-phase extraction of erythromycin from chicken muscle[J].J Chromatogr:B,2011,879:1617-1624.
[14]XU Z F,WEN G,KUANG D Z,et al.Selective separation of deltamethrin by molecularly imprinted polymers using a β-cyclodextrin derivative as the functional monomer[J].J Environ Sci Heal:B,2013,48:336-343.

