运动对急性暴露于2,3,7,8-四氯二苯并二恶英大鼠肝组织酶活性的影响
闫会萍,张弛,杜乐,宋小波,丁孝民,魏东洋,许振成,陆一帆,*
1. 北京体育大学运动康复系,北京 100084 2. 环境保护部华南环境科学研究所,广州 510655
运动对急性暴露于2,3,7,8-四氯二苯并二恶英大鼠肝组织酶活性的影响
闫会萍1,张弛1,杜乐1,宋小波1,丁孝民1,魏东洋2,许振成2,陆一帆1,*
1. 北京体育大学运动康复系,北京 100084 2. 环境保护部华南环境科学研究所,广州 510655
为了研究运动对2,3,7,8-四氯二苯并二恶英(2,3,7,8-TCDD)急性暴露大鼠肝组织酶活性的影响,将40只雄性Wistar大鼠随机分为正常对照组(NC)、染毒组(NT)、运动对照组(EC)、运动染毒组(ET)。染毒组(NT组与ET组)腹腔注射10 μg·kg-1(以单位体重计)的TCDD,对照组(NC组与EC组)腹腔注射等量的玉米油;NT、NC组静养4周,ET、EC组运动(尾部负重5%游泳30分钟) 4周。4周后,称重并宰杀大鼠,分离肝组织,称重后-80 ℃保存待测7-乙氧基异吩恶唑酮脱乙基酶(EROD)、7-乙氧基香豆素-O-脱乙基酶(ECOD)及芳香烃羟化酶(AHH)的活性。将数据进行多因素方差分析(MAVONA)处理,结果表明,染毒可降低大鼠体重,增加肝湿重和肝相对重量、增加EROD、ECOD活性;运动可增加大鼠肝相对重量、增加AHH的活性;染毒后运动可降低EROD、ECOD的活性。结论:急性10 μg·kg-1(以单位体重计)TCDD染毒后4周可增加大鼠肝相对重量;4周的运动能有效降低TCDD对EROD、ECOD活性的激活作用。
2,3,7,8-四氯二苯并二恶英(2,3,7,8-TCDD);大鼠;肝毒性;肝微粒体酶;运动
二恶英类化合物(doxin-like compounds, DLC)作为各类工业过程、被污染的气体、水及土壤的副产品,难降解,却易聚集于动物食物链和人体中,对机体危害大[1-3];肝脏是较早大量接触二恶英类化合物的脏器,也是最主要的毒性靶器官。二恶英类化合物中,2,3,7,8-TCDD毒性最强,因其非致癌风险比致癌毒性对人体健康危害的风险更大而被广泛关注[4]。
运动对机体最根本的作用就是使其产生适应的过程。规律的有氧运动能使机体产生良好的适应,有益于身心健康,被国际运动医学会推荐为最佳的健身运动[5]。美国运动医学学会(ACSM)于近年来首先倡导并提出了“运动即良医(exercise is medicine)”。目前,运动已经成为一种医疗模式,成为预防或治疗疾病的一种全新途径。
如何从不同的视角来预防和控制二恶英类物质对人体健康影响的研究还比较匮乏。研究表明,从饮食[6]和药物[7-9]方面进行干预,有助于消除体内二恶英类化合物,但还未见运动干预对二恶英类化合物毒性作用的相关研究。本文通过随机对照试验(randomized controlled trail, RCT)研究运动对急性TCDD暴露后大鼠肝组织微粒体酶活性的影响,为运动预防TCDD肝毒性的有效性提供理论依据。
1 对象与方法(Subjects and methods)
1.1 对 象
8周龄VAF/SPF级雄性Wistar大鼠40只,体重(336.03±16.07) g,购自北京维通利华实验动物中心(许可证编号:SCXK(京)2006-0009)。实验已由清华大学实验动物福利伦理委员会批准。将大鼠适应性饲养1周后随机分为4组:正常对照组(Normal Control, NC)、染毒组(Normal Toxic, NT)、运动对照组(Exercise Control, EC)及运动染毒组(Exercise Toxic, ET),各组分笼饲养,饲养温度(22.75±1.33) ℃,湿度为(50.57±7.53)%,昼夜交替时间为12 h,自由饮用水和食物,以国家标准啮齿类动物常规饲料喂养。饲养室、用具等定期消毒灭菌。
1.2 给药剂量、方式及运动强度的选择
将2,3,7,8-TCDD溶于玉米油中,染毒(NT与ET)组腹腔注射10 μg·kg-1(以单位体重计)的2,3,7,8-TCDD(购自美国Cambridge Isotope Laboratories Inc,纯度99%),对照(NC与EC)组腹腔注射等量的玉米油。NT、NC组静养4周,ET、EC组运动4周。运动方式为尾部负重5%进行游泳(尾根套负重螺丝),每周游泳6天,每天游泳30 min,水温为(32±2) ℃。游泳水桶直径150 cm,水深75 cm。每组大鼠每天游泳时间固定,于每周称重后调整负重。
1.3 实验取材
取材前大鼠禁食8 h,称重并记录,用20%(w/v)的乌拉坦,按2 g·kg-1(以单位体重计)腹腔注射麻醉大鼠,快速剥离肝脏组织,用0.9%(w/v)生理盐水浸洗,吸干,称重并记录,装入事先标号的Eppendorf管中,待测组织酶活性。
1.4 指标测试方法
酶活性采用荧光分光光度法测试,所用试剂盒购自北京华英生物技术研究所,主要仪器为RF540型荧光分光光度计(日本岛津公司)。7-乙氧基异吩恶唑酮脱乙基酶(7-ethoxyresorufin O-deethylase, EROD)、7-乙氧基香豆素-O-脱乙基酶(7-ethoxycoumarin O-deethylase, ECOD)的活力单位用每克蛋白产生的异吩恶唑(Resorufin)的nmol数表示;芳香烃羟化酶(aryl hydrocarbon hydroxylase, AHH)的活力单位规定为每分钟产生1 pmol的3-羟基苯并[a]芘为一个酶活力单位(U)。
1.5 数据处理

2 结果(Results)
2.1 大鼠体重、肝湿重和肝相对重量
大鼠体重、肝湿重和肝相对重量结果见表1,结果显示,运动、染毒对大鼠体重(F=0.644,P=0.428,偏Eta方=0.019)、肝湿重(F=0.194,P=0.663,偏Eta方=0.006)和肝相对重量(F=1.211,P=0.279,偏Eta方=0.034)的影响无可靠的交互效应;运动对肝相对重量(F=7.273,P=0.011,偏Eta方=0.176)有可靠的主效应,运动可非常显著增加肝相对重量,运动对大鼠体重(F=0.000,P=0.987,偏Eta方=0.000)、肝湿重(F=3.850,P=0.058,偏Eta方=0.102)无可靠的主效应;染毒对大鼠体重(F=10.537,P=0.003,偏Eta方=0.237)、肝湿重(F=55.157,P=0.000,偏Eta方=0.619)和肝相对重量(F=149.692,P=0.000,偏Eta方=0.815)有可靠的主效应,染毒可非常显著降低大鼠体重、增加肝湿重和肝相对重量。
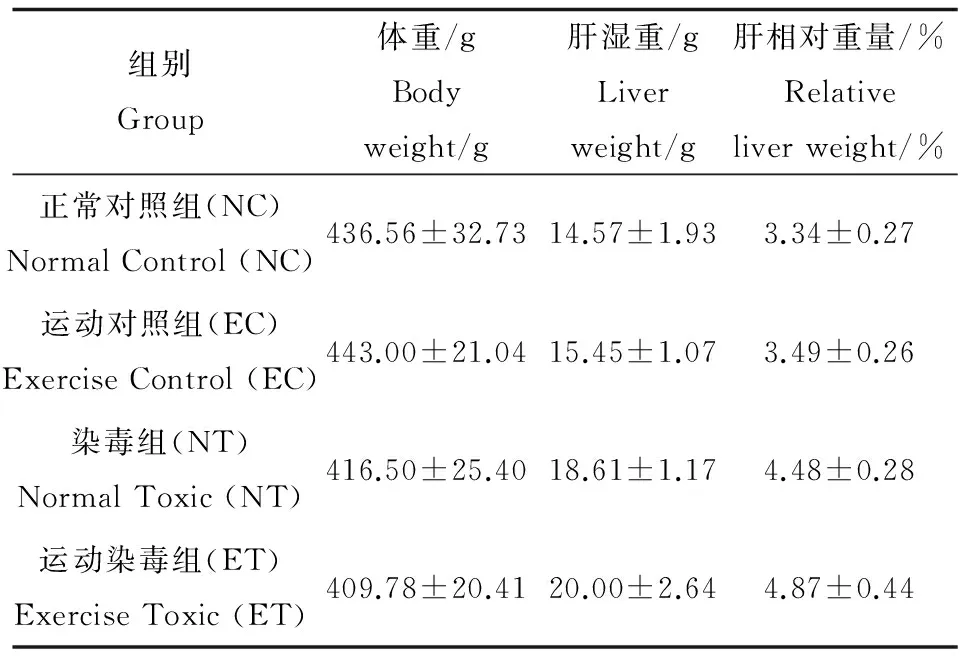
表1 运动对2,3,7,8-TCDD染毒大鼠肝绝对 重量和相对重量的影响Table 1 The effects of exercise on the liver weight and relative liver weight of rat after exposure to 2,3,7,8-TCDD
2.2 肝组织EROD活性
肝组织EROD活性水平见图1,结果显示,运动对EROD(F=3.815,P=0.059,偏Eta方=0.096)活性的影响无可靠的主效应,染毒对EROD(F=9.907,P=0.003,偏Eta方=0.216)活性的影响有可靠的主效应,使EROD活性显著增高;运动、染毒对大鼠肝组织EROD(F=13.377,P=0.001,偏Eta方=0.271)活性的影响有可靠的交互效应,染毒后运动可非常显著降低EROD活性。

图1 运动对2,3,7,8-TCDD染毒大鼠肝组织 EROD活性的影响Fig. 1 The effect of exercise on the activity of liver EROD of rat after exposure to 2,3,7,8-TCDD
2.3 肝组织ECOD活性
肝组织ECOD活性水平见图2,结果显示,运动对ECOD(F=1.545,P=0.222,偏Eta方=0.041)活性的影响无可靠的主效应,染毒对ECOD(F=15.509,P=0.000,偏Eta方=0.301)活性的影响有可靠的主效应,使ECOD活性显著增高;运动、染毒对大鼠肝组织ECOD(F=16.237,P=0.000,偏Eta方=0.311)活性的影响有可靠的交互效应,染毒后运动可非常显著降低ECOD活性。

图2 运动对2,3,7,8-TCDD染毒大鼠肝组织 ECOD活性的变化Fig. 2 The effect of exercise on the activity of liver ECOD of rat after exposure to 2,3,7,8-TCDD
2.4 肝组织AHH活性
肝组织AHH活性水平见图3,结果显示,运动对AHH(F=12.896,P=0.001,偏Eta方=0.264)活性的影响有可靠的主效应,运动可显著升高AHH活性;染毒对AHH(F=0.023,P=0.881,偏Eta方=0.001)活性的影响无可靠的主效应。运动、染毒对大鼠肝组织AHH(F=1.894,P=0.177,偏Eta方=0.050)活性的影响无可靠的交互效应。

图3 运动对2,3,7,8-TCDD染毒大鼠肝组织 AHH活性的变化Fig. 3 The effect of exercise on the activity of liver AHH of rat after exposure to 2,3,7,8-TCDD
3 讨论(Discussion)
3.1 运动对TCDD大鼠体重、肝湿重和肝相对重量的影响
体重是反映机体营养状态最简单、最直接的指标,也是衡量健康状况的重要标志之一;肝相对重量(肝脏的湿重与体重的百分比)可作为评价肝毒性的一个参数[10];急性二恶英中毒后,体重的降低与剂量没有效应关系,而大鼠肝脏相对重量明显增加[11-12]。本研究中,染毒可非常显著降低大鼠体重、增加肝湿重和肝相对重量,染毒使肝相对重量的增加可能为肝肿大的原因[13];运动使肝相对重量显著增加,运动后肝湿重增加幅度比体重增加幅度大是其可能原因;染毒和运动对大鼠肝相对重量的增加无交互影响作用。
3.2 运动对TCDD大鼠肝组织微粒体氧化酶活性的影响
研究表明,肝脏是2,3,7,8-TCDD发挥毒性作用的主要靶器官,也是机体进行代谢及发挥生物转化作用的主要器官[4]。微粒体氧化酶系存在于细胞的光面内质网上,在生物转化的氧化还原反应中占有重要地位,是需细胞色素P450(CYP450)的氧化酶系,属于易被诱导的酶。目前在环境生物学中广泛研究的微粒体氧化酶主要有AHH、ECOD及EROD,主要分布于肝脏,参与生物体内源性物质和外源性物质(如药物、环境致癌物等)的生物转化,其中AHH是人体中由遗传所决定的一种酶,在肝组织和肺组织含量较高,是预防医学中研究环境污染与癌症关系的常用指标之一。
TCDD具有亲脂性,其高度脂溶性的特点使其极易透过细胞膜进入细胞浆,在胞浆内作为配体与转录因子芳香烃受体(aryl hydrocarbon receptor, AHR)结合后,以与固醇类激素的相似作用机制发挥毒性作用。AHR几乎是TCDD诱发所有毒性作用的必经之路,通过与AHR结合进入细胞核内,结合到靶基因的特异反应序列,诱导其转录[14]。研究表明,TCDD通过与AHR结合来诱导CYP1A1、CYP1A2等与毒物代谢有关的微粒体氧化酶[15-18];CYP1A对污染物的特征反应是诱导,CYP1A1主要影响EROD的活性,也能影响AHH的活性,CYP1A2主要影响ECOD的活性。在肝微粒体氧化酶系中,ECOD比EROD更敏感,因为肝细胞被诱导前,CYP1A1是被抑制的。
当急性染毒剂量为0.1 μg·kg-1TCDD时,24 h后就能诱导大鼠肝脏CYP1A1基因的表达[19]。急性2,3,7,8 - 四溴二苯并二恶英(TBDD)染毒剂量为10 μg·kg-1及以上时,肝脏AHH、ECOD、EROD活性持续增加,肝相对重量增加,说明肝微粒体单氧酶是TBDD影响肝脏功能的最早的敏感指示剂(TBDD的急性肝毒性与2,3,7,8-TCDD的毒性接近)[12]。,急性10 μg·kg-1TCDD染毒后4周,可致大鼠肝组织EROD、ECOD活性非常显著升高,表明10 μg·kg-1TCDD染毒后4周诱导大鼠肝脏CYP1A1、CYP1A2,从而使肝组织EROD、ECOD活性显著升高。由于肝细胞在被诱导前,CYP1A1是被抑制的,因此急性10 μg·kg-1TCDD染毒后4周AHH活性未出现明显变化可能与染毒时间和染毒剂量有关。
运动过程中机体会产生相应的反应和适应,反应可由急性或是次急性运动所产生,适应则是一个长期系统运动的结果,表现为机体在功能上和形态结构上的持久性变化,此变化正是体质增强和训练水平提高的基础;而运动对机体最根本的作用就是使其产生适应的过程。研究表明,规律的有氧运动能使机体产生良好的适应[5],有氧运动能提高肝脏抗氧化酶活性,保护肝脏免受活性氧和能量损耗导致的损伤[20]。10 μg·kg-1TCDD染毒后运动4周,可非常显著降低EROD、ECOD活性,提示有氧运动可有效抵抗TCDD对CYP1A1和CYP1A2的诱导,有氧运动对体内毒物分布及代谢途径的影响研究目前还鲜有报道,本研究认为运动对机体TCDD毒性的短期作用可能是通过提高机体的代谢能力,从而减少体内毒物的浓度,而长期作用则可能是提高肝脏抗氧化酶活性,减轻肝脏损伤,具体机制有待进一步研究。
综上所述,急性10 μg·kg-1(以单位体重计)TCDD染毒后4周可增加大鼠肝相对重量,并诱导大鼠肝组织CYP1A的活性,使肝组织EROD、ECOD活性显著升高;而运动能有效抵抗TCDD对CYP1A1和CYP1A2的诱导,从而减少其对EROD、ECOD活性的激活作用。
致谢:特别感谢环境保护部华南环境科学研究所许振成研究员、国家体育总局运动医学研究所方子龙研究员及北京体育大学运动人体科学学院石丽君教授的支持和帮助。
[1] Gordon M. Dioxin characterization, formation and minimisation during municipal solid waste (MSW) incineration: Review [J]. Chemical Engineering Journal, 2002, 86(3): 343-368
[2] Buekens A, Huang H, Stieglitz L. Dioxins from the sintering process. (I) Particle characterisation and SEM/wet analysis of samples [J]. Organohalogen Compounds, 1999, 41: 109-112
[3] Passarini B, Infusino S D, Kasapi E. Chloracne: Still cause for concern [J]. Dermatology, 2010, 221(1): 63-70
[4] 杨永滨, 郑明辉, 刘征涛. 二恶英类毒理学研究新进展[J]. 生态毒理学报, 2006, 1(2): 105-111
Yang Y B, Zheng M H, Liu Z T. Researching advancement of the dioxins toxicology [J]. Asian Journal of Ecotoxicology, 2006, 1(2): 105-111 (in Chinese)
[5] 王艳. 有氧运动对非酒精性脂肪肝病干预效果的研究[D]. 北京: 北京体育大学, 2006: 12
[6] Ciftci O, Tanyildizi S, Godekmerdan A. Protective effect of curcumin on immune system and body weight gain on rats intoxicated with 2, 3, 7, 8-Tetrachlorodibenzo-p-dioxin (TCDD) [J]. Immunopharmacology and Immunotoxicology, 2010, 32(1): 99-104
[7] 孔元原, 蒋明玉, 蔡德培. 滋肾阴泻相火中药对环境内分泌干扰物染毒大鼠生殖器官雌激素受体表达的影响[J]. 中国中西医结合杂志, 2010, 30(3): 312-316
Kong Y Y, Jiang M Y, Cai D P. Effects of Chinese herbs for nourishing shen-yin and removing xiang-fire on estrogen receptor expression in reproductive organ of rats contaminated with environmental endocrine disruptor [J]. Chinese Journal of Integrated Traditional and Western Medicine, 2010, 30(3): 312-316 (in Chinese)
[8] 尹海萍, 徐建平, 周显青. 维生素E对2,3,7,8-四氯二苯并二恶英急性染毒小鼠卵巢内分泌及其结构的影响[J]. 动物学研究, 2008, 29(3): 265-269
Yin H P, Xu J P, Zhou X Q. Effects of vitamin E on reproduction endocrine and ovary structures in mice acutely treated with TCDD [J]. Zoological Research, 2008, 29(3): 265-269 (in Chinese)
[9] 周显青, 王晓辉, 徐建平, 等. 维生素 E 对 TCDD 染毒小鼠白细胞介素和 T 细胞亚群的影响[J]. 动物学报, 2007, 53(5): 884-891
Zhou X Q, Wang X H, Xu J P, et al. Effects of vitamin E on interleukin and T cell subsets in the mice treated by 2,3,7,8-tetrachlorodibenzon-p-dioxin[J]. Acta Zoological Sinica, 2007, 53(5): 884-891 (in Chinese)
[10] Cattley R C, Marsman D S, Popp J A. Age-related susceptibility to the carcinogenic effect of the peroxisome proliferator WY-14,643 in rat liver [J]. Carcinogenesis, 1991, 12(3): 469-473
[11] Boverhof D R, Burgoon L D, Tashiro C, et al. Temporal and dose-dependent hepatic gene expression patterns in mice provide new insights into TCDD-mediated hepatotoxicity [J]. Toxicological Sciences, 2005, 85(2):1048-1063
[12] Ohbayashi H, Sasaki T, Matsumoto M, et al. Dose-and time-dependent effects of 2, 3, 7, 8-tetrabromodibenzo-p-dioxin on rat liver [J]. The Journal of Toxicological Sciences, 2007, 32(1): 47-56
[13] Vanbirgelen A P J M, Vanderkolk J, Fase K M, et al. Subchronic dose-response study of 2, 3, 7, 8-tetrachlorodibenzo-p-dioxin in female Sprague-Dawley rats [J]. Toxicology and Applied Pharmacology, 1995, 132(1): 1-13
[14] Schneider A J, Branam A M, Peterson R E. Intersection of AHR and Wnt signaling in development, health, and disease [J]. International Journal of Molecular Sciences, 2014, 15(10): 17852-17885
[15] Wang Y, Zheng R, Zuo Z, et al. Relation of hepatic EROD activity and cytochrome P4501A level in Sebastiscus marmoratus exposed to benzo [a] pyrene [J]. Journal of Environmental Sciences, 2008, 20(1): 101-104
[16] Beliaeff B, Burgeot T. Sampling design optimization for EROD measurements in fish [J]. Marine Ecology Progress Series, 1997, 153: 239-246
[17] Payne J F, Fancey L L, Rahimtula A D, et al. Review and perspective on the use of mixed-function oxygenase enzymes in biological monitoring [J]. Comparative Biochemistry and Physiology Part C, 1987, 86(2): 233-245
[18] Nito S, Todoroki N, Misumi M, et al. Biological evaluation of the pollution of rivers flowing into Tokyo Bay with the 7-ethoxycoumar in O-deethylase (ECOD) activity induced by river sediment extracts in HepG2 cells [J]. Journal of Health Science, 2001, 47(2): 118-122
[19] 刘云儒, 汤乃军, 任大林. 2,3,7,8-四氯二苯并二恶英对大鼠肝脏芳烃受体和细胞色素P4501A1 mRNA的诱导[J]. 中华劳动卫生职业病杂志, 2003, 21(6): 417-419
Liu Y R, Tang N J, Ren D L. Induction of aryl hydrocarbon receptor and CYP1A1 mRNA by 2,3,7,8-tetrachlorodibenzo-p-dioxin in rat liver [J]. Chinese Journal of Industrial Hygiene and Occupational Diseases, 2003, 21(6): 417-419 (in Chinese)
[20] 马国栋, 宋光春. 有氧运动下调的脂肪肝小鼠肝脏UCP2表达对肝脏ATP含量及抗氧化功能的影响[J].西安体育学院学报, 2008, 25(1): 58-62
Ma G D, Song C G. The effects of aerobic exercise-induced down-regulation of UCP2 on content of ATP and antioxidative function in liver in hyperlipid diet-induced mice [J]. Journal of Xi’An Physical Education University, 2008, 25(1): 58-62 (in Chinese)
◆
The Effect of Exercise on the Activity of Liver Microsomal Oxidase in 2,3,7,8-Tetrachlorodibenzo-p-dioxin(TCDD)-Exposed Rats
Yan Huiping1, Zhang Chi1, Du Le1, Song Xiaobo1, Ding Xiaomin1, Wei Dongyang2, Xu Zhencheng2, Lu Yifan1,*
1. Sport Rehabilitation College, Beijing Sport University, Beijing 10043, China 2. South China Institute of Environmental Sciences of Ministry of Environmental Protection, Guangzhou 510655, China
14 December 2013 accepted 15 November 2014
The aim of the present study was to investigate the effects of exercise on the activity of liver microsomal oxidase in acute 2,3,7,8-TCDD-exposed rats. Forty male Wistar rats were randomly divided into four groups: normal control (NC), normal toxic (NT), exercise control (EC), and exercise toxic (ET). The rats in NC and ET groups were intraperitoneal injection of 2,3,7,8-TCDD (10 μg·kg-1); the NC and EC animals were administered with equivalent volume of coin oil, and the rats in exercise groups were submitted to swimming for 30 min·d-1with 5% weights attached to tails. After 4 weeks, the rats were sacrificed and the livers were immediately isolated and weighted. The lobe of each liver was kept at -80 °C for detecting the activity of hepatic microsomal enzymes. The results were statistically analyzed using MANOVA. A decreased body weight together with increased liver weight, relative liver weight, and the activities of 7-ethoxyresorufin O-deethylase (EROD) and 7-ethoxycoumarin O-deethylase (ECOD) were observed in toxic group; an increased relative liver weight and the activity of aryl hydrocarbon hydroxylase (AHH) were observed in exercise group; and exercise could effectively prevent the activation of 2,3,7,8-TCDD on the activities of EROD and ECOD. The results suggest that acute exposure to 2,3,7,8-TCDD can increase the relative liver weight, and exercise can effectively prevent the activation of 2,3,7,8-TCDD on the activities of EROD and ECOD.
2,3,7,8-TCDD; rat; hepatotoxicity; liver microsomal oxidase; exercise
北京体育大学自主科研课题(2014YB015);全国重点地区环境与健康专项调查(21111011101EHH(2011)-505)
闫会萍(1975-),女,博士,研究方向为运动与健康,E-mail: yanhp000@126.com;
*通讯作者(Corresponding author), E-mail: fanluyi@hotmail.com
10.7524/AJE.1673-5897.20131214001
2013-12-14 录用日期:2014-11-15
1673-5897(2015)2-204-06
X171.5
A
陆一帆(1963—),男,运动生理学博士,教授,博士研究生导师,主要研究方向为运动训练监控、社区体育健身、运动与健康。
闫会萍, 张弛, 杜乐, 等. 运动对急性暴露于2,3,7,8-四氯二苯并二恶英大鼠肝组织酶活性的影响[J]. 生态毒理学报, 2015, 10(2): 204-209
Yan H P, Zhang C, Du L, et al. The effect of exercise on the activity of liver microsomal oxidase in 2,3,7,8-tetrachlorodibenzo-p-dioxin(TCDD) -exposed rats [J]. Asian Journal of Ecotoxicology, 2015, 10(2): 204-209(in Chinese)

