二氧化钛纳米颗粒与重金属联合毒性研究进展
王晶晶,王希楠,代慧,刘赟,许安,*
1. 中国科学技术大学 环境科学与光电技术学院,合肥 230026 2. 中国科学院合肥物质科学研究院 中国科学院&安徽省离子束生物工程学重点实验室,合肥 230031
二氧化钛纳米颗粒与重金属联合毒性研究进展
王晶晶1,2,王希楠2,代慧2,刘赟2,许安2,*
1. 中国科学技术大学 环境科学与光电技术学院,合肥 230026 2. 中国科学院合肥物质科学研究院 中国科学院&安徽省离子束生物工程学重点实验室,合肥 230031
二氧化钛纳米颗粒(TiO2-NPs)在广泛使用的同时也带来了潜在的环境污染、生态和健康风险。随着TiO2-NPs的废弃量逐年上升,其与环境中重金属的联合毒性特别是对生态环境的影响逐渐引起国内外研究者重视。结合近几年国内外对二者相互作用的研究,重点综述TiO2-NPs与铅(Pb)、镉(Cd)和砷(As)之间的联合毒性,并对存在的问题和今后的关注重点进行探讨。
二氧化钛纳米颗粒;重金属;铅;镉;砷;联合毒性
纳米技术被誉为是21世纪三大支柱技术之一。据推算,从2011年到2020年,全球纳米物质的工业生产总量将从400 t增长到58 000 t[1],到2015年,该领域的产值将达到1万亿美元[2]。在众多纳米材料中,二氧化钛纳米颗粒(TiO2-NPs)由于具有纳米尺度效应、表面效应、量子尺寸效应、宏观量子隧道效应、光催化效应、吸收紫外线能力强等特点,被广泛应用于各个领域[3],如日化用品,抗菌材料,涂料,陶瓷,污水处理等。
研究发现,TiO2-NPs在生产、使用和废弃的过程中将不可避免地进入环境和生态系统,从而引发多种生物学效应。目前,TiO2-NPs的毒性研究多限于单一TiO2-NPs在实验室条件下的毒性作用,然而在实际自然环境中,TiO2-NPs与多种污染物往往同时存在并发生相互作用。TiO2-NPs相对于宏观颗粒物具有更大的比表面积,一旦进入环境中,可显著影响和改变环境中污染物的环境行为,或导致污染物生物有效性和毒性效应的改变[4]。TiO2-NPs因其比表面积高和独特的表面化学性质常作为吸附剂来处理水环境中的重金属以及有机污染物,同时水体也被认为是TiO2-NPs在环境中循环积聚的最终场所,因此其可与重金属充分接触,并有可能吸附大量重金属,如Pb、Cd和As,成为毒物载体,增大其在水生生物体内总量,进而放大毒性作用。目前,关于重金属与TiO2-NPs载体之间相互作用的研究尚处起步阶段,其联合毒性亟待深入研究。
本文回顾了我国几种重金属污染现状,并以此为基础结合近年来国内外研究状况,重点探讨TiO2-NPs与Pb、Cd和As的联合毒性以及其对于生态和人类健康的影响,并总结目前研究中尚存的问题以及今后应关注的焦点。
1 TiO2-NPs的单一毒性(Individual toxicity ofTiO2-NPs)
随着越来越多的TiO2-NPs的合成及使用,其中部分纳米颗粒将会被有意或者无意地释放到环境中,并在环境中扩散[5-6]。资料显示,在瑞士多个地区的流经城市建筑物表面的雨水和附近河流[7]、美国亚利桑那州中部的污水处理厂的污泥中[8]已检测出TiO2-NPs等。鉴于纳米材料对生态环境的潜在威胁,其毒性研究已引起学术界的关注。
围绕TiO2-NPs对环境及健康的影响已开展一系列研究工作。流行病学研究显示,生产TiO2-NPs的工人和普通人相比更易患肺癌[9]。尽管后期有相关实验表明TiO2-NPs暴露与肺癌之间并没有显著相关性[10],但其潜在危害及促进作用不可否认。动、植物研究显示,5 g·kg-1体重的TiO2-NPs暴露剂量会对老鼠体内组织产生明显的损伤[11]。TiO2-NPs可使雌性小鼠卵巢损伤导致生殖功能障碍[12]。TiO2-NPs可显著影响秀丽隐杆线虫生长发育,如导致发育迟缓和畸形等[19]。TiO2-NPs可以通过减少导水率抑制植物生长;另有研究发现,TiO2-NPs可通过加强叶的光合作用和根部固氮作用来提高植物生长[13]。水生态环境研究显示,环境中的生物,尤其是直接与环境交换物质的水生生物如藻类、水溞、鱼类等,被认为更容易受到TiO2-NPs的损伤。研究发现,在自然水中,低浓度的TiO2-NPs(16 mg·L-1)便可抑制藻类生长[14]。TiO2-NPs可在水溞体内富集[15],可通过鳃进入鱼体内,而一旦进入血液系统,TiO2-NPs便可以转移至体内其他器官[16]。TiO2-NPs处理虹鳟后,鳃和肠道中Na+K+-ATPase的活性显著性下降,鱼鳃中谷胱甘肽水平显著性上升等[17]。TiO2-NPs通过吸附、摄食等途径积累在水生生物体内并通过食物链层层放大,不可避免的影响到人类健康[18]。TiO2-NPs的尺寸、形状、聚集程度、表面修饰、化学组成等多种物理化学因素都会影响其毒性[2,9,19]。
大量针对TiO2-NPs毒性的研究结果表明,对纳米材料安全应用的考虑应得到重视,而目前对于TiO2-NPs环境行为的具体机制及其对整个生态系统的影响尚未清楚,有待进一步研究。
2 TiO2-NPs与Pb的联合毒性(Combined toxicityof TiO2-NPs and Pb)
Pb是已知危害最大的重金属污染物之一。据世界卫生组织(WHO)报告数据显示,Pb污染造成的疾病负担在总疾病负担中占0.9%,位列全部疾病负担分类的第16位,且高发于不发达国家[20]。我国环保总局数据表明:我国近海2/3的海域Pb超过国家标准,大约1/5的耕地受到Pb化合物污染。在开采、冶炼、水泥制造、煤、汽油燃烧等过程中,Pb会大量释放到环境中。Pb具有很强的积累作用及不可逆特性,在环境中性质稳定,不易消除,对环境生物和人体健康具有严重危害。针对各类人群的研究表明,儿童是低剂量慢性Pb暴露的敏感人群,Pb暴露会对儿童的智力、生长发育造成不可逆的损害[21]。对成人而言,Pb表现出肾毒性,可导致肾功能衰竭、痛风和高血压等疾病的发生,血铅水平与血压呈正相关关系[22],进而可能引发心血管疾病[23]。在环境中,Pb对多种海洋单细胞藻类有毒性作用[24]。鉴于TiO2-NPs的广泛使用和排放及严重Pb污染,探讨TiO2-NPs与Pb对生态及人类健康的联合毒性也显得尤为重要。
TiO2-NPs比表面积大,具有很强的吸附能力和很高的化学活性,常作为吸附剂,固相萃取河水以及海水中的Pb,使其可与重金属充分接触并相互作用,最后不可避免地释放到水环境中,其中直接与环境交换物质的水生生物最容易受到其影响。纳米材料存在于水生态系统中增加了各种潜在风险,不仅在于纳米材料本身,更在于它们可能会通过吸附等作用结合重金属,随着纳米材料的摄入而增加重金属暴露、积聚并导致毒性增强。Hu等[25-26]研究了水体中的Pb在TiO2-NPs存在下对网纹溞的毒性变化,发现在TiO2-NPs低浓度(低于200 mg·L-1)时,单独处理对网纹溞没有致死性,但可明显增加Pb的毒性,因为在TiO2-NPs与Pb共同作用时,Pb的半数致死浓度(LC50)由单独作用时的606 μg·L-1降为98 μg·L-1。Hu还指出,不论是否含有纳米材料,降低溶液的pH可以更大的促进Pb的毒性,这可能是由Pb2+离子形成以及Pb2+在纳米颗粒物上吸附位的改变引起的。
TiO2-NPs因其特殊的表面性质,容易催化产生活性氧类物质,对机体造成氧化损伤,Du等[27]研究发现,低剂量的TiO2-NPs与PbAc相互作用可产生不同的毒性反应。在无光催化条件下,TiO2-NPs与PbAc混合后作用于L-02细胞24 h,与1‰二甲基亚砜(DMSO)阴性对照组相比,TiO2-NPs和PbAc联合暴露诱导了活性氧(ROS)水平、细胞内超氧化物歧化酶(SOD)活性、谷胱甘肽(GSH)水平、DNA加合物8-羟基脱氧鸟苷(8-OHdG)水平、DNA损伤修复酶8-羟基鸟苷DNA糖苷酶同源物(OGG1)表达水平以及细胞毒性的增加,但是TiO2-NPs和PbAc单独处理,这些因素都没有明显变化。TiO2-NPs和PbAc低浓度混合物联合作用可诱导细胞氧化应激促进ROS释放和DNA损伤,上升的氧化应激触发了细胞保护防御的正调节作用,OGG1应激性增高以修复DNA损伤,这时细胞还拥有一定的抗氧化能力从而阻碍进一步的氧化损伤;而高浓度混合物时,则触发了负调节作用,即持续增加的DNA损伤会使OGG1水平下降[28],ROS水平持续增加,最后导致SOD及GSH活性降低,抗氧化能力下降,细胞活力下降[29]。Du等[30]又用同样的实验剂量进一步证明了,TiO2-NPs和PbAc联合作用可增强诱导L-02细胞凋亡,并协同增强细胞晚期凋亡水平,而Caspase-3在细胞凋亡作用中起着关键作用。相似的,Zhang等[31]用成年小鼠研究不同粒径TiO2颗粒和PbAC的联合毒性。对照组和处理组经口灌胃,处理小鼠7 d后,用乙醚麻醉后处死。肝功能和肾毒检测数据表明,混合悬液处理组有严重的肝和肾损伤,导致肝肾功能下降,其中,肝的ROS水平明显增加,皮层和海马的SOD及谷胱甘肽过氧化物酶(GSH-Px)活力降低。虽然没有产生协同急性毒性,但PbAC可能在其他方面增加了TiO2颗粒的毒性,其潜在的毒性机制可能与上述Du等[27]指出的氧化损伤有关。
然而,当TiO2-NPs和Pb单独处理都可产生毒性效应时,二者之间的相互作用方式便成为研究的重点。范传刚等[32]利用大肠杆菌研究了TiO2-NPs与PbAc之间的相互作用:TiO2-NPs吸附PbAc,减少其有效浓度;PbAc诱导TiO2-NPs聚集,影响其粒径大小及表面性质。实验所用的TiO2-NPs与PbAc分别单独作用时对大肠杆菌生长、抗氧化酶类、蛋白质、DNA均有毒性作用,而当二者联合作用时,产生不同于单独处理的毒性变化,即二者联合作用低于二者毒性的相加作用,交互作用证实为拮抗作用,在一定程度上减弱了二者的联合毒性作用。
3 TiO2-NPs与Cd的联合毒性(Combined toxicityof TiO2-NPs and Cd)
Cd于1993年被国际癌症研究机构(IARC)定为IA级致癌物[33]。世界卫生组织(WHO)将Cd作为优先研究的食品污染物。我国环境保护部和国土资源部2014发布的《全国土壤污染状况调查公报》显示,我国无机污染物超标情况中Cd位列首位[34]。Cd污染主要由矿资源不合理开采以及含Cd污水无组织排放所引起。Cd是一种可在人体和环境中长期蓄积的有毒重金属物质,在人体内的半衰期长达10~35 a,日本的痛痛病即为慢性Cd中毒的典型病症,表现为全身疼痛、多发性骨折、肌肉萎缩和其他并发症,最终导致病人死亡[35]。作为机体生长发育非必需元素,微量Cd进入人体即可通过生物积累,对肾、肺、肝、睾丸、脑、骨骼以及血液系统产生一系列损伤[36]。Cd的遗传毒性作用十分复杂,因为Cd既可与DNA又可与蛋白质相互作用。Cd可降低DNA聚合酶保真性,抑制DNA修复的某些途径[37],显著增加哺乳动物细胞基因突变率[38-39];通过抑制DNA甲基转移酶活性等诱发癌症[40],还可通过氧化应激刺激线粒体诱发凋亡[41]。
水生藻类与摄食性水生生物不同,不需要研究其体内摄入物的暴露毒性,而只与所处介质的污染物浓度、毒性相关,TiO2-NPs的吸附作用可降低水中自由Cd浓度,从而减轻Cd对藻类的毒性作用。
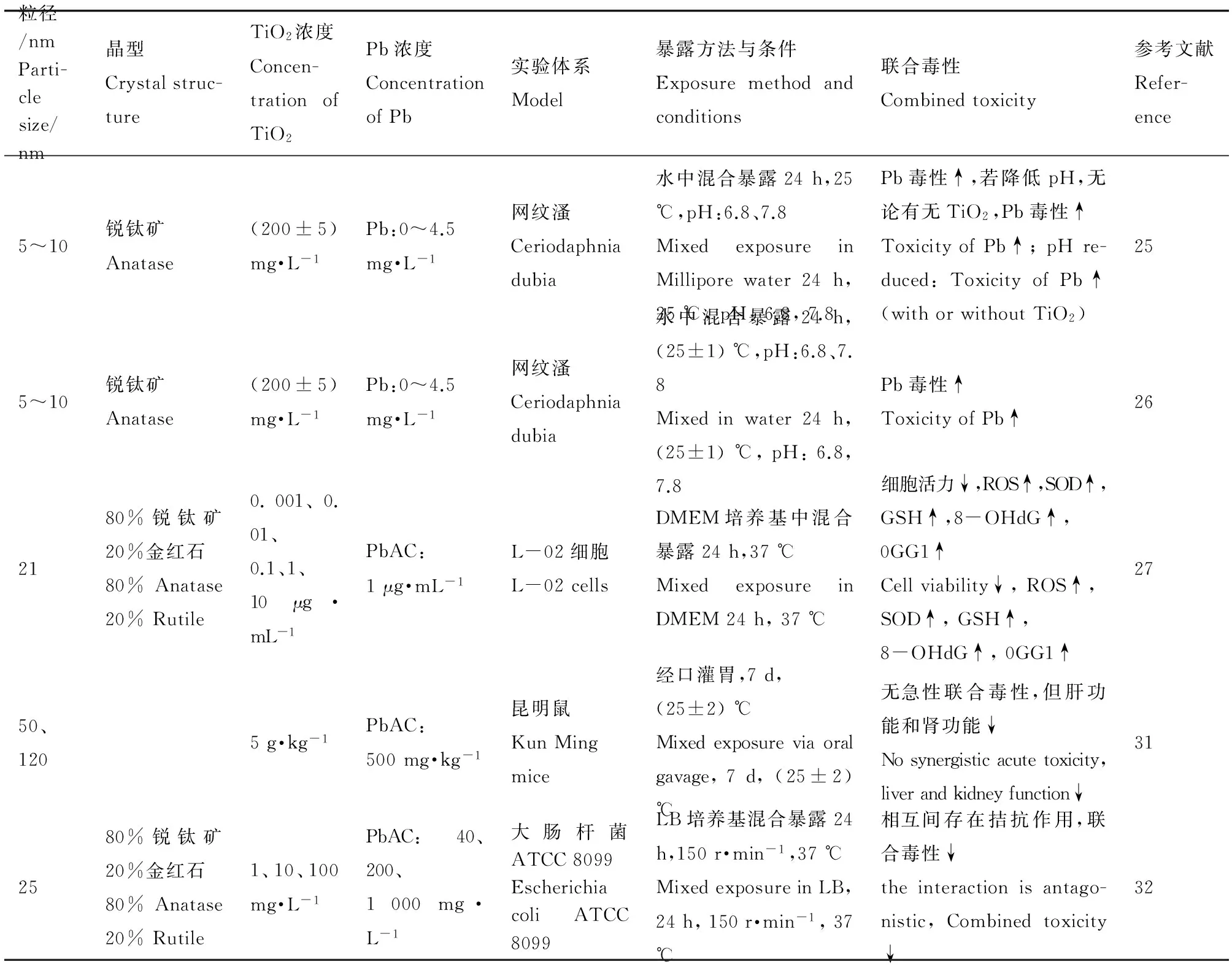
表1 TiO2-NPs与Pb联合毒性Table 1 Combined toxicity of TiO2-NPs and Pb
Yang等[42-43]研究了Cd2+吸附于聚丙烯酸钠包裹的TiO2-NPs后对莱茵衣藻毒性的影响,发现Cd2+可快速吸附于TiO2-NPs并在30 min内达到饱和,且被吸附的Cd2+含量随时间延长而增加,符合假一级动力学(pseudo-first order kinetics)模型。TiO2-NPs存在时可减缓Cd2+对衣藻的细胞毒性,可能是吸附作用降低了水中自由Cd2+浓度,从而减轻Cd2+对藻细胞生物积累以及毒性作用;也可能是被包裹的TiO2-NPs和藻细胞之间的静电斥力和潜在的空间位阻效应妨碍了彼此直接接触,导致细胞不能吞入纳米颗粒;此外还可能是细胞壁的保护作用,这有待于进一步研究。Yang等[43-44]又探讨了裸露的TiO2-NPs和普通TiO2颗粒对Cd2+毒性的影响。他指出,2种TiO2都可吸附Cd2+,从而降低水中自由离子浓度,进而降低了Cd2+的生物积累以及毒性,减轻Cd2+对莱茵衣藻的抑制作用,与上述结果一致。然而无论TiO2的粒径和浓度,只要介质中含有相近的自由Cd2+离子浓度,都可达到相当的Cd2+毒性和生物积累,TiO2浓度造成的毒性差异消失了,即毒性完全取决于自由Cd2+浓度,而与纳米颗粒大小、浓度无关。辛元元等[45]研究了TiO2-NPs和Cd对铜绿微囊藻生物效应的影响,指出当TiO2-NPs与Cd离子同时存在时,由于TiO2-NPs对Cd离子的吸附作用,水中游离态Cd离子浓度降低,导致Cd离子对藻的毒性明显降低。Hartmann等[46]利用月牙藻研究了不同粒径TiO2颗粒对Cd生物有效性的影响,发现300 nm TiO2颗粒存在时,由于Cd吸附于TiO2颗粒表面,降低了水中Cd的生物有效性和毒性,即效应浓度值(EC)上升。然而,对于30 nm的TiO2-NPs而言,可导致Cd的EC值明显降低,这可能是联合毒性的结果,例如,由于细胞膜被TiO2-NPs破坏导致Cd摄取增加或者Cd虽然吸附于TiO2-NPs但吸附的Cd对藻仍存在生物有效性。
而对于水生动物而言,其与藻类的实验结果存在很大不同,Cd可伴随着TiO2-NPs的摄入而摄入,在增加Cd暴露量的同时,TiO2-NPs本身也可产生多种效应,如增加氧化应激、导致Cd不同的亚细胞分布、阻碍Cd的排泄等。Yang等[43]研究了聚丙烯酸钠包裹的TiO2-NPs与Cd对四膜虫的联合毒性,发现在3 h的吸收实验中,四膜虫可以持续快速地吞且不会出现饱和,TiO2扮演着Cd2+进入细胞的携运载体和Cd2+亚细胞分布的介导者的2种角色。对于四膜虫而言TiO2-NPs本身可以致毒,而Cd2+的毒性在TiO2-NPs的作用下加剧了,但加剧程度与TiO2-NPs浓度不成正比。因此,TiO2-NPs与Cd2+的联合毒性不等同于二者毒性简单的加和,其机制有待深入研究。Yang[47]进一步利用四膜虫为模型,对TiO2-NPs与Cd的联合毒性进行了深入探讨,同样采用聚丙烯酸钠包裹的TiO2-NPs,他发现TiO2-NPs可促进Cd的摄入,增强对四膜虫特异细胞生长率的抑制作用,这可能是由TiO2-NPs自身所产生的毒性或者是不同摄入形式导致Cd的不同的亚细胞分布导致的。对于稍高等的溞类等,实验暴露方法和结果具有多样性,Tan等[48]研究了TiO2-NPs对大型溞中Cd的生物积累及毒性影响。他先将大型溞暴露于TiO2-NPs 2 d,再暴露于不同浓度Cd中,导致明显的Cd生物积累,但当肠道里的TiO2-NPs被清除后,摄取率立刻恢复到正常水平。这说明TiO2-NPs提前暴露并积累于溞肠道中可促进Cd富集。TiO2-NPs单独处理后,对ROS和金属硫蛋白(MTs)的测定数据表明,TiO2-NPs处理并未引起ROS和MTs 的明显变化,推测Cd摄入的增加可能是因为肠道中的TiO2-NPs提供了更多的结合位点。存活率的下降和死亡时间提前的数据也表明TiO2-NPs可促进Cd毒性增加。利用相似的暴露途径,Santaella等[49]证明,当大肠杆菌提前暴露于日化中常用的TiO2-NPs以及UVA时,细胞对Cd的敏感性会大大增强。Tan[50]还用不同方法研究了TiO2-NPs对大型溞中Cd的摄取和排泄,他指出Cd伴随着TiO2-NPs的摄入而摄入,吸附于TiO2-NPs的Cd排泄速率会明显低于未被吸附的Cd。因此他总结为吸附于TiO2-NPs可促进重金属的摄取以及体内的存留。然而,Hartmann等[51]在研究蚯蚓和大型溞中不同粒径TiO2颗粒对Cd潜在的运载作用时,发现添加TiO2颗粒后蚯蚓内Cd的生物积累和毒性都没有变化,说明Cd吸附于TiO2并没有影响整体性的积累。虽然促进了大型溞对Cd的摄取与积累,但未引起明显毒性变化。对于水生鱼类,Zhang等[52]比较了TiO2-NPs和天然沉积颗粒物在Cd污染水域中对Cd的吸附作用,以及二者单独存在时对鲤鱼体内Cd积累的促进作用。其研究指出,TiO2-NPs对Cd的吸附明显强于天然沉积颗粒物,并且,TiO2-NPs可显著促进鲤鱼中Cd的积累,因为联合暴露25 d后,鲤鱼中Cd浓度由单独暴露于Cd污染水域时的9.07 μg·g-1增加到22.3 μg·g-1,即增加了146%,且与TiO2-NPs浓度呈现正相关,而天然沉积颗粒物对Cd的积累未有显著影响。相似的,Hu等[53]研究了TiO2-NPs和腐殖酸(HA)对斑马鱼体内Cd的生物积累作用。他指出,在含有HA的溶液中,只有溶解的Cd参与生物积累,然而,在含有TiO2-NPs或者其与HA的混合溶液中,溶解的Cd和被TiO2-NPs吸附的Cd都可参与生物积累,因为TiO2吸附Cd促使肠道额外摄取,从而促进Cd的积累。
不管是通过自身暴露还是食物链传递,人类健康都不可避免的受到影响。高霞等[54]研究发现,不同浓度的CdCl2单独或者与TiO2-NPs混合作用于L-02细胞24 h,其中混合组的DNA损伤加剧,hMsh2基因表达水平上升,O6-甲基鸟嘌呤甲基转移酶(MGMT)和DNA依赖蛋白激酶复合物催化亚基(DNA-PKcs)基因表达水平上升,说明TiO2-NPs可增加各浓度CdCl2对L-02细胞的DNA单链损伤,从而使CdCl2对L-02细胞的毒性作用增强。肾脏是Cd发挥毒性作用的主要靶器官,因此XIA等[55-56]通过对氧化应激多种相关分子进行测量来研究TiO2-NPs和CdCl2联合作用对人胚肾细胞(HEK293T)氧化损伤作用。结果指出,当TiO2-NPs和CdCl2混合组处于本试验中较低浓度(总和为0.75 TU,1 TU=LD50)时,对血红素加氧酶1(HO-1)基因表达、过氧化氢酶(CAT)活性和丙二醛(MDA)浓度等有叠加作用。当总TU增加到1或1.25 TU,则TiO2-NPs和CdCl2之间存在协同作用。此外,当混合物中CdCl2具有较高比例时,TiO2-NPs对CdCl2影响不大,当CdCl2浓度低于或者等于TiO2-NPs浓度时,SOD活性和ROS浓度的变化表明TiO2-NPs和CdCl2对HEK293T细胞的氧化损伤具有协同作用,并指出,这些氧化应激指标的敏感性随着混合物中TiO2-NPs和CdCl2的浓度以及比例的变化而不同,其中ROS是氧化损伤最敏感的指标,就像Balbi等[57]所指出的,TiO2-NPs与Cd2+联合暴露可以对贻贝细胞的功能参数产生协同以及拮抗作用,具体由细胞类型、暴露条件以及测量的生物学终点等决定。
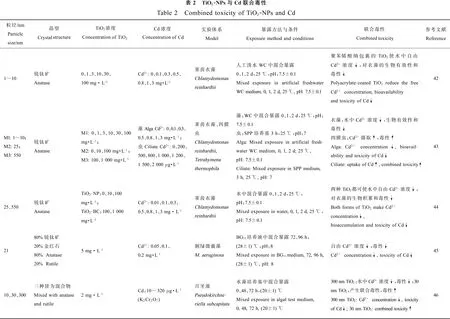
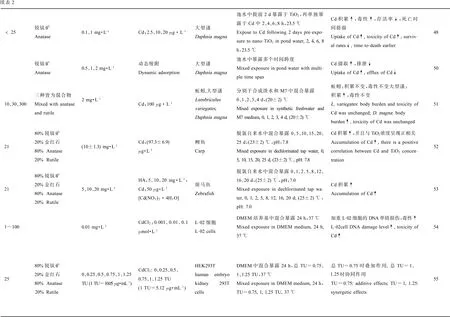
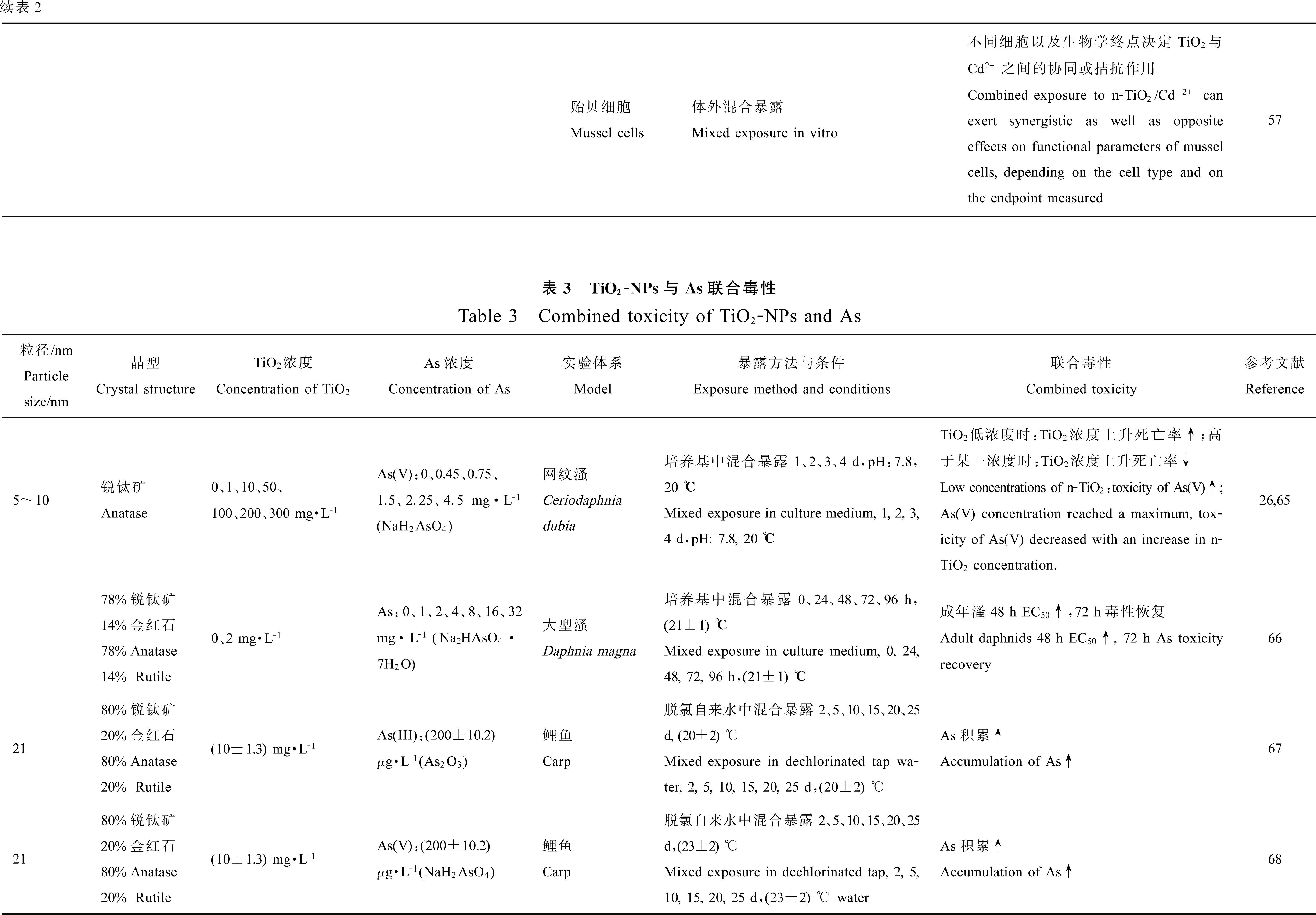
4 TiO2-NPs与As的联合毒性(Combined toxicityof TiO2-NPs and As)
As是一种类金属元素,IARC于1987年将其列为I A类环境致癌物[58]。我国土壤中As污染严重,许多矿区、流域沉积物、蔬菜基地均受到不同程度As污染,主要受当地工业(如煤炭工业、热力发电等)、含As农药喷洒以及污水灌溉或污泥施用的影响。As是广泛存在的环境污染物,自然界的As主要以As(III)和As(V)两种形式存在,以化合物形式广泛存在于地表、土壤、水、大气、食物及生物体内。饮用水含As量过高、食物受到As的污染、燃烧含As量高的煤,都易导致地方性As中毒;开采和冶炼As矿、使用含As农药、生产含As化合物,是职业性As中毒的主要途径。As作为一种外源性物质,进入生物体后随血液循环参与到生命活动中,对健康造成严重影响。As可导致细胞周期停滞[59],增加DNA的链断裂[60],诱发各种肿瘤细胞和正常细胞凋亡[61],抑制细胞增殖和DNA损伤修复[62]。As不仅对人体具有危害性,As还具有显著的环境危害性。As可影响跳虫的生长和生殖[63],高浓度的砷酸钠对大盐湖卤虫的生长、生殖和成活均有显著影响[64]等。
TiO2-NPs对As具有很强的吸附性,可造成As在水生动物体内大量积累,但是对于不同的暴露浓度,可产生不同的联合作用。Wang等[26,65]研究了TiO2-NPs与As(V)对网纹溞的协同毒性效应。当TiO2-NPs浓度低于400 mg·L-1时自身没有毒性,然而较低浓度的TiO2-NPs可显著的促进As(V)毒性。在TiO2-NPs浓度低于300 mg·L-1时的一系列实验结果显示,当TiO2-NPs浓度固定,死亡率随着As(V)的浓度的增加而增加,但当As(V)初始浓度固定,随着TiO2-NPs的浓度增加,致死率先上升到最大值后再下降,因为低浓度时As的吸附会随着TiO2-NPs浓度的增加而增加,从而增加As的毒性;但当TiO2-NPs浓度增加到一定值后不仅降低了游离的As(V)浓度,也使TiO2-NPs表面吸附的As(V)浓度下降,从而降低了毒性。因此,游离的As(V)和吸附的As(V)共同作用于对网纹溞的毒性。另外,高浓度TiO2-NPs因更易团聚而降低网纹溞的摄取率,这也是随着TiO2-NPs浓度上升死亡率降低的另一个原因。Rosenfeldt等[66]研究了TiO2-NPs与As对大型溞的联合毒性,发现TiO2-NPs促使成年溞的48 h-EC50上升32%但72 h毒性作用有所恢复,使未成熟溞的72 h-EC50上升24%,并指出成年溞48 h毒性的下降可能是因为TiO2-NPs对As的快速吸附以及聚集沉降等过程,然而其72 h-EC50与对照组相比并没有显著变化,成年溞72 h毒性的恢复表明其随后对TiO2-NPs的摄入以及所吸附As的释放。Sun等[67]研究了TiO2-NPs对As价态变化及鲤鱼的生物利用性的影响。实验指出,TiO2-NPs对As(III)有显著的吸附作用,30 min之内即达到饱和,其中起始As(III)大约有30%被吸附。在光刺激下,水相中大部分As(III)被TiO2-NPs氧化成As(V)。在TiO2-NPs存在情况下,可造成As大量积累,因为TiO2-NPs暴露25 d后,鲤鱼中As浓度比没有TiO2-NPs时高出44%。Sun等[68]又研究了TiO2-NPs对As(V)的促进积累作用。TiO2-NPs对As(V)有显著的吸附作用,30 min之内即达到平衡。当As(V)污染的水域中同时存在TiO2-NPs时,鲤鱼体内可积累大量As,同样暴露25 d后,鲤鱼中As浓度比没有TiO2-NPs时高出132%,其中肠胃和鱼腮中As积累最为显著。
5 总结与展望(Summary and prospect)
TiO2-NPs与重金属的污染现状,引起国内外学者围绕二者联合毒性展开相应的研究工作,为联合毒性的评估提供了重要的科学依据(表1,2,3)。本文重点讨论的Pb、As和Cd都有分别与TiO2-NPs联合作用的特点。其中光照条件可使光催化材料TiO2-NPs产生氧化作用引起As的价态变化;对于不同粒径的TiO2颗粒,尽管不同处理对象表现出不同结果,但对于同一处理对象,粒径较小的颗粒表现出相对较重的毒性。TiO2-NPs与重金属共同作用于受试体,可通过加剧氧化应激等相关指标来影响联合毒性。当TiO2-NPs处于无毒条件时,对于摄食动物如鲤鱼和大型溞等可能增大重金属毒性,因为重金属会随TiO2-NPs摄取大量积累;但浮游藻类如莱茵衣藻和铜绿微囊藻等由于重金属吸附于TiO2-NPs,从而降低介质中游离的自由离子浓度,但实际结果受制于不同实验条件。当TiO2-NPs处于有毒条件时,与重金属的联合毒性是叠加、协同还是拮抗作用,由二者暴露比例、受试对象、暴露途径以及测量的生物学终点决定,目前还没有统一性结论。
对于TiO2-NPs与重金属联合毒性的探究有待进一步展开,由于纳米材料使用广泛,目前无法估算其逐年暴增的废弃量,也无法确定TiO2-NPs在水生态中或其他方面的含有量及其对生态系统的多方面影响。值得注意的是,研究中不应只考虑单一因素,应综合研究纳米材料与污染物之间的相互作用、相互影响。然而目前对纳米材料与重金属联合毒性的研究仍存在一些问题:(1)关于纳米材料与重金属联合毒性的研究相对较少,一定程度上反映出此方向还未引起广泛重视,研究成果数量有限,其他纳米材料如碳族与重金属之间的联合毒性研究更是屈指可数,因此有关联合毒性对生态和健康影响的关注度有待提高。(2)纳米材料与重金属之间的联合机制有待深入探讨,现有相关文献大多浅谈潜在机制,没有使研究进一步深化,一定程度上反映出联合毒性研究处于相对初级阶段。(3)目前尚无法估算真实生态系统中纳米材料污染持有量,无法精确模拟真实环境中的联合毒性效应,以及与其他更多污染物之间未知的相互作用,研究有待实际化。(4)国内外关于纳米材料与重金属联合毒性的研究侧重于生态系统,但对人类健康效应的研究相对较少,因此,有必要围绕此方向开展更多的研究工作。
[1] Sharma V K. Aggregation and toxicity of titanium dioxide nanoparticles in aquatic environment-A review [J]. Journal of Environmental Science and Health Part A-Toxic/Hazardous Substances & Environmental Engineering, 2009, 44(14): 1485-1495
[2] Nel A, Xia T, Madler L, et al. Toxic potential of materials at the nano level [J]. Science, 2006, 311(5761): 622-627
[3] 陈春英. 二氧化钛纳米材料生物效应与安全应用[M]. 北京: 科学出版社, 2010: 222-225
Chen C Y. Biological Effect and Security Applications of Titanium Dioxide Nanometer Material [M]. Beijing: Science Press, 2010: 222-225 (in Chinese)
[4] Lin D, Tian X, Wu F, et al. Fate and transport of engineered nanomaterials in the environment [J]. Journal of Environmental Quality, 2010, 39(6): 1896-1908
[5] Petosa A R, Jaisi D P, Quevedo I R, et al. Aggregation and deposition of engineered nanomaterials in aquatic environments: Role of physicochemical interactions [J]. Environmental Science &Technology, 2010, 44(17): 6532-6549
[6] Warheit D B, Sayes C M, Reed K L, et al. Health effects related to nanoparticle exposures: Environmental, health and safety considerations for assessing hazards and risks [J]. Pharmacology & Therapeutics, 2008, 120(1): 35-42
[7] Kaegi R, Ulrich A, Sinnet B, et al. Synthetic TiO2nanoparticle emission from exterior facades into the aquatic environment [J]. Environmental Pollution, 2008, 156(2): 233-239
[8] Kiser M, Westerhoff P, Benn T, et al. Titanium nanomaterial removal and release from wastewater treatment plants [J]. Environmental Science &Technology, 2009, 43(17): 6757-6763
[9] Baan R, Straif K, Grosse Y, et al. Carcinogenicity of carbon black, titanium dioxide, and talc [J]. Lancet Oncology, 2006, 7(4): 295-296
[10] Chen J L, Fayerweather W E. Epidemiologic study of workers exposed to titanium dioxide [J]. Journal of Occupational and Environmental Medicine, 1988, 30(12): 973-942
[11] Wang J, Zhou G, Chen C, et al. Acute toxicity and biodistribution of different sized titanium dioxide particles in mice after oral administration [J]. Toxicology Letters, 2007, 168(2): 176-185
[12] Zhao X Y, Ze Y G, Gao G D, et al. Nanosized TiO2-induced reproductive system dysfunction and its mechanism in female mice [J]. PlosOne, 2013, 8(4): e59378
[13] Ma X, Geiser-lee J, Deng Y, et al. Interactions between engineered nanoparticles (ENPs) and plants: Phytotoxicity, uptake and accumulation [J]. Science of the Total Environment, 2010, 408(16): 3053-3061
[14] Menard A, Drobne D, Jemec A. Ecotoxicity of nanosized TiO2-review of in vivo data [J]. Environmental Pollution, 2011, 159(3): 677-684
[15] Zhu X, Chang Y, Chen Y. Toxicity and bioaccumulation of TiO2nanoparticle aggregates in Daphnia magna [J]. Chemosphere, 2010, 78(3): 209-215
[16] Johnston B D, Scown T M, Moger J, et al. Bioavailability of nanoscalemetal oxides TiO2, CeO2, and ZnO to fish [J]. Environmental Science &Technology, 2010, 44(3): 1144-1151
[17] Federici G, Shaw B J, Handy R D. Toxicity of titanium dioxide nanoparticles to rainbow trout (Oncorhynchus mykiss): Gill injury, oxidative stress, and other physiological effects [J]. Aquatic Toxicology, 2007, 84(4): 415-430
[18] Zhu X S, Wang J X, Zhang X Z, et al. Trophic transfer of TiO2nanoparticles from daphnia to zebrafish in a simplified freshwater food chain [J]. Chemosphere, 2010, 79(9): 928-933
[19] Angelstorf J S, Ahlf W, von der Kammer F, et al. Impact of particle size and light exposure on the effects of TiO2nanoparticles on Caenorhabditis elegans [J]. Environmental Toxicology and Chemistry, 2014, 33(10): 2288-2296
[20] WHO. Environmental Burden of Disease: Introduction and Methods [EB/OL]. [2004-09-01]. http: www.emro.who.int/ceha /media/ PowerPoint / partl. Pps.2004
[21] Lanphear B P, Hornung R, Khoury J, et al. Low-level environmental lead exposure and children's intellectual function: An international pooled analysis [J]. Environmental Health Perspectives, 2005, 113(7): 894-899
[22] Nawrot T S, Thijs L, Den Hond E M, et al. An epidemiological re-appraisal of the association between blood pressure and blood lead: A meta-analysis [J]. Journal of Human Hypertension, 2002, 16(2): 123-131
[23] Anvas-acien A, Guallar E, Silbergeld E K, et al. Lead exposure and cardiovascular disease-A systematic review [J]. Environmental Health Perspectives, 2007, 115(3): 472-482
[24] Zhan Y J, Yang R J, Wang X L, et al. Acute toxic effect of Hg(II) and Pb(II) on marine unicellular algae [J]. Asian Journal of Ecotoxicology, 2010, 6(5): 523-531
[25] Hu J, Wang D M, Wang J T, et al. Toxicity of lead on Ceriodaphnia dubia in the presence of nano-CeO2and nano-TiO2[J]. Chemosphere, 2012, 89(5): 536-541
[26] 胡佶. 水体中的As(Ⅴ)、Pb(Ⅱ)在纳米颗粒物存在下对网纹溞(Ceriodaphnia dubia)的毒性作用[D]. 山东: 中国海洋大学, 2012: 37-48, 62-73
Hu J. Synergistic toxic effect of nanoparticles and As(V) and Pb(II) on Ceriodaphnia dubia [D]. Shandong: Ocean University of China, 2012: 37-48, 62-73 (in Chinese)
[27] Du H R, Zhu X L, Fan C G, et al. Oxidative damage and OGG1 expression induced by a combined effect of titanium dioxide nanoparticles and lead acetate in human hepatocytes [J]. Environmental Toxicology, 2012, 27(10): 590-597
[28] 杜海荣, 周宜开, 朱晓玲. 低剂量纳米二氧化钛和乙酸铅联合诱导人胚肝细胞DNA损伤与修复作用[J]. 环境与健康杂志, 2012, 29(5): 403-406
Du H R, Zhou Y K, Zhu X L. Oxidative damage and OGG1 expression induced by a combined effect of titanium dioxide nanoparticles and lead acetate in human hepatocytes [J]. Journal of Environment and Health, 2012, 29(5): 403-406 (in Chinese)
[29] 杜海荣, 朱晓玲, 周宜开. 纳米二氧化钛与醋酸铅联合诱导人胚肝细胞氧化应激作用[J]. 环境与职业医学, 2012, 29(9): 552-555
Du H R, Zhu X L, Zhou Y K. Joint oxidative stress induced by nanometer titanium dioxide and lead acetate in human derived fetal hepatocytes [J]. Journal of Environmental & Occupational Medicine, 2012, 29(9): 552-555 (in Chinese)
[30] 杜海荣. Nano-TiO2与PbAc联合诱导人胚肝细胞氧化应激和凋亡作用研究[D]. 武汉: 华中科技大学, 2010: 16-66
Du H R. Study on joint effect of oxidative stress and apoptosis caused by nano-TiO2and PbAc in human derived fetal hepatocytes [D]. Wuhan: Huazhong University of Science and Technology, 2010: 16-66 (in Chinese)
[31] Zhang R, Niu Y J, Li Y W, et al. Acute toxicity study of the interaction between titanium dioxide nanoparticles and lead acetate in mice [J]. Environmental Toxicology and Pharmacology, 2010, 30(1): 52-60
[32] 范传刚. 纳米TiO2和重金属铅对环境微生物E. coli联合毒性作用的评价研究[D]. 武汉: 华中科技大学, 2011: 19-37
Fan C G. Study on the combined toxic effects of nano titanium dioxide and lead acetate on Escherichia coli [D]. Wuhan: Huazhong University of Science and Technology, 2011: 19-37 (in Chinese)
[33] Vainio H, Heseltine E, Partensky C, et al. Meeting of the IARC working group on beryllium, cadmium, mercury and exposures in the glass manufacturing industry [J]. Scandinavian Journal of Work, Environment & Health, 1993, 19(5): 360-363
[34] 环境保护部, 国土资源部. 全国土壤污染状况调查公报[EB/OL]. [2014-04-17]. http://www.zhb.gov.cn/gkml/hbb/qt/201404/t20140417_270670.htm
[35] Baba H, Tsuneyama K, Kumada T, et al. Histopathological analysis for osteomalacia and tubulopathy in Itai-itai disease [J]. Journal of Toxicological Sciences, 2014, 39(1): 91-96
[36] IARC. Cadmium in the Human Environment: Toxicity and Carcinogenicity [M]. Italy: IARC Scientific Publications, 1992, 118: 1-464
[37] Hartwig A. Role of DNA-repair inhibition in lead-induced and cadmium-induced genotoxicity: A review [J]. Environmental Health Perspectives, 1994, 102(3): 45-50
[38] Filipic M, Hei T K. Mutagenicity of cadmium in mammalian cells: Implication of oxidative DNA damage [J]. Mutation Research-Fundamental and Molecular Mechanisms of Mutagenesis, 2004, 546(1-2): 81-91
[39] Fotakis G, Cemeli E, Anderson D, et al. Cadmium chloride-induced DNA and lysosomal damage in a hepatoma cell line [J]. Toxicology in Vitro, 2005, 19(4): 481-489
[40] Hartwig A. Mechanisms in cadmium-induced carcinogenicity: Recent insights [J]. Biometals, 2010, 23(5): 951-960
[41] Kumar M, Kumari P, Gupta V, et al. Differential responses to cadimium induced oxidative stress in marine macroalga Ulva lactuca (Ulvales, Chlorophyta) [J]. Biometals, 2010, 23(2): 315-325
[42] Yang W W, Miao A J, Yang L Y. Cd2+toxicity to a green alga Chlamydomonas reinhardtii as influenced by its adsorption on TiO2engineered nanoparticles [J]. PLoSOne, 2012, 7(3): e32300
[43] 杨溦莞. 纳米二氧化钛颗粒对Cd2+生物有效性及毒性的影响[D]. 南京: 南京大学, 2013: 7-61
Yang W W. Effects of titanium dioxide engineered nanoparticles on the bioavailability and toxicity of Cd2+[D]. Nanjing: Nanjing University, 2013: 7-61 (in Chinese)
[44] Yang W W, Li Y, Miao A J, et al. Cd2+toxicity as affected by bare TiO2nanoparticles and their bulk counterpart [J]. Ecotoxicology and Environmental Safety, 2012, 85: 44-51
[45] 辛元元, 陈金媛, 程艳红, 等. 纳米TiO2与重金属Cd对铜绿微囊藻生物效应的影响[J]. 生态毒理学报, 2013, 8(1): 23-28
Xin Y Y, Chen J Y, Cheng Y H, et al. Biological effects of nano-TiO2and heavy metal Cd on M. aeruginosa [J]. Asian Journal of Ecotoxicology, 2013, 8(1): 23-28 (in Chinese)
[46] Hartmann N B, Von der Kammer F, Hofmann T, et al. Algal testing of titanium dioxide nanoparticles-testing considerations, inhibitory effects and modification of cadmium bioavailability [J]. Toxicology, 2010, 269(2-3): 190-197
[47] Yang W W, Wang Y, Huang B, et al. TiO2nanoparticles act as a carrier of Cd bioaccumulation in the ciliate Tetrahymena thermophila [J]. Environmental Science & Technology, 2014, 48(13): 7568-7575
[48] Tan C, Wang W X. Modification of metal bioaccumulation and toxicity in Daphnia magna by titanium dioxide nanoparticles [J]. Environmental Pollution, 2014, 186: 36-42
[49] Santaella C, Allainmat B, Simonet F, et al. Aged TiO2-based nanocomposite used in sunscreens produces singlet oxygen under long-wave UV and sensitizes Escherichia coli to cadmium [J]. Environmental Science & Technology, 2014, 48(9): 5245-5253
[50] Tan C, Fan W H, Wang W X. Role of titanium dioxide nanoparticles in the elevated uptake and retention of cadmium and zinc in Daphnia magna [J]. Environmental Science & Technology, 2012, 46(1): 469-476
[51] Hartmann N B, Legros S, Von der Kammer F, et al. The potential of TiO2nanoparticles as carriers for cadmium uptake in Lumbriculus variegatus and Daphnia magna [J]. Aquatic Toxicology, 2012, 118: 1-8
[52] Zhang X Z, Sun H W, Zhang Z Y, et al. Enhanced bioaccumulation of cadmium in carp in the presence of titanium dioxide nanoparticles[J]. Chemosphere, 2007, 67(1): 160-166
[53] Hu X L, Chen Q Q, Jiang L, et al. Combined effects of titanium dioxide and humic acid on the bioaccumulation of cadmium in zebrafish [J]. Environmental Pollution, 2011, 159(5): 1151-115
[54] 高霞, 张娜, 杜宏, 等. 纳米二氧化钛对氯化镉所致人胚肝L-02细胞毒性作用的影响[J]. 环境与职业医学, 2008, 25(3): 256-258
Gao X, Zhang N, Du H, et al. Influence of nano-TiO2on the toxic effects of cadmiu chloride in human liver L-02 cells [J]. Journal of Environmental & Occupational Medicine, 2008, 25(3): 256-258 (in Chinese)
[55] Xia B, Chen J W, Zhou Y K. Cellular oxidative damage of HEK293T cells induced by combination of CdCl2and nano-TiO2[J]. Journal of Huazhong University of Science and Technology-Medical Sciences, 2011, 31(3): 290-294
[56] 夏彬. 氯化镉与纳米二氧化钛、EDTA的联合毒性评价及典型地区土壤镉污染健康风险分析[D]. 武汉: 华中科技大学, 2008: 12-32
Xia B. Combination toxicity of cadmium chloride and nanometer titania, EDTA and health risk evaluation of soil pollution of cadmium in typical areas [D]. Wuhan: Huazhong University of Science and Technology, 2008, 12-32 (in Chinese)
[57] Balbi T, Ciacci C, Fabbri R, et al. In vitro effects of combined exposure to N-TiO2and Cd2+inmussel cells [J]. Comparative Biochemistry and Physiology, Part A, 2012, 163(1): S41
[58] IARC. Arsenic and arsenic compounds [M]// IARC Monographs on the Evaluation of Carcinogenic Risks to Humans. Lyon: International Agency for Research On Cancer, 1987: 100-206
[59] Yih L H, Hsueh S W, Luu W S, et al. Arsenite induces prominent mitotic arrest via inhibition of G2 checkpoint activation in CGL-2 cells [J]. Carcinogenesis, 2005, 26(1): 53-63
[60] Wang T S, Hsu T Y, Chung C H, et al. Arsenite induces oxidative DNA adducts and DNA-protein cross-links in mammalian cells [J]. Free Radical Biology Medicine, 2001, 31(1): 321-330
[61] Mirkes P E, Little S A. Teratogen-induced cell death in post implantation mouse embryos: Differential tissue sensitivity and hallmarks of apoptosis [J]. Cell Death and Differentiation, 1998, 5(7): 592-600
[62] Vega L, Gonsebatt M E, Ostrosky-Wegman P. Aneugenic effect of sodium arsenite on human lymphocytes in vitro: An individual susceptibility effect detected [J]. Mutation Research-Environmental Mutagenesis and Related Subjects, 1995, 334(3): 365-373
[63] Crouau Y, Moia C. The relative sensitivity of growth and reproduction in the springtail, Folsomia candida, exposed to xenobiotics in the laboratory: An indicator of soil toxicity [J]. Ecotoxicology and Environmental Safety, 2006, 64(2): 115-121
[64] Brix K V, Cardwell R D, Adams W J. Chronic toxicity of arsenic to the great salt lake brine shrimp, Artemia franciscana [J]. Ecotoxicology and Environmental Safety, 2003, 54(2): 169-175
[65] Wang D M, Hu J, Irons D R, et al. Synergistic toxic effect of nano-TiO2and As(V) on Ceriodaphnia dubia [J]. Science of the Total Environment, 2011, 409(7): 1351-1356
[66] Rosenfeldt R R, Seitz F, Schulz R, et al. Heavy metal uptake and toxicity in the presence of titanium dioxide nanoparticles: A factorial approach using Daphnia magna [J]. Environmental Science & Technology, 2014, 48(12): 6965-6972
[67] Sun H W, Zhang X Z, Zhang Z Y, et al. Influence of titanium dioxide nanoparticles on speciation and bioavailability of arsenite [J]. Environmental Pollution, 2009, 157(4): 1165-1170
[68] Sun H W, Zhang X Z, Niu Q, et al. Enhanced accumulation of arsenate in carp in the presence of titanium dioxide nanoparticles [J]. Water, Air and Soil Pollution, 2007, 178(1-4): 245-254
◆
Review on Combined Toxicity of TiO2Nanoparticles and Heavy Metals
Wang Jingjing1,2, Wang Xinan2, Dai Hui2, Liu Yun2, Xu An2,*
1. School of Environmental Science and Optoelectronic Technology, University of Science and Technology of China, Hefei 230026, China 2. Key Laboratory of Ion Beam Bioengineering of Chinese Academy of Science and Anhui Province, Hefei Institutes of Physical Science, Chinese Academy of Science, Hefei 230031, China
8 October 2014 accepted 19 November 2014
Although titanium dioxide nanoparticles (TiO2-NPs) have been widely used for years, they may potentially cause environmental pollution and ecological & health risks at the same time. With the increasing release of TiO2-NPs, the combined toxicity of TiO2-NPs and heavy metals have become an important issue and caused great research interests. This review focused on the combined toxicity of TiO2-NPs and heavy metals including lead, cadmium and arsenic, the existing problems, and the prospective in the field.
titanium dioxide nanoparticles (TiO2-NPs); heavy metals; Pb; Cd; As; combined toxicity
国家重大科学研究计划(2014CB932002);中国科学院战略先导性科技专项B(XDB14030502);国家自然科学基金(U1232144;30570442);合肥物质科学技术中心重要/创新项目培育基金(2014FXCX010)
王晶晶(1990-),女,硕士,研究方向为环境毒理学,E-mail: zkdwjj@mail.ustc.edu.cn
*通讯作者(Corresponding author), E-mail: anxu@ipp.ac.cn
10.7524/AJE.1673-5897.20141008001
2014-10-08 录用日期:2014-11-19
1673-5897(2015)2-100-13
X171.5
A
许安(1971-),女,博士,研究员,主要研究方向为环境毒理学。
王晶晶, 王希楠, 代慧, 等. 二氧化钛纳米颗粒与重金属联合毒性研究进展[J]. 生态毒理学报, 2015, 10(2): 100-112
Wang J J, Wang X N, Dai H, et al. Review on combined toxicity of TiO2nanoparticles and heavy metals [J]. Asian Journal of Ecotoxicology, 2015, 10(2): 100-112 (in Chinese)

