玉米氰化物解毒基因β-CAS和NIT在非生物胁迫下的表达与生物学效应
季 静,柳 洁,王 罡,杜希龙,曹海燕,荣 非,金 超
玉米氰化物解毒基因β-CAS和NIT在非生物胁迫下的表达与生物学效应
季 静1,2,柳 洁1,2,王 罡2,杜希龙1,2,曹海燕1,2,荣 非2,金 超2
(1. 天津大学化工学院,天津 300072;2. 天津大学遗传工程研究所,天津 300072)
氰化物(cyanide)对生物有机体和环境都有剧毒.在非生物胁迫条件下,植物细胞内会产生大量的氰化物,这些氰化物对细胞具有毒害作用,基因β-CAS和NIT是玉米细胞氰化物解毒途径上的重要基因.本研究分别以200,mmol/L NaCl胁迫条件下第2,h、8,h、24,h和48,h的天塔5号(F1)及其亲本三叶期的幼苗作为实验材料,对其光合速率、生长势、叶片氰化物含量及氰化物解毒途径重要相关基因β-CAS和NIT的表达量进行了检测和统计学分析.研究结果表明,F1代的根长显著长于亲本;在盐胁迫处理下,三系叶片的光合速率均发生下调,其中F1的光合速率和母本没有显著差异,但是显著高于父本;F1叶片的氰化物含量比母本和父本更早发生下降;三系的基因β-CAS表达量均上调,上调幅度从大到小的顺序依次是母本、F1和父本;F1和母本的NIT基因表达量下调,父本则发生上调.
玉米;氰化物;实时定量PCR;盐胁迫;非生物胁迫
近年来,随着冶金等工业的迅速发展,氰化物(cyanide)污染日益严重,土壤氰化物污染的问题也随之而来.氰化物对生物有机体有剧毒,它能在动物体内迅速电离出氰离子,造成急性中毒,甚至死亡.其中,氰化钾的致死量为1~2,mg/kg[1],土壤中氰化物污染严重的还会导致农作物减产,甚至寸草不生[2].与此相对的是,氰化物在土壤中的降解很慢,目前,已经报道过的治理土壤氰化物污染的方法主要有植物法[3]和化学法,其中,植物法由于其具有对土地破坏较小、修复生态环境的优势而倍受青睐.前人将玉米放到含有氰化物的营养液中培养,一段时间后,营养液中氰化物含量降低,从而证明玉米具有吸收并转化环境中氰化物的能力[4].玉米是主要的经济作物,研究玉米细胞中氰化物代谢记录,对培育具有氰化物耐受性能的玉米植株以及降低土壤氰化物污染治理成本具有重要意义.
事实上,氰化物作为植物胞内的内源物质,来源于多个代谢途径,其中最重要的两个代谢途径分别是生氰糖苷和氰化脂类的转化[5]以及乙烯的生物合成[6],且后者比前者在植物物种中更具有普遍性.氰化物在胞内承担着信号传导的功能[7],处于逆境胁迫时,植物细胞内的氰化物会发生富集,刺激氨基酸的转化和蛋白质的合成以抵御逆境.但是,大量产生的氰化物也会导致胞内金属离子被络合,引起蛋白质失活,损害细胞的正常代谢,进而破坏植物生理,这是逆境对细胞产生破坏的一个重要方面.综上所述,细胞内的氰化物浓度在细胞对环境胁迫的响应过程中发挥着重要作用,由细胞内的多条代谢途径进行精密的调控.经过亿万年的进化,植物也形成了一套相对比较有效的应对机制,即存在一条转化和降解氰化物完备的代谢途径,在该代谢途径上游,酪氨酸、异亮氨酸、苯丙氨酸和缬氨酸在氮端单氧化酶(N-monooxygenase)、肟单氧化酶(oxime monooxygenase)和羟基扁桃腈裂合酶(hydroxymandelonitrile lyase)的作用下,顺次生成肟(oxime)、腈(nitrile)和中心产物氰化物.氰化物代谢途径下游一般又被称为氰化物解毒途径,氰化物在不同酶的催化作用下有多个去向,最重要的两个去向分别是在关键酶β-腈丙氨酸合成酶(β-cyanoalanine synthase,β-CAS)的催化下与丝氨酸反应,生成β-腈丙氨酸(β-cyanoalanine)[8],并进一步合成天冬氨酸或天冬酰胺[9],或是在腈裂解酶(nitrilase)的催化下生成丙氨酸[10].由此可见,胞内氰化物保持在很低的水平,处于精密的动态平衡调控之下.
目前,国内外对氰化物代谢途径的研究很少,大多是关于该途径在植物对抗生物和非生物逆境时的响应.Vahala等[10]的研究表明,当白杨暴露于臭氧中时,基因β-CAS的表达量和乙烯的合成量共同上调.在面对干旱胁迫时,烟草组织中的氰化物含量和β-CAS的表达量均发生上调[11],而在拟南芥中,Machingura等[12]则进一步讨论了该途径在植物遭受缺水胁迫时的响应情况,包括细胞响应与胁迫位点的统一性,以及细胞响应随着时间和胁迫强度的不同发生的变化.O’Leary等[13]证实在烟草中腈裂解酶的活性是氰化物解毒的限制性因素,提高腈裂解酶的活性能提高植物对氰化物的抗性和同化作用.
由此可以看出,在植物遭遇环境胁迫时,氰化物解毒途径会产生响应,使细胞内的氰化物浓度维持在稳定水平,提高细胞对环境胁迫的抗逆性.该途径上与氰化物解毒关系较大的基因一共有2个:β-CAS和NIT.
天津天塔5号是近年来经过杂交育种获得的新品系,子代抗非生物胁迫的能力强于亲本.而玉米的三叶期是其抵抗盐碱胁迫的关键时期,许多关键的酶和信号传导途径都在此时发挥作用[14-17].为了研究玉米细胞中氰化物的代谢机理及关键酶对该途径的影响,笔者对三叶期的天塔5号及其亲本进行盐胁迫并对氰化物解毒相关基因β-CAS和NIT的表达量及相关生理生化性状进行了研究.
1 材料与方法
1.1 材 料
本实验所用玉米品种为天塔5号及其父本和母本,系天津市科润津丰种业有限公司提供,并由天津大学遗传工程研究所保种.
1.2 方 法
实验于2013年在天津大学科技示范园内进行,春季播种,种植天塔5号(F1)及父本和母本各50株,株距0.5,m,长至三叶期时,每株均用200,mL浓度为200,mmol/L的氯化钠溶液进行胁迫处理,胁迫期间不浇水,胁迫2,h、8,h、24,h和48,h,同时,以同期未做任何处理的天塔5号及亲本作为对照组.各组分别取顶部叶片,置于-80,℃待测.
2 测定项目
2.1 玉米叶片光合速率
玉米长至三叶期时采用美国产LI-6400便携式光合测定仪于晴天分别测定对照组和实验组玉米顶部叶片的净光合速率,每个数据重复测量3次.
2.2 植株性状
(1) 株高:在三叶期,从样品中随机抽样8~10株,测量植株主茎从地面到顶部叶片顶部的高度.
(2) 叶宽:在三叶期,从样品中随机抽样8~10株,测量顶部叶片中部的宽度.
(3) 叶长:在三叶期,从样品中随机抽样8~10株,测量顶部叶片叶鞘以上至叶片顶端部分的长度.
(4) 根长:在三叶期,从样品中随机抽取8~10株,测量主根的顶端到茎部底部的长度.
2.3 叶片氰化物含量
本实验采用国标法中的硝酸银滴定法[18]测定玉米叶片氰化物的含量.
取处理后各组顶部叶片,定量至5,g,液氮研磨至粉末状后,置于500,mL蒸馏瓶中,加适量的二次去离子水浸没,加入15,mL乙酸锌溶液、30,mL酒石酸溶液,迅速连接好实验装置,冷凝管下端插入盛有15,mL 0.5,mol/L NaOH溶液的100,mL容量瓶的液面下,先缓慢均匀加热蒸馏瓶,再通水蒸气进行蒸馏,收集馏出液约100,mL,取出容量瓶,加二次去离子水定容至刻度并摇匀.移取此溶液10,mL,利用硝酸银法进行测定.
对照组实验方法同上.
2.4 玉米植株关键基因表达量
玉米长至三叶期时,采用Agilent Technologies® Stratagene MX3000P分别测定顶部叶片的基因β-CAS和NIT的表达量,各组的测定均重复3次.
本实验采用qRT-PCR方法测定各组上述两个基因的瞬时表达量.叶片从幼苗取下后,立即用液氮保存,使用ambion® PureLink® RNA Mini Kit试剂盒提取各组RNA,提取过程中使用PureLinkTM DNase除去基因组DNA,利用ambion High Capacity cDNA Reverse Transcription Kits进行反转录,以actin基因作为内参,使用TransGen® TranStartTM Top Green qPCR Supermix进行各组qRT-PCR的测定,每组取3株作为样品,每个样品分别重复测定3次.所使用引物如表1所示.

基因表达量的计算式为式中:X为某组所测基因表达量与别组的差异倍数;ef为引物的扩增效率;ΔΔCt为某组所测基因表达量与别组的循环阈值Ct之差,其中,下角标代表不同的实验组和对照组,a表示内参基因.

表1 qRT-PCR 引物列表Tab.1 Primers used in qRT-PCR
以上测得的数据处理均采用SPSS软件进行数据方差分析和多重比较.
3 实验结果
3.1 玉米叶片光合速率
植株在受到盐胁迫时,细胞内会产生包括氰化物在内的大量的自由基.氰化物含量过高时会影响光合作用的效率,因此,叶片光合速率受到氰化物解毒途径响应的影响,同时是表征植株生理状况和抗逆能力的重要指标之一.
统计学分析表明,胁迫前后,天塔5号的光合速率均显著高于其亲代,且胁迫后光合速率下降的百分比和亲本对比有减小的趋势.
通过观测发现对照组的三系在2,h、24,h和48,h时的光合速率都是先升高再下降,这是因为测量时阳光强度的差异和盐胁迫对照未浇水造成的.从实验组的角度看,光合速率均小于对照组,这是盐胁迫造成的.同时,实验组24,h的光合速率相比2,h显著降低,且从斜率看,速度很快,到48,h虽然还是有下降的趋势,速度却已经变慢,特别是天塔5号植株的光合速率基本已经趋于不变(见表2).
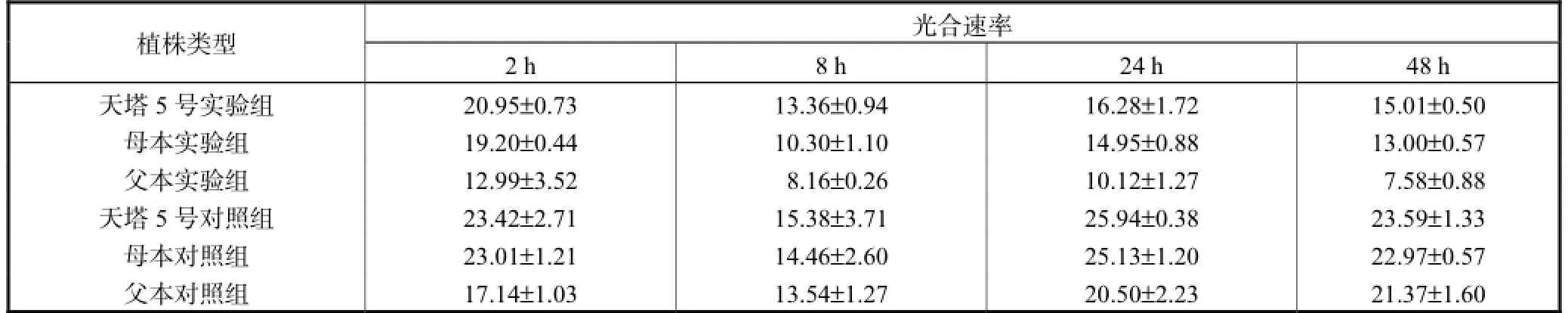
表2 玉米叶片光合速率Tab.2 Photosynthetic rate of maize leaves μmol/(m2·s)
3.2 植株性状
农艺性状通常都是表征植物生长势的.
天塔5号的植株和其亲代相比,在株高、叶宽和叶长方面,经统计学分析,无显著性差异,但是其根部长度与母本相比没有显著差异,显著长于父本.
叶宽方面,天塔5号的叶片与其亲本相比有增宽趋势.叶宽使叶面积增加,叶绿体含量增加,光合作用增强(见表3).

表3 玉米植株性状Tab.3 Maize plants traits cm
3.3 叶片氰化物含量
植物体内的氰化物含量是一个很重要的生理指标,因为氰化物即可以作为信号传导物质激发细胞合成某些种类的氨基酸(如天冬氨酸等)以维持正常的生理,也会导致胞内金属离子被络合,进而影响细胞的生理.统计学分析表明,实验组植株胞内的氰化物含量显著提高,从提高的百分比看,天塔5号显著低于亲本,以胁迫后2 h为例,分别提高了50.4%、52.3%和67.2%.这表明,天塔5号氰化物含量的控制能力最强,母本次之,父本最弱,这与天塔5号和母本的耐盐能力强于父本相符合.从时间上看,三系具有相似的变化趋势,均是胁迫后迅速上升,然后缓慢下降.但是相比之下,天塔5号在24,h时已开始下降,48 h时的浓度更接近初始浓度(见表4).

表4 玉米植株氰化物含量Tab.4 Cyanide content of maize plants mgCN/kg
3.4 玉米植株关键基因表达量
β-CAS作用于氰化物转化成天冬氨酸途径的第一步是把剧毒的氰化物转化成天冬氨酸的前体,即L-3-氰丙氨酸,该物质对植物的毒害较小,能迅速地转化成天冬氨酸.NIT是氰化物转化成丙氨酸途径上的关键步骤,最终产物是丙氨酸.两个途径的共同点是都可以降低胞内氰化物的浓度,把有毒物质转变为氨基酸,这两个基因调控的均是各自途径上的限速步骤,因此,它们的表达量可以表征该途径的通量,即植物对氰化物的解毒能力.
统计分析表明,三系的β-CAS表达量均随胁迫时间增大,但是增大的百分比和速度有显著的差异,其中,上升幅度最大的是母本,最小的是父本,天塔5号介于两者之间,三系之间均具有显著差异;从表达量上升的速度方面看,天塔5号和母本之间没有显著差异,却显著高于父本(见图1).
基因NIT的表达量随胁迫时间的延长,三系之间存在比较大的差异.父本植株的表达量有上升的趋势,天塔5号及母本则发生显著的下降,而且随着胁迫时间的延长,下降的幅度越大,这说明,盐胁迫后,天塔5号和母本细胞中氰化物转化为丙氨酸的途径通量下降,而父本则是发生上调(见图2).
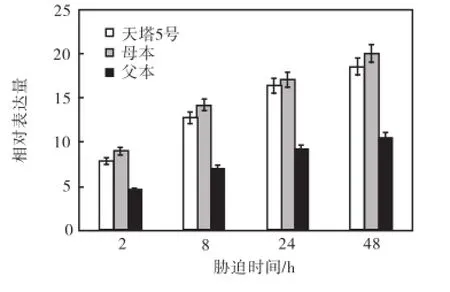
图1 β-CAS 基因相对表达量Fig.1 Expression level of β-CAS

图2 NIT 基因相对表达量Fig.2 Expression level of NIT
4 分析与讨论
本研究以天津本地的新品种天塔5号及其亲本三叶期幼苗作为实验材料,盐胁迫处理时间为2,h、8,h、24,h和48,h,对光合速率、植株性状、叶片氰化物的含量和氰化物代谢途径上两个关键基因β-CAS及NIT的表达量随胁迫时间的变化进行了考察和统计学分析.
结果表明,三叶期的天塔5号的根部显著长于父本,说明其对盐碱和干旱等胁迫具有更强的耐受性;同时,盐胁迫下三系的玉米叶片的光合速率均显著下降,叶片氰化物的含量显著上升,但是随着胁迫时间的延长,F1的光合速率和氰化物含量均率先趋于正常;同时基因β-CAS和NIT都对非生物胁迫有响应,其中,三系的β-CAS表达量均随着胁迫时间增大,而NIT的表达量变化则是父本表达量发生持续上调,天塔5号和母本则发生持续下调,在它们的共同作用下,胁迫后的植株的氰化物含量先上升后下降,联系三系胁迫后光合作用的变化和生长势的区别,说明这两个基因在对抵御非生物胁迫和氰化物解毒上具有重要的作用,并且在表型上有所体现.
但是,从三系在胁迫环境下光合作用和氰化物含量的变化情况看,它们均不是简单地随着β-CAS和NIT基因的变化而单调地变化,这说明胁迫之后很短的时间内,植物自身的抗逆机制响应不足,但随着时间的增长,抗逆机制响应充分后,胁迫所产生的副作用已经有所遏制.
不仅如此,本研究观测到的NIT表达量与前人得到的结论不同.O’Leary等[13]的研究发现,拟南芥遇到胁迫时,胞内氰化物含量增多的同时NIT4的表达量也升高,而且NIT4的表达量高低直接影响了细胞解毒的能力.对于这种结果,本研究认为,玉米作为高等植物,具有比拟南芥更复杂的代谢网络和更精密的调控机制,而且,不少人的研究也表明,比较高等植物,如烟草和水稻,在逆境中更倾向于把胞内多余的氮元素(包含氰化物)转化成天冬氨酸[19],天冬氨酸参与许多植物生理活动,例如提供TCA循环的底物、参与胞内信号传导等[20],对于维持植物生理具有重要的作用.同时,虽然此途径中,丙氨酸合成途径的通量下调,却不能简单地认为丙氨酸合成下降,这是因为氰化物解毒途径不是胞内丙氨酸的主要来源.因此本研究在此基础上提出猜想,高等植物在逆境环境下,氰化物解毒途径会发生响应,总体趋势是倾向于把氰化物转化为天冬氨酸.
植物抵抗非生物胁迫的机制很复杂,涉及多个代谢途径和物质,包括氧化还原酶系统、氨基酸和多糖类物质的合成与降解等,目前分子机理还存在许多谜团,因此,在今后的研究中将着重探索分子机理,将分子机理和生理特性联系起来,以期能破解植物抵抗非生物胁迫的机理,培育出抗逆能力更强的玉米品种.
5 结 语
本研究发现,在盐胁迫条件下,天塔5号叶片的氰化物含量显著低于亲本,氰化物解毒途径的响应也显著快于其亲本,说明该途径的快速响应提高了玉米植株解除氰化物毒性的能力和耐盐性,为后续利用玉米植株的该途径提高玉米非生物胁迫的抗逆性和吸收转化环境中的氰化物打下基础.
[1] Christel D,Eyer P,Hegemann M,et al. Pharmacokinetics of cyanide in poisoning of dogs,and the effect of 4-dimethylaminophenol or thiosulfate[J]. Archives of Toxicology,1977,38(3):177-189.
[2] Eisler R,Wiemeyer S N. Reviews of Environmental Contamination and Toxicology[M]. New York:Springer,2004.
[3] Kang D H,Hong L Y,Paul Schwab A,et al. Removal of Prussian blue from contaminated soil in the rhizosphere of cyanogenic plants[J]. Chemosphere,2007,69(9):1492-1498.
[4] Yu X Z,Gu J D. Differences in Michaelis-Menten kinetics for different cultivars of maize during cyanide removal[J]. Ecotoxicology and Environmental Safety,2007,67(2):254-259.
[5] Poulton J E. Cyanogenesis in plants[J]. Plant Physiology,1990,94(2):401-405.
[6] Yip W K,Yang S F. Cyanide metabolism in relation to ethylene production in plant tissues[J]. Plant Physiology,1988,88(2):473-476.
[7] Melanie M A,Georg G. Cyanide is an adequate agonist of the plant hormone ethylene for studying signalling of sensor kinase ETR1 at the molecular level[J]. Biochemical Journal,2012,444(2):261-267.
[8] Hendrickson H R,Conn E E. Cyanide metabolism in higher plants (Ⅳ). Purification and properties of the βcyanoalanine synthase of blue lupine[J]. Journal of Biological Chemistry,1969,244(10):2632-2640.
[9] Piotrowski M,Schönfelder S,Weiler E W. The Arabidopsis thaliana isogene NIT4 and its orthologs in tobacco encode beta-cyano-L-alanine hydratase/nitrilase[J]. The Journal of Biological Chemistry,2001,276(4):2616-2621.
[10] Vahala J,Ruonala R,Keinänen M,et al. Ethylene insensitivity modulates ozone-induced cell death in birch[J]. Plant Physiology,2003,132(1):185-195.
[11] Liang W S. Drought stress increases both cyanogenesis and β-cyanoalanine synthase activity in tobacco[J]. Plant Science,2003,165(5):1109-1115.
[12] Machingura M,Sidibe A,Wood A J,et al. The βcyanoalanine pathway is involved in the response to water deficit in Arabidopsis thaliana[J]. Plant Physiology and Biochemistry,2013,63(2):159-169.
[13] O’Leary B,Preston G M,Sweetlove L J. Increased βcyanoalanine nitrilase activity improves cyanide tolerance and assimilation in Arabidopsis[J]. Molecular Plant,2014,7(1):231-243.
[14] Hodges D M,Andrews C J,Johnson D A,et al. Antioxidant compound responses to chilling stress in differentially sensitive inbred maize lines[J]. Physiologia Plantarum,1996,98(4):685-692.
[15] Teasdale J R. Influence of corn(Zea mays)population and row spacing on corn and velvetleaf(Abutilon theophrasti)yield[J]. Weed Science,1998,46(4):447-453.
[16] 季 静,汪婷婷,王 罡,等. HAK基因对玉米的遗传转化及其耐盐性研究[J]. 天津大学学报:自然科学与工程技术版,2013,46(7):659-665.
Ji Jing,Wang Tingting,Wang Gang,et al. Genetic transformation of maize with HAK gene and its effect on salt tolerance[J]. Journal of Tianjin Univeristy:Science and Technology,2013,46(7):659-665(in Chinese).
[17] 季 静,杨海兰,王 罡,等. AtchyB基因过表达对转基因洋桔梗抗氧化性的影响[J]. 天津大学学报:自然科学与工程技术版,2014,47(8):735-740.
Ji Jing,Yang Hailan,Wang Gang,et al. Effect of over-expression of AtchyB on the oxidation resistance of transgenic eustoma grandiflorum[J]. Journal of Tianjin Univeristy:Science and Technology,2014,47(8):735-740(in Chinese).
[18] 中华人民共和国环境保护部. HJ 484—2009水质氰化物的测定容量法和分光光度法[S]. 北京:中国环境科学出版社,2009.
Ministry of Environmental Protection of the People's Republic of China. HJ 484—2009 Water Quality-Determination of Cyanide-Volumetric and Spectrophotometry Method[S]. Beijing:China Environmental Science Press,2009(in Chinese).
[19] Kirma M,Araújo W L,Fernie A R,et al. The multifaceted role of aspartate-family amino acids in plant metabolism[J]. Journal of Experimental Botany,2012,63(14):4995-5001.
[20] Atkins C A,Pate J S,Sharkey P J. Asparagine metabo
lism—Key to the nitrogen nutrition of developing legume seeds[J]. Plant Physiology,1975,56(6):807-812.
(责任编辑:田 军)
Expression and Biologic Effect of Cyanide Detoxification Genes β-CAS and NIT in Maize Under the Antibiotic Stress
Ji Jing1,2,Liu Jie1,2,Wang Gang2,Du Xilong1,2,Cao Haiyan1,2,Rong Fei2,Jin Chao2
(1. School of Chemical Engineering and Technology,Tianjin University,Tianjin 300072,China;2. Research Institute of Genetic Engineering,Tianjin University,Tianjin 300072,China)
Cyanide is poisonous to live organisms and environment. The cyanide content would burst out in cells when the plants are under the antibiotic stress,which is harmful to plants. Genes β-CAS and NIT are important genes involved in the cyanide detoxication. The Tianta 5(F1),and its parent lines were treated with 200 mmol/L NaCl for 2 h,8 h,24 h and 48 h,and the same lines were used as the control group when they were at three-leaf stage. The photosynthetic rate,the plant character,the cyanide content and the gene expression of β-CAS and NIT of Tianta 5 and its parent lines were detected. Then the data were analyzed statistically. The results indicated that the root of F1 was significantly longer than those of the parent lines;the photosynthetic rates of all lines were down-regulated after treated by salt,among which no significant difference was found between F1 and female parent.However,the photosynthetic rate of the male parent is significantly lower than that of F1.The cyanide content of F1 decreased earlier than its parents and the expression level of β-CAS was up-regulated for all lines,the female parent increasing the most while the male parent the least.The expression level of NIT of F1 and female parent was down-regulated while that of the male parent was up-regulated.
maize;cyanide;qRT-PCR;salt stress;antibiotic stress
Q786
A
0493-2137(2015)05-0409-06
10.11784/tdxbz201403073
2014-03-24;
2014-05-27.
国家自然科学基金资助项目(31271793,31271419);国家转基因生物新品种培育科技重大专项资助项目(2014ZX08003-002B).
季 静(1965— ),女,博士,教授,jijingtjdx@163.com.
王 罡,wanggangtjdx@126.com.
时间:2014-07-03. 网络出版地址:http://www.cnki.net/kcms/doi/10.11784/tdxbz201403073.html.

