低分子量罗非鱼眼透明质酸的制备及其抗氧化性研究
高瑞昌,陈 辉,,李来好,于 刚,吴燕燕,胡 晓,陈胜军,*
(1.江苏大学食品与生物工程学院,江苏镇江 212013;2.中国水产科学研究院南海水产研究所,农业部水产品加工重点实验室,国家水产品加工技术研发中心,广东广州 510300)
低分子量罗非鱼眼透明质酸的制备及其抗氧化性研究
高瑞昌1,陈 辉1,2,李来好2,于 刚2,吴燕燕2,胡 晓2,陈胜军2,*
(1.江苏大学食品与生物工程学院,江苏镇江 212013;2.中国水产科学研究院南海水产研究所,农业部水产品加工重点实验室,国家水产品加工技术研发中心,广东广州 510300)
本研究采用微波结合过氧化氢+抗坏血酸法降解罗非鱼眼透明质酸,通过改变降解条件制备相对分子量分别为小于5、5~10、10~30、30~60ku的低分子量透明质酸(LMWHA)。研究比较了不同分子量LMWHA对·OH、DPPH自由基的清除作用以及还原力的大小。结果显示,随着LMWHA分子量的降低其对DPPH的清除率以及还原力增大,而对·OH的清除率减小,这种现象可能与LMWHA清除自由基的作用机理有关,LMWHA清除DPPH自由基以及还原力的大小依赖于其双键的数量,而清除·OH能力的大小则依赖于LMWHA链上羟基以及其螯合过渡金属离子的能力。实验证明低分子量透明质酸具有良好的抗氧化性。
罗非鱼眼,透明质酸,降解,抗氧化
自由基在生物体新陈代谢的过程中不断产生,适量的自由基对维持人体的正常生理活动必不可少,如促进细胞的增殖分化、协助白血球吞噬微生物、参与蛋白质的合成等,但当其量超出一定水平的时候就会对人体造成较大的损害[1]。自由基能攻击细胞膜上的糖蛋白、磷脂,导致细胞膜的损害,引起细胞的破坏和突变[2];自由基能使生物体的大分子物质如多糖、蛋白质、核酸等发生氧化,从而加速人体的衰老,引起各种疾病,如心脏病、关节炎、白内障、癌症等[3-4]。研究发现,自然界中的抗氧化物质种类繁多,包括酚类、糖类、蛋白类、肽类,黄酮类等化合物,这些抗氧化剂通过直接或者间接的方式清除生物体内的自由基,从而减少自由基对生物体的损害。天然抗氧化剂安全、高效,使得其能在医药、食品、化妆品中得到广泛的利用。
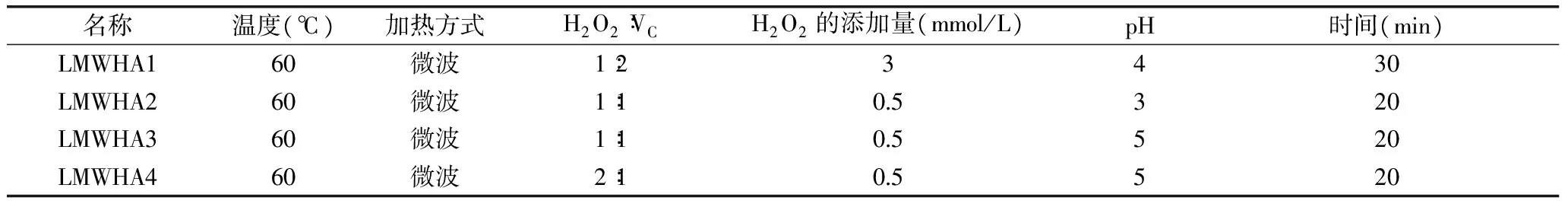
表1 不同分子量LMWHA的制备Table 1 The preparation of LMWHA with different molecular weight
透明质酸是一种活性多糖,其生物活性和分子量大小具有一定的相关性,LMWHA具有大分子量透明质酸所不具有的特殊生理功能,例如促进细胞增殖、调节机体的免疫功能、抗癌[5]、创伤修复[6]等。本文利用微波结合过氧化氢+抗坏血酸法降解罗非鱼眼透明质酸,制备分子量不同的LMWHA,并通过其研究对·OH、DPPH·的清除及还原力的大小考察LMWHA的抗氧化能力,利用紫外、红外光谱对其结构进行分析并初步探讨其抗氧化的机理。
1 材料与方法
1.1 材料与仪器
透明质酸 实验室自制,见实验方法;抗坏血酸、无水乙醇、咔唑、浓硫酸、氯化钠、氢氧化钠、浓盐酸、水杨酸、FeSO4、铁氰化钾、三氯乙酸、DPPH以上试剂均为分析纯;30% H2O2、PBS缓冲液(pH6.6)。
水浴震荡锅THZ-82 金坛市精达仪器制造厂;UV3紫外分光光度计 上海美谱达仪器有限公司;冷冻离心机 3K30,德国Sigma公司;真空冷冻干燥机 ALPHA1-4,德国Sigma公司;pH计 PE20,梅特勒托利多仪器有限公司;乌氏粘度计(0.5~0.6mm):上海申立玻璃仪器有限公司;红外光谱仪 IRAffinity-1,岛津;微波消解仪 MAS-Ⅱ,上海新仪微波化学科技有限公司。
1.2 实验方法
1.2.1 罗非鱼眼透明质酸的提取方法 参考文献[7-8]取未解冻的罗非鱼眼若干,取出玻璃体,脱脂,干燥后称取适量的玻璃体,加入0.2mol/L NaCl,搅匀,调节溶液pH,加入适宜的复合酶(胰蛋白酶和复合蛋白酶按酶活力1∶1混合),超声波处理一段时间后放入40℃水浴震荡锅中酶解提取,待其酶解完毕后进行灭酶,在6000r/min离心10min,取上清液超滤浓缩,加入乙醇进行沉淀,将沉淀的粗品利用十六烷基三甲基溴化铵(CTAB)进行纯化,利用离子交换层析进一步纯化,经透析后冷冻干燥,得到透明质酸。
1.2.2 低分子量透明质酸的制备 前期研究显示改变HA降解时溶液的pH、过氧化氢的加入量以及H2O2∶VC就可以得到不同相对分子量的透明质酸[7-8]。据此,配制一定浓度的HA溶液,按表1工艺条件制备相对分子量不同的LMWHA,分别命名为LMWHA1、LMWHA2、LMWHA3、LMWHA4。
1.2.3 低分子量透明质酸清除DPPH·能力的测定 二苯代苦味酰基(DPPH)能溶于有机溶剂,是一种相对稳定的自由基,其化学结构以氮为中心,其最大吸收波长为517nm,若对其提供质子,自由基被清除,吸光值下降,下降越多表明物质的抗氧化能力越强,因此其可以用来作为评价抗氧化剂抗氧化能力的评价指标。该法反应速度快、操作方便且反应灵敏,因此在评价天然抗氧化剂的抗氧化性能时最常使用[9]。

采用式(1)计算LMWHA对DPPH的清除率:

式(1)
1.2.4 低分子量透明质酸清除·OH能力的测定 根据Fenton反应原理可知,H2O2和FeSO4相互作用可以产生羟自由基,而水杨酸可以捕获羟自由基生产有色物质,该物质在510nm处有最大吸收;当向体系中加入抗氧化剂时,就会清除羟自由基,使得有色物质的含量下降,510nm处吸光值降低[4]。
参考Wei Liu等[12]的方法并略作改进,吸取1mL FeSO4(3mmol/L)放置比色管中,然后依次吸取1mL水杨酸-乙醇(3mmol/L)溶液和1mL不同浓度的LMWHA样液放置该比色管中,最后加入反应启动剂H2O2,混匀,37℃水浴30min,测量510nm处溶液的吸光值Ai;同理用水代替样液测量空白对照液的吸光值A0;用水代替水杨酸-乙醇溶液测量样品溶液的本底吸光值Aj,以消除样品本身的吸收对测量的影响。根据LMWHA浓度和清除率的关系得出清除率为50%时LMWHA的浓度,即为IC50。
根据式(2)计算·OH清除率:
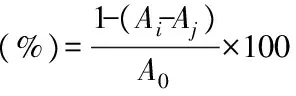
式(2)
1.2.5 低分子量透明质酸还原力的测定 抗氧化剂和铁氰化钾相互作用时,将其还原成亚铁氰化钾,而亚铁氰化钾能在FeCl3的作用下生成普鲁士兰,该物质在700nm有最大光吸收,因此可以根据反应液在700nm处吸光值的大小比较物质的抗氧化能力。
参考Sarikurkcu等[13]的方法并略作改进,取1mL不同浓度的LMWHA溶液,依次加入1mL磷酸盐缓冲液和1mL K3Fe(CN)6(1%),混匀,50℃水浴20min。取出降至室温,吸取10%的三氯乙酸1mL加至反应液中以终止反应,然后于4500r/min下离心10min,吸取2mL上清液,分别加入2mL蒸馏水、0.5mL FeCl3(0.1%)继续反应10min,测定溶液在700nm处的吸光度,以1mL蒸馏水代替样品溶液作为空白。
1.2.6 紫外光谱 配制浓度为0.25mg/mL的样品溶液,在波长190~400nm进行紫外扫描得到透明质酸的紫外光谱[14]。
1.2.7 红外光谱 称取干燥的透明质酸样品4~8mg,将其利用溴化钾压片法进行处理,然后利用红外光谱仪对样品在400~4000cm-1的范围内进行扫描,得到样品的红外光谱[14]。
1.2.8 透明质酸分子量的测定 用NaCl溶液配制不同浓度的透明质酸溶液,利用乌氏粘度计测量流出时间,根据式(3)和(4)分别计算出相对粘度ηr、比粘度ηsp,然后分别以透明质酸浓度Ci、ηsp/Ci为横纵坐标作图,进行线性回归,直线与Y轴的交点即为特性粘度[η],根据式(5)求出透明质酸的相对分子质量[15]。
式(3)
ηsp=ηr-1
式(4)
[η]=3.6×10-4Mr0.78
式(5)
1.3 数据处理方法
数据处理主要采用Excel、origin及Spss数据处理软件。
2 结果与分析
2.1 透明质酸的主要理化指标分析
通过对所得罗非鱼透明质酸各理化指标进行测定,表2中数据显示多得到的透明质酸的纯度符合英国药典要求,以葡萄糖醛酸含量表示纯度为40.40%。
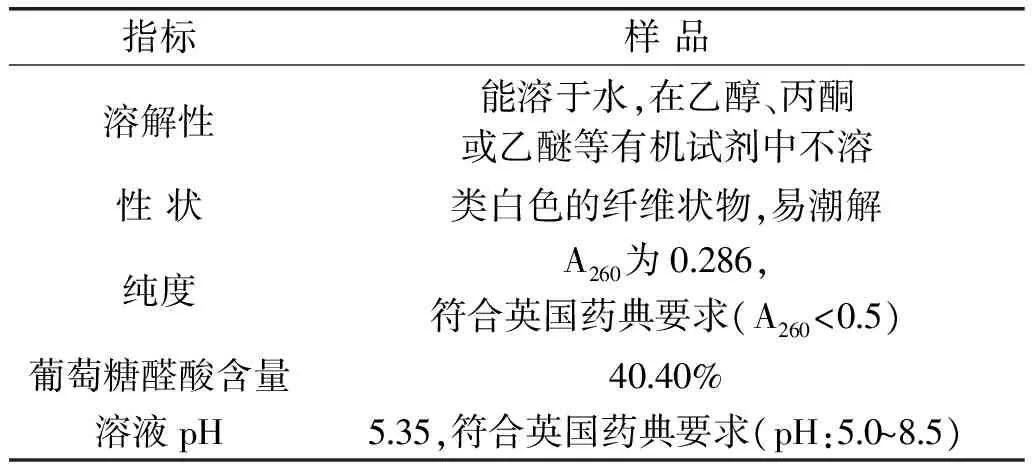
表2 HA的主要理化指标Table 2 The quality standard of HA
注:说明:透明质酸在260 nm处的吸光值及葡萄糖醛酸的含量均可以表征透明质酸的纯度[15]。
2.2 利用方法1.2.2制得不同分子量的透明质酸分子量
通过乌氏粘度计测量法对制备的透明质酸的分子量进行了分析,分子量区间和相对分子量分布如表3所示。通过对工艺条件的调整可使透明质酸进行定向降解,以获得不同分子量区间的低分子量透明质酸。

表3 LMWHA的分子量Table 3 The molecular weight of LMWHA
2.3 降解方法对透明质酸紫外光谱的影响
由图1可知,降解前后HA的紫外光谱略有差异,且随着的分子量的减小差异性越大。LMWHA在260nm处均出现不同程度的吸收,分子量越小吸收越大,说明降解对HA的微结构造成了影响,即在基团的某些键上造成了微小的变化,这可能源于降解时主链断裂或者脱氢反应产生的不饱和结构,Kim等人利用伽马射线降解透明质酸时,降解产物在265nm处出现吸收峰,随着射线剂量的加强吸收峰值越大[16]。

图1 不同分子量LMWHA的紫外图谱Fig.1 UV spectra of LMWHA with different molecular weight
2.4 降解方法对透明质酸红外光谱的影响
由图2可知,低分子量透明质酸和HA的红外吸收光谱一致,说明降解未对HA的基本结构造成较大影响。二者在3417.90cm-1处均有较强的吸收峰,此处为O-H、N-H的伸缩振动;在2935.66cm-1处有吸收,此处为C-H的伸缩振动,说明存在多甲基结构;1648.46、1412.54cm-1处分别为C=O、C-O的伸缩振动的吸收峰,1141.86、1076.28、1041.56cm-1分别代表C-O-C(氧桥)、C-O(六元环)和C-OH 结构;1564.63cm-1处为C-N伸缩振动的吸收峰,1317.37cm-1为O-H、N-H弯曲振动的吸收峰[17]。

图2 不同分子量LMWHA的红外光谱Fig.2 FT-IR spectra of LMWHA with different molecular weight
2.5 不同分子量透明质酸的DPPH·清除力的比较
由图3可知,不同分子量透明质酸清除DPPH·的效果均与HA的浓度 正相关,随着浓度的增大清除率升高。LMWHA1的清除效果最好,明显大于LMWHA2、LMWHA3、LMWHA4,在各浓度条件下均差异性显著(p<0.05),LMWHA2与LMWHA4差异性显著(p<0.05),而LMWHA2与LMWHA3、LMWHA3与LMWHA4差异性不显著(p>0.05)。当LMWHA1浓度为5mg/mL时,清除率达到89%,而此浓度下LMWHA2、LMWHA3、LMWHA4对DPPH·的清除率分别为49%、43%、38%,其值随着相对分子量的增大而增大,说明LMWHA清除DPPH·的能力和其相对分子量存在一定的相关性,分子量越大清除能力越差,这与邹朝晖等人的研究结果类似,随着辐照强度的增加HA的分子量逐渐下降,其清除DPPH·的能力也随之增强[18]。LMWHA的清除DPPH·的能力可能和其在260nm处的吸收有关,吸收越强其清除能力越强,而该波长的光吸收说明有双键的存在[16],微波结合过氧化氢+抗坏血酸降解法可能使得HA的吡喃羧酸环产生双键,且随着降解强度的增大双键数量越多,清除DPPH·的能力越强,Choi等人的研究也得到了类似的结果[7],因此LMWHA清除DPPH·的能力可能和其双键有关。

图3 不同分子量LMWHA对DPPH自由基的清除作用Fig.3 DPPH radical scavenging activity of LMWHA with different molecular weight
2.6 不同分子量透明质酸·OH清除率效果的比较
由图4可知,不同分子量大小的LMWHA均有较强的清除羟自由基的能力,且清除能力差异性较小,只在浓度为5mg/mL时LMWHA1、LMWHA2同LMWHA3、LMWHA4差异性显著(p<0.05),其他条件下四种LMWHA对羟自由基的清除率差异性均不显著(p>0.05)。LMWHA1、LMWHA2、LMWHA3、LMWHA4的IC50分别为4.39、4.64、4.78、4.82mg/mL,由IC50可知,随着LMWHA分子量的下降,其清除羟自由基的能力呈现小幅度降低,说明分子量的大小对HA清除·OH的能力有一定影响,但不是很显著。邹朝晖等人[18]利用60Co γ射线降解HA,随着辐照强度的增加HA的分子量逐渐下降,其清除·OH的能力也随之下降;杨文鸽等人[19]利用过氧化氢结合抗坏血酸法降解龙须菜多糖,降解后多糖清除·OH的能力下降,且分子量越低清除能力越差;代琼等人[8]研究发现分子量为10~80ku之间的LMWHA清除·OH的能力最强,当分子量小于10ku时,清除能力反而有所下降,但仍远大于降解前的HA。目前认为,透明质酸清除羟自由基的方式有两种[20]:一种是直接清除·OH,透明质酸分子链上存在大量的氢原子,其能与自由基结合生成水,通过对HA的结构进行分析可知,降解前后HA的基本结构未发生变化,可能并不影响HA链上的氢原子和·OH的结合;另一种是螯合产生·OH反应中所必须的过渡金属,如Fe3+、Cu2+,使得自由基反应中断,HA螯合金属离子的能力和其分子量大小没有直接的关系[21-22]。
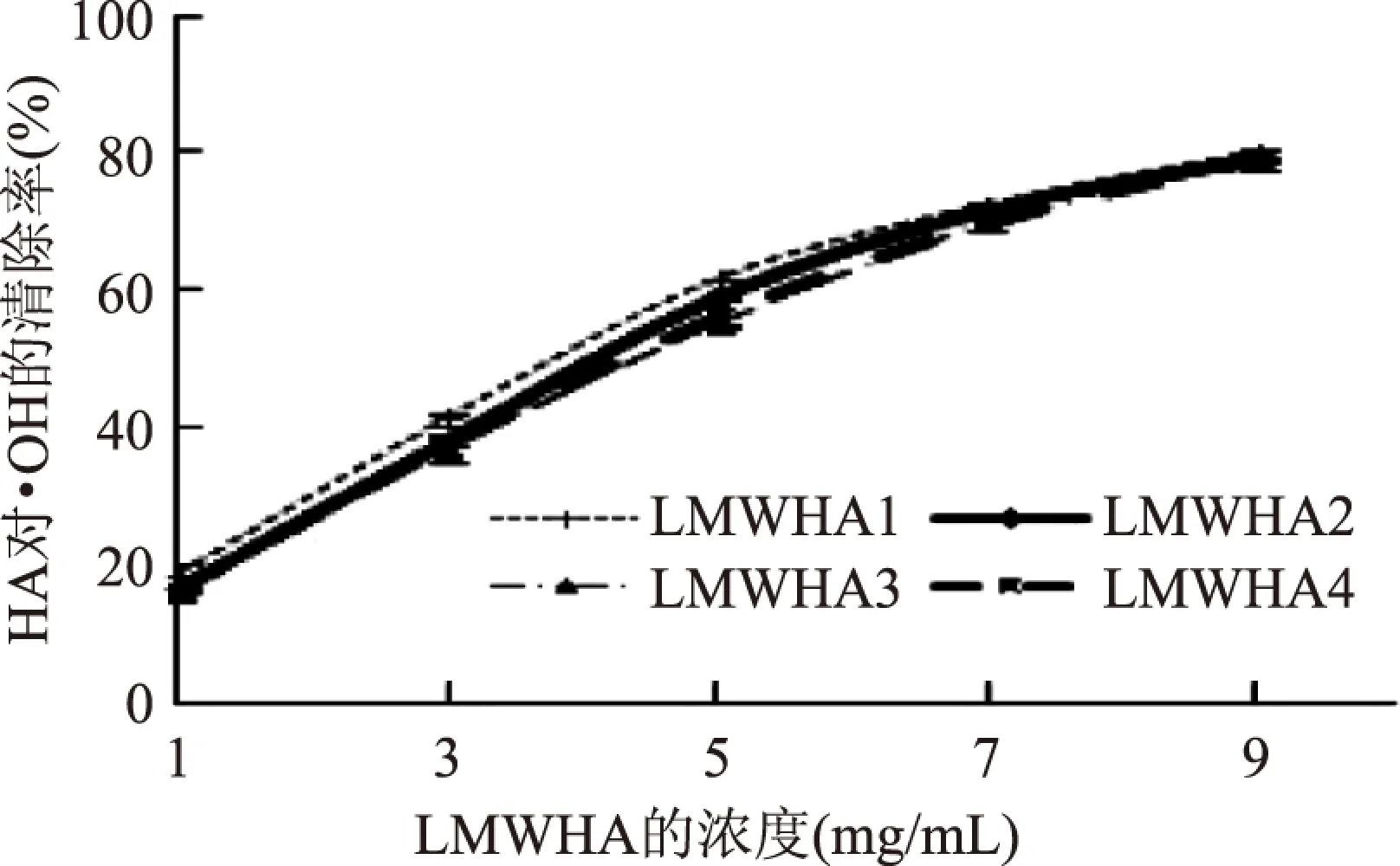
图4 不同分子量LMWHA对羟自由基的清除效果Fig.4 ·OH radical scavenging activity of LMWHA with different molecular weight
2.7 不同分子量透明质酸还原力效果的比较
3 总结
利用微波结合过氧化氢+抗坏血酸法降解罗非鱼眼透明质酸,通过改变HA降解时溶液的pH、过氧化氢的加入量以及H2O2∶VC制备相对分子量分别为小于5、5~10、10~30、30~60ku的LMWHA1、LMWHA2、LMWHA3、LMWHA4,并利用红外光谱、紫外光谱对其结构进行分析,降解前后HA的红外光谱基本一致,说明降解未对HA的基本结构造成影响,降解前后HA的紫外光谱稍有变化,LMWHA在260nm处均出现不同程度的吸收,分子量越小吸收越大,说明降解对HA的微结构造成了影响,这可能源于降解时主链断裂或者脱氢反应产生的不饱和结构。
本文通过研究LMWHA对·OH、DPPH·的清除率以及还原力来考察LMWHA的抗氧化能力。结果显示,随着LMWHA分子量的减小其对DPPH·的清除率以及还原力增大,而对·OH的清除率减小,这可能与LMWHA和自由基的作用机理有关,LMWHA清除DPPH·以及还原力的大小依赖于其双键的数量,而清除·OH能力大的大小则依赖于LMWHA链上羟基以及其螯合过渡金属离子的能力。以上只是对透明质酸抗氧化性及其机理的初步探讨,还需要进一步的科学研究。
[1]顾有方,陈会良,刘德义,等. 自由基的生理和病理作用[J]. 动物医学进展,2005,26(1):94-97.
[2]刘春红,马宇,何忠梅,等. 平贝母多糖的分离纯化及抗氧化活性研究[J]. 食品科学,2011,32(21):29-33.
[3]Raja B,Pugalendi K V. Evaluation of antioxidant activity of Melothria maderaspatanainvitro[J]. Central European journal of biology,2010,5(2):224-230.
[4]梁绍兰,覃冬,黄连秋,等. 柑橘皮多糖抗氧化性研究[J]. 安徽农业科学,2012,40(5):2624-2625.
[5]Misra S,Ghatak S,Toole B P. Regulation of MDR1 expression and drug resistance by a positive feedback loop involving hyaluronan,phosphoinositide 3-kinase,and ErbB2[J]. Journal of Biological Chemistry,2005,280(21):20310-20315.
[6]Nyman E,Huss F,Nyman T,etal. Hyaluronic acid,an important factor in the wound healing properties of amniotic fluid:Invitrostudies of re-epithelialisation in human skin wounds[J]. Journal of plastic surgery and hand surgery,2013,47(2):89-92.
[7]Choi J,Kim J,Kim J,etal. Degradation of hyaluronic acid powder by electron beam irradiation,gamma ray irradiation,microwave irradiation and thermal treatment:A comparative study[J]. Carbohydrate Polymers,2010,79(4):1080-1085.
[8]代琼,杨文鸽,陈小芳,等. 鱿鱼眼透明质酸及其降解产物的抗氧化和保湿作用[J]. 食品科学,2012,33(01).
[9]Han S S,Lo S C,Choi Y W,etal. Antioxidant activity of crude extract and pure compounds of Acer ginnala Max[J]. Bulletin of the Korean Chemical Society,2004,25(3):389-391.
[10]El-Safory N S,Lee C. Cytotoxic and antioxidant effects of unsaturated hyaluronic acid oligomers[J]. Carbohydrate Polymers,2010,82(4):1116-1123.
[11]郭欣,陈士国,薛长湖,等. 超声降解法制备可溶性鱿鱼墨黑色素及其抗氧化性[J]. 水产学报,2013,37(7):1113-1120.
[12]Liu W,Wang H,Pang X,etal. Characterization and antioxidant activity of two low-molecular-weight polysaccharides purified from the fruiting bodies ofGanoderma lucidum[J]. International journal of biological macromolecules,2010,46(4):451-457.
[13]Sarikurkcu C,Tepe B,Semiz D K,etal. Evaluation of metal concentration and antioxidant activity of three edible mushrooms from Mugla,Turkey[J]. Food and chemical toxicology,2010,48(5):1230-1233.
[14]Kanchana S,Arumugam M,Giji S,etal. Isolation,characterization and antioxidant activity of hyaluronic acid from marine bivalve mollusc[J]. 2013.
[15]Laurent T C,Ryan M,Pietruszkiewicz A. Fractionation of hyaluronic acid the polydispersity of hyaluronic acid from the bovine vitreous body[J]. Biochimica et biophysica acta,1960,42:476-485.
[16]Kim J K,Srinivasan P,Kim J H,etal. Structural and antioxidant properties of gamma irradiated hyaluronic acid[J]. Food chemistry,2008,109(4):763-770.
[17]Luan T,Wu L,Zhang H,etal. A study on the nature of intermolecular links in the cryotropic weak gels of hyaluronan[J].Carbohydrate Polymers,2012,87(3):2076-2085.
[18]邹朝晖,王强,王志东,等. 辐照对透明质酸抗氧化性及结构特性的影响[J]. 核农学报,2011,25(1):83-87.
[19]杨文鸽,谢果凰,徐大伦,等. 龙须菜多糖的降解及其降解产物的抗氧化活性[J]. 水产学报,2009,33(2):342-347.
[20]Wang J,Zhang Q,Zhang Z,etal. Antioxidant activity of sulfated polysaccharide fractions extracted fromLaminaria japonica[J]. International Journal of Biological Macromolecules,2008,42(2):127-132.
[21]Mercê A L R,Marques Carrera L C,Santos Romanholi L K,etal. Aqueous and solid complexes of iron(III)with hyaluronic acid:potentiometric titrations and infrared spectroscopy studies[J]. Journal of inorganic biochemistry,2002,89(3):212-218.

[23]柯春林,乔德亮,曾晓雄. 低分子量透明质酸的制备及其抗氧化活性的研究[J]. 食品工业科技,2010(1):107-111.
[24]张莲,王金鹏,孔子青,等. 硫酸软骨素的降解及其降解产物抗氧化活性的测定[J]. 食品工业科技,2012(12):180-182.
[25]Alkrad J A,Mrestani Y,Stroehl D,etal. Characterization of enzymatically digested hyaluronic acid using NMR,Raman,IR,and UV-vis spectroscopies[J]. Journal of pharmaceutical and biomedical analysis,2003,31(3):545-550.
[26]Campo G M,Avenoso A,Campo S,etal. Reduction of DNA fragmentation and hydroxyl radical production by hyaluronic acid and chondroitin-4-sulphate in iron plus ascorbate-induced oxidative stress in fibroblast cultures[J]. Free radical research,2004,38(6):601-611.
Preparation and antioxidant properties oflow molecular weigh hyaluronic acid from tilapia eye
GAO Rui-chang1,CHEN Hui1,2,LI Lai-hao2,YU Gang2,WU Yan-yan2,HU Xiao2,CHEN Sheng-jun2,*
(1.School of Food and Biological Engineering,Jiangsu University,Zhenjiang 212013,China;2.Key Laboratory of Aquatic Product Processing,Ministry of Agriculture;National R&D Center forAquatic Product Processing;South China Sea Fisheries Research Institute,CAFS,Guangzhou 510300,China)
LMWHA with relative molecular weight less than 5,5~10,10~30,30~60ku were prepared by changing the degradation conditions of the microwave combined with hydrogen peroxide and ascorbic acid. Reducing power,scavenging ability on ·OH and DPPH free radical of different molecular weight LMWHA were determined. Results showed that the scavenging ability of DPPH free radical and reducing power increased with molecular weight decreased,while the scavenging ability of ·OH decreased,this phenomenon may be associated with the mechanism of LMWHA removing free radicals,the scavenging ability of DPPH and reducing power of LMWHA depended on the number of the double bonds,but the scavenging ability of ·OH depended on the Hydroxyl groups of LMWHA and the ability of chelating transition metal ions. Therefore,low molecular weight hyaluronic acid had good oxidation resistance.
tilapia eyes;hyaluronic acid;degradation;antioxidation
2014-03-24
高瑞昌(1976-),男,博士,副教授,研究方向:水产品化学与综合利用。
*通讯作者:陈胜军(1973-),男,博士,副研究员,主要从事水产品加工与质量安全控制研究。
中央级公益性科研院所基本科研业务费专项资金(中国水产科学研究院南海水产研究所)资助项目(2013TS01);国家现代农业产业技术体系(CARS-49);江苏大学“青年骨干教师培养工程”。
TS254.9
A
1002-0306(2015)03-0060-05
10.13386/j.issn1002-0306.2015.03.003

