三七总皂苷对巨噬细胞分泌NO、TGF-β1、MMP-9的影响研究
祁 燕,袁嘉丽,万春平,赵文娟,陈一纾,邢海晶
(1.云南中医学院第一附属医院,云南昆明650000;2.云南中医学院,云南昆明650500)
慢性阻塞性肺疾病(Chronic obstructive pulmonary disease,COPD)是一种气流受限呈进行性发展,以气道炎症和气道重建为主要特征,可以预防和治疗的慢性肺部疾病。COPD气道炎症以中性粒细胞、巨噬细胞、CD8+T淋巴细胞浸润为主,其中巨噬细胞作为参与气道固有免疫应答的重要细胞,广泛分布在肺泡内及支气管表面,也是肺部接触抗原较早、机会最多的免疫细胞,在气道防御反应中发挥吞噬作用的同时也参与了气道炎症的形成[1]。气道反复的慢性炎症刺激导致气道壁组织损伤和异常修复过程反复进行,在此异常修复过程中发生的气道壁结构重构即气道重建。气道重建呈进行性发展,最终造成气道狭窄、气流受限。所以,防治炎症是COPD长期以来的重点和难点。当巨噬细胞受到细菌内毒素等因素刺激时被激活会释放一系列细胞因子如一氧化氮(NO)、转化生长因子-β1(TGF-β1)、基质金属蛋白酶-9(MMP-9)等参与 COPD气道炎症及气道重建等病理过程[2-4]。三七总皂苷是我国名贵中药三七的主要活性成分,其可加快血流速度,降低血液黏度,改善机体微循环;可缓解支气管痉挛,抑制炎症反应,改善肺泡通气功能,促进慢性阻塞性肺疾病急性加重期(AECOPD)患者的恢复[5]。其用于治疗COPD也获明显疗效[6-7]。课题组前期动物实验研究也表明,三七总皂苷可降低COPD模型大鼠血清中TGF-β1、MMP-9水平,从而达到缓解COPD发展进程中气道炎症及气道重建的作用[8]。本研究以前期课题组用三七总皂苷干预COPD动物模型的疗效为基础,采用脂多糖(LPS)激活RAW264.7巨噬细胞构建COPD发病过程中气道组织损伤的炎症细胞模型,在细胞水平观察三七总皂苷对巨噬细胞分泌及表达NO、MMP-9、TGF-β1的作用,以进一步探讨三七总皂苷防治COPD发病过程中气道炎症及气道重建的效应机制,为三七总皂苷临床治疗COPD提供实验依据。
1 实验资料
1.1 药物 三七总皂苷(注射用血塞通)购自昆明制药集团股份有限公司,400 mg/支,批号:100707。地塞米松注射液购自西南药业股份有限公司,5 mg/支,批号:120721。
1.2 细胞 RAW264.7巨噬细胞购自中国科学院昆明细胞库。
1.3 实验试剂及仪器 RPMI-1640培养基购自GibcoBRL公司;胎牛血清购自Hyclone;总RNA提取试剂盒购自天根;逆转录试剂盒及SYBR Premix Ex TaqⅡ均购自TaKaRa;引物(TGF-β1,MMP-9)均由大连宝生物工程有限公司合成。恒温CO2细胞培养箱(Trermo公司,型号:3111);ABI PCR仪(Gene公司,型号:Veriti);安捷伦核酸扩增荧光检测仪(Gene公司,型号:MX3000P);Epoch连续波长酶标仪购自美国Bio-Tek公司。
1.4 方法
1.4.1 细胞培养 用含10%胎牛血清的1640培养基于37℃,5%CO2恒温培养箱中常规培养RAW264.7巨噬细胞,细胞经传代至4~5代,处于对数生长期时进行实验。
1.4.2 MTT法测定三七总皂苷对RAW264.7细胞增殖的影响 RAW264.7细胞以1×109L-1接种于96孔板,每孔100 μL。细胞分为 3组:三七总皂苷组每孔加入不同浓度的三七总皂苷药液(10,30,100,300,900,2700 μg/mL),地塞米松组每孔加入100 μg/mL地塞米松,正常对照组以1640培养基正常培养。每组3个复孔,以37℃、5%CO2培养24 h后每孔加入终浓度5 mg/mL MTT,继续培养4 h,小心吸弃上清,每孔加入150 μL DMSO,震荡10 min后在酶标仪上570 nm处测各孔的吸光值(OD)。
1.4.3 Griess法测定RAW264.7细胞培养上清液中NO的含量 RAW264.7细胞分为正常对照组(以1640培养基正常培养)、LPS组(1 μg/mL LPS)、LPS+三七总皂苷不同浓度组(1 μg/mL LPS+10,30,100,300 μg/mL 三七总皂苷)、LPS+地塞米松组(1 μg/mL LPS+100 μg/mL地塞米松)。细胞以1×109L-1接种于96孔板,每孔100 μL,每组重复3孔,同时按照分组加入对应浓度药物50 μL置于37℃,5%CO2培养箱中孵育1 h 后,再加入1 μg/mL LPS 50 μL 以激活 RAW264.7 细胞。24 h后收取细胞培养上清,置于-20℃待测。检测时以50 μL培养液上清与100 μL Griess混合试剂[1%对氨基苯磺酸溶液+0.1%N-(1-萘基)乙二胺二盐酸盐溶液等体积]充分混合、振摇10 min,酶标仪上540 nm处测量吸光度。根据标准曲线计算NO释放量。
1.4.4 RAW264.7细胞培养上清液中 TGF-β1、MMP-9含量检测 细胞分组及给药同1.4.3,取细胞培养上清后按照酶联免疫(ELISA)试剂盒说明书检测上清中 TGF-β1及MMP-9含量。
1.4.5 实时荧光定量PCR检测 RAW264.7细胞TGF-β1mRNA、MMP-9mRNA水平 RAW264.7细胞以1×109L-1接种于6孔板,每孔1 mL。细胞分组及给药同1.4.3,细胞培养24 h后每孔细胞加入1 mL trizol提取试剂提取细胞总RNA,按TaKaRa逆转录试剂盒说明书操作合成cDNA,采用SYBR GreenI嵌合荧光法于荧光定量PCR仪中进行扩增,以小鼠β-actin基因为内参对照。反应体系为:SYBR Premix Ex TaqⅡ12.5 μL ,Primer F 1 μL,Primer R 1 μL,cDNA 2μL,ddH2O 8.5 μL 扩增条件:95 ℃ 30 s,95 ℃ 5 s,62℃ 30 s,共40个循环。实验设置3个平行复孔,并重复3次实验,取平均值。用2-ΔΔCT计算基因相对表达量。根据基因库中基因序列设计TGF-β1、MMP-9基因及内参基因β-actin引物,各基因引物序列见表1。
1.5 统计学方法 所有实验数据采用SPSS 17.0统计软件包处理。均值间差异比较采用t检验或单因素方差分析,P<0.05为差异有统计学意义。
2 结果
2.1 各组RAW264.7细胞增殖情况 三七总皂苷在10~300 μg/mL范围内细胞增殖情况与正常对照组比较差异无统计学意义,900 μg/mL和2700 μg/mL细胞增殖情况与正常对照组比较差异有统计学意义(P均<0.01),见表2。提示三七总皂苷在10~300 μg/mL范围内对细胞无毒性作用,可在此剂量范围内进行实验。

表1 Q-PCR引物序列
表2 各组RAW264.7细胞增殖情况(±s)
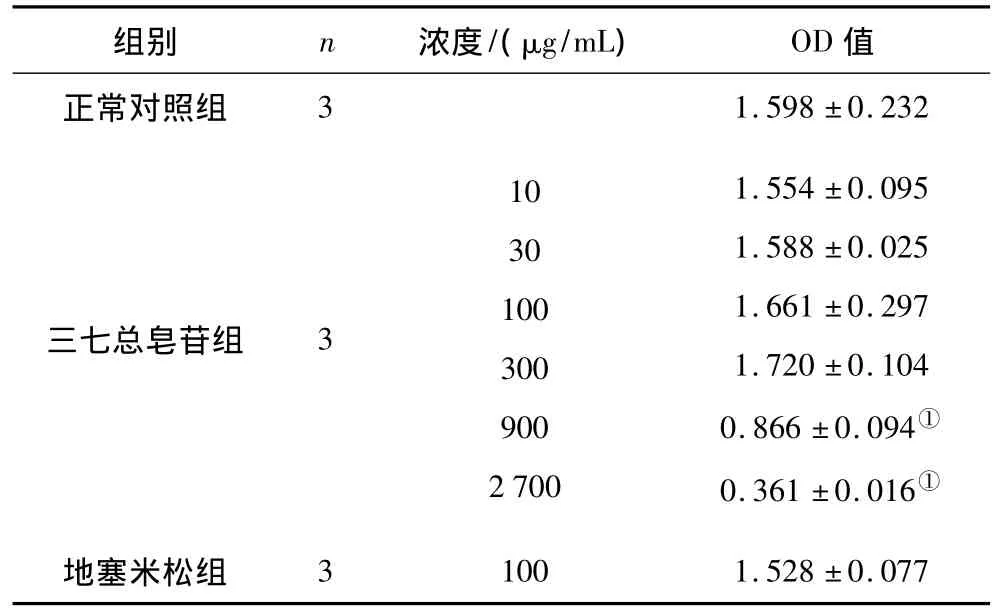
表2 各组RAW264.7细胞增殖情况(±s)
注:①与正常对照组比较,P<0.01。
组别 n 浓度/(μg/mL) OD值正常对照组31.598 ±0.232三七总皂苷组 3103010030090027001.554 ±0.0951.588 ±0.0251.661 ±0.2971.720 ±0.1040.866 ±0.094①0.361 ±0.016①地塞米松组31001.528 ±0.077
2.2 各组RAW264.7细胞NO释放情况 LPS组细胞培养液中NO含量显著高于正常对照组(P<0.01)。三七总皂苷100,300 μg/mL组和地塞米松组细胞培养液中NO含量显著低于LPS组(P均<0.01)。见表3。
表3 各组RAW264.7细胞NO释放情况(±s)
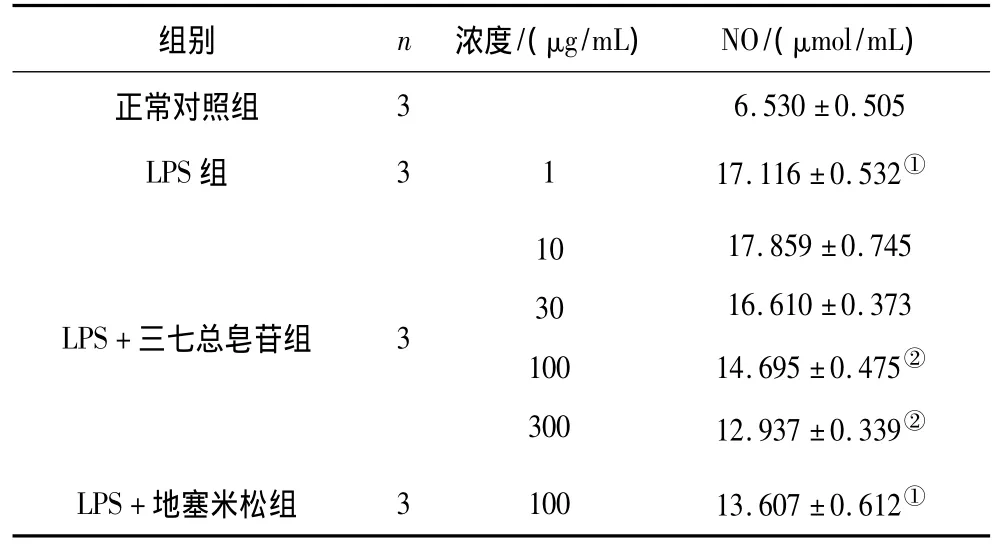
表3 各组RAW264.7细胞NO释放情况(±s)
注:①与正常对照组比较,P <0.01;②与 LPS组比较,P <0.01。
组别 n 浓度/(μg/mL) NO/(μmol/mL)正常对照组36.530 ±0.505 LPS 组 3117.116 ±0.532①LPS+三七总皂苷组 3103010030017.859 ±0.74516.610 ±0.37314.695 ±0.475②12.937 ±0.339②LPS+地塞米松组 310013.607 ±0.612①
2.3 各组RAW264.7细胞上清中TGF-β1、MMP-9分泌情况 LPS组细胞培养液中TGF-β1、MMP-9含量显著高于正常对照组(P<0.05或P<0.01)。LPS+三七总皂苷100,300 μg/mL组及LPS+地塞米松组细胞培养液中TGF-β1含量显著低于LPS组(P均<0.05);LPS+三七总皂苷300 μg/mL组、LPS+地塞米松组细胞培养液中MMP-9含量显著低于 LPS组(P<0.01或P<0.05)。见表4。
2.4 各组RAW264.7细胞TGF-β1mRNA、MMP-9mRNA表达情况 检测所提取样本总 RNA A260/A280在1.8~2.0,RNA较纯,无蛋白质污染,内参及目的基因标准曲线相关系数大于0.99,扩增效率90%~120%,内参及目的基因溶解曲线峰形单一,扩增产物特异性较好。Real-time PCR检测结果显示,LPS组中TGF-β1mRNA、MMP-9 mRNA的表达量明显高于正常对照组(P均<0.05)。LPS+三七总皂苷300 μg/mL组、LPS+地塞米松组MMP-9 mRNA表达量明显低于 LPS组(P均 <0.05);LPS+三七总皂苷100,300 μg/mL组及LPS+地塞米松组TGF-β1mRNA表达量明显低于LPS组(P<0.05或P<0.01)。见表5。
表4 各组RAW264.7细胞上清中TGF-β1、MMP-9分泌情况(±s)
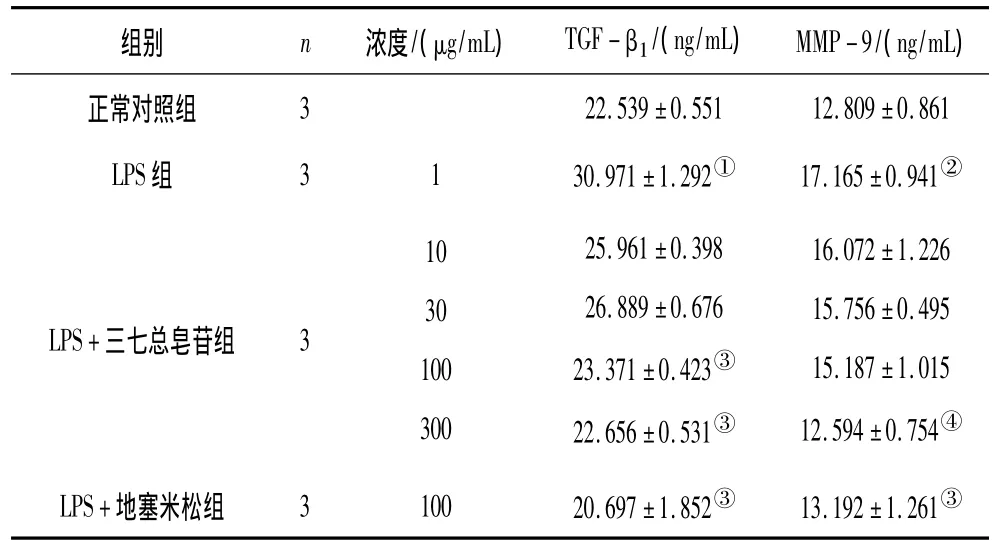
表4 各组RAW264.7细胞上清中TGF-β1、MMP-9分泌情况(±s)
注:①与正常对照组比较,P<0.05;②与正常对照组比较,P<0.01;③与 LPS组比较,P <0.05;④与 LPS组比较,P <0.01。
组别 n 浓度/(μg/mL) TGF-β1/(ng/mL) MMP-9/(ng/mL)正常对照组322.539±0.55112.809±0.861 LPS组 3130.971±1.292① 17.165±0.941②LPS+三七总皂苷组 3103010030025.961±0.39826.889±0.67623.371±0.423③22.656±0.531③16.072±1.22615.756±0.49515.187±1.01512.594±0.754④LPS+地塞米松组 310020.697±1.852③ 13.192±1.261③
表5 各组RAW264.7细胞TGF-β1mRNA、MMP-9 mRNA表达情况(±s)

表5 各组RAW264.7细胞TGF-β1mRNA、MMP-9 mRNA表达情况(±s)
注:①与正常对照组比较,P<0.05;②与 LPS组比较,P<0.05;③与 LPS组比较,P <0.01。
组别 n 浓度/(μg/mL) TGF-β1mRNA MMP-9 mRNA正常对照组31.001.00 LPS组 311.90±0.073① 2.59 ±0.319①LPS+三七总皂苷组 310301003001.52±0.2101.45 ±0.2551.31±0.164②0.95 ±0.4961.95 ±0.0892.09 ±0.2032.06 ±0.4391.47 ±0.090②LPS+地塞米松组 31000.99±0.179③ 1.56±0.095②
3 讨论
巨噬细胞的激活是炎症反应的重要环节,LPS等激活巨噬细胞后在酶的催化下合成过量的NO[9],可介导并放大炎症反应,促进肺组织的炎性渗出及肺泡的损伤。研究报道COPD患者NO的生成及释放增多,测定NO升高可提示存在气道炎症[10]。巨噬细胞激活后分泌过高的MMP-9对炎性细胞有趋化作用,可促进炎症发展,更为重要的是MMP-9可降解细胞外基质,使肺泡结构破坏,参与COPD气道重建过程,导致气流阻塞。对COPD动物模型及COPD患者的研究表明,其体内肺组织、血液中MMP-9表达水平均升高[11-12]。此外巨噬细胞分泌的TGF-β1是气道重建的主要调控因子[13],其表达增高,可引起气道上皮细胞损伤,诱导成纤维细胞向肌成纤维细胞转化,肌成纤维细胞具有更强的胶原合成活性,故促进气道胶原沉积和基底膜增厚,促进结缔组织蛋白合成[14-16],在气道重建中发挥重要作用,最终可导致气道狭窄和不可逆的肺功能改变。因此,能拮抗巨噬细胞分泌NO、MMP-9、TGF-β1的药物可能减轻气道炎症反应,延缓气道重建过程,减缓COPD的发病。
本研究通过MTT法检测发现三七总皂苷在10~300 μg/mL范围内未对细胞产生明显毒性作用;未经LPS刺激的正常对照组NO、MMP-9、TGF-β1分泌较少,且 MMP-9、TGF-β1mRNA 表达较低,加入 LPS刺激后,NO、MMP-9、TGF-β1释放量显著增加,MMP-9、TGF-β1mRNA表达亦上调,表明LPS能够诱导RAW264.7巨噬细胞过度激活,释放炎症相关递质。经三七总皂苷干预后,三七总皂苷100 μg/mL组和300 μg/mL组与 LPS组相比,NO、MMP -9、TGF - β1含量均降低 ,MMP-9、TGF-β1mRNA表达亦明显下调,提示三七总皂苷能够从细胞水平和转录水平上抑制 LPS诱导的RAW264.7巨噬细胞分泌的功能。
综上所述,三七总皂苷可能是通过下调 NO、TGF-β1、MMP-9的表达抑制巨噬细胞产生的炎症反应,从而推测此途径可能是其临床治疗COPD获效的作用机制之一,而要明确三七总皂苷治疗COPD的分子调控体系、信号转导通路尚需进一步深入研究,这也是今后积极研究的方向。
[1] 常嘉琛,焦宗宪.肺泡巨噬细胞及其相关细胞因子与慢性阻塞性肺疾病相互关系研究进展[J].国际呼吸杂志,2012,32(21):1641-1645
[2] 王月州.COPD患者治疗前后血清NO、NOS和GM-CSF检测的临床意义[J].放射免疫学杂志,2011,24(6):631-633
[3] 李若葆,王菁,李洪先,等.COPD模型大鼠肺组织TGF-β1的表达及意义[J].山东医药,2008,48(13):7-8
[4] 毕辉,李玲玲,姚欣.sirtuin-1在肺泡巨噬细胞金属基质蛋白酶9表达中作用[J].南京医科大学学报:自然科学版,2014,34(8):1015-1018
[5] 徐勇.三七总皂苷在AECOPD治疗中的临床应用[J].临床肺科杂志,2013,18(3):515 -522
[6] 周爱珠.三七总皂苷注射液治疗慢性阻塞性肺疾病急性加重期疗效观察[J].中华实用诊断与治疗杂志,2013,27(7):696-698
[7] 吉冬元,孟庆华,李承红.三七总皂苷片改善慢性阻塞性肺疾病稳定期患者生活质量的研究[J].湖北中医杂志,2010,32(2):7-8
[8] 吴敏.益气活血法对OOPD模型大鼠气道重塑调节作用的初步研究[D].昆明:云南中医学院,2013
[9] 何涛,陈宏辉,王正根.埃索美拉唑抑制LPS诱导小鼠巨噬细胞产生 NO 和 PGE2[J].免疫学杂志,2014,30(1):61-64
[10] 刘红艳,赵卉.慢性阻塞性肺疾病患者呼出气一氧化氮测定的临床意义[J].安徽医学,2013,34(8):1115-1117
[11] Yao H,Hwang JW,Sundar IK,et al.SIRT1 redresses the imbalance of tissue inhibitor of matrix metalloproteinase-1 and matrix metalloproteinase-9 in the development of mouse emphysema and human COPD[J].Am J Physiol Lung Cell Mol Physiol,2013,305(9):615
[12] Kobayashi S,Fujinawa R,Ota F,et al.A single dose ofLipopolysaccharide into mice with emphysema mimics human chronic obstructive pulmonary disease exacerbation as assessed by micro-computed tomography[J].Am J Respir Cell Mol Biol,2013,49(6):971
[13] Chen M,Lv Z,Huang L,et al.Triptolide inhibits TGF - β1- induced cell proliferation in rat airway smooth muscle cells by suppressing Smad signaling[J].Exp Cell Res,2015,331(2):362-368
[14] Kohan M,Bader R,Puxeddu I,et al.Enhanced osteopontin expression in a murine model of allergen-induced airway remodeling[J].Clin Exp Allergy,2007,37(10):1444 -1454
[15] Doherty T,Broide D.Cytokines and growth factors in airway remodeling in asthma[J].Curr Opin Immunol,2007,19(6):676 - 680
[16] Bhaskaran M,Kolliputi N,Wang Y,et al.Trans-differentiation of alveolar epithelial typeⅡcells to typeⅠcells involves autocrine signaling by transforming growth factor betal through the smad pathway[J].Biol Chem,2007,282(6):3968 -3976

