曲妥珠单抗联合含紫杉类方案治疗HER-2阳性晚期乳腺癌疗效观察
胡爱玲
(江苏省洪泽县人民医院,江苏洪泽223100)
乳腺癌是女性恶性肿瘤中最常见的一种,其致死率在因癌致死疾病中仅次于肺癌,其中有近30%患者出现人表皮生长因子受体2(HER-2)表达阳性[1-2]。虽然目前临床已经开展早期筛查且早期诊断技术也在不断提高,但其发病率仍在不断升高,且出现年轻化趋势,这可能与现代女性的不良生活习惯、压力等因素有关。对于晚期乳腺癌的传统临床治疗措施主要以化疗为主,而随着对癌症研究的逐渐深入,针对不同分子靶点的抗肿瘤药物与针对相关基因的特异性治疗方案也逐渐应用于临床。曲妥珠单抗是人源化的单克隆抗体,属于发现、应用较早的分子靶向药物,而其作用靶点则在HER-2上,因此可以通过发挥抗体介导的细胞毒性作用抑制癌症细胞[3-4]。2011年 4 月—2014 年 5月,笔者观察了紫杉类(TAX)方案化疗的同时联合曲妥珠单抗治疗HER-2阳性晚期乳腺癌患者的疗效,现将结果报道如下。
1 临床资料
1.1 一般资料 选取上述时期本院收治的HER-2阳性晚期乳腺癌患者68例,均符合乳腺癌诊断标准[5],经病理学活检均已证实;免疫组化检验结果显示HER-2标记物呈阳性表达,临床分期为晚期,病灶可测量[6];预计生存期不低于3个月,Karnofsky评分不低于60分;具有完整、详细的临床病例资料以及相关肿瘤标志物的检查结果;入组前1个月内未实施放化疗及其他相关治疗;实验前均了解相关内容,自愿参与并签署知情同意书,符合医学伦理学要求。排除既往其他恶性肿瘤史或手术史、外伤史者,拒绝化疗或对化疗耐受极差无法实施化疗方案者,因个人因素无法配合治疗或无法完成整体治疗方案者。随机分为 2组:观察组34例,年龄28~74(43.91±10.16)岁;HER -2(+)3 例,(⧺)13 例,(⧻)18例。对照组34例,年龄31~73(45.12±9.35)岁;HER-2(+)2例,(⧺)13例,(⧻)19例。 2组基本情况比较差异均无统计学意义(P均>0.05),具有可比性。
1.2 治疗方法 对照组化疗前给予雷赛隆3 mg抑制呕吐、恶心;TAX 135 mg/m2静脉点滴,3周为1周期重复。观察组在对照组治疗基础上联合应用曲妥珠单抗,首次4 mg/kg静滴,而后剂量减半,每周给药1次,连续用药超过2个月。
1.3 观察指标 观察 2组治疗后病灶改变情况,评价 2组临床治疗效果。使用酶联免疫法测定 2组治疗前后血清相关肿瘤标志物癌胚抗原(CEA)、癌相关糖蛋白抗原(CA153)、组织多肽特异性抗原(TPS)水平,抽取患者5 mL清晨空腹静脉血,离心留取血清冷藏保存后统一进行测定。
1.4 疗效评定标准[7]完全缓解(CR):目标病灶完全或基本消失,相关肿瘤标志物血清水平降至正常并维持不低于4周;部分缓解(PR):目标病灶最长径之和减少不低于30%,且没有新发病灶亦无扩大病灶,肿瘤标志物水平降低超过65%并维持不低于4周;稳定(SD):目标病灶最长径之和减少程度低于PR或扩大程度低于PD,标志物水平降低程度低于PR或升高程度低于PD;进展(PD):目标病灶最长径之和扩大超过20%,或出现新发病灶,标志物水平升高超过40%。客观有效率为CR+PR所占百分比,临床收益率为CR+PR+SD所占百分比。
1.5 统计学方法 采用SPSS 17.0版统计软件进行临床数据分析。计数资料以例(%)表示,采用χ2检验;计量资料以±s表示,采用t检验。P<0.05为差异有统计学意义。
2 结果
2.1 2组临床治疗效果对比 观察组治疗后客观有效率、临床收益率均明显高于对照组(P均<0.05)。见表1。
2.2 2组治疗前后血清CEA、CA153、TPS水平比较 2组治疗后血清CEA、CA153、TPS水平均较治疗前明显降低(P均<0.05),且观察组明显低于对照组(P均<0.05)。见表2。
3 讨论
乳腺癌在世界范围内是发病率最高的女性恶性肿瘤,每年约100多万女性新发乳腺癌,而死于乳腺癌者更是多达40余万[8]。虽然随着经济快速发展、人们生活水平与健康意识提高,社会及医学界对该病重视程度已逐渐提高,临床上也逐步开展早筛查、早诊断、早治疗,且相关的检查、诊疗技术及相应器械不断更新完善,但其发病率仍居高不下,且有上升趋势。
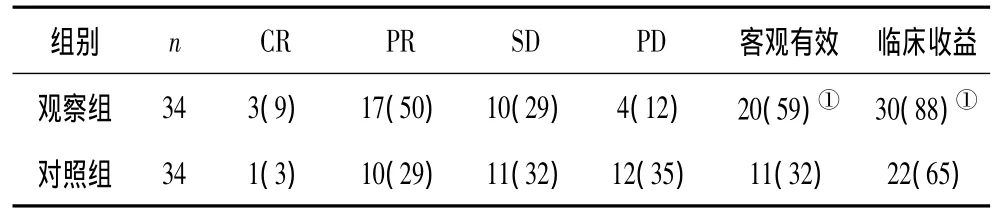
表1 2组临床疗效对比 例(%)
表2 2组治疗前后血清CEA、CA153、TPS水平比较(±s)
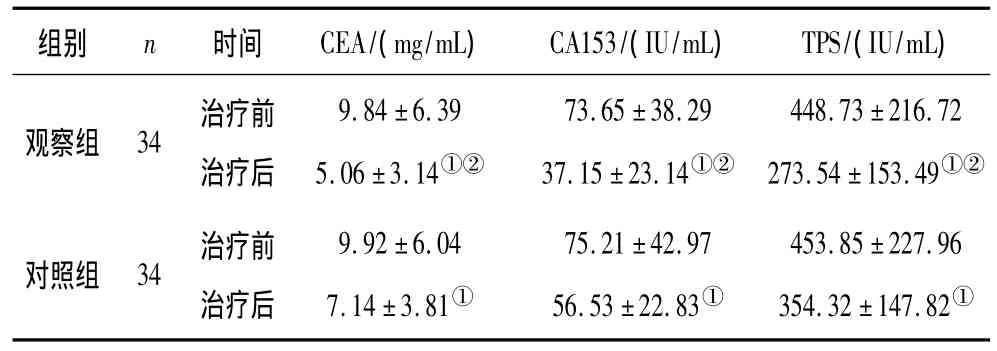
表2 2组治疗前后血清CEA、CA153、TPS水平比较(±s)
注:①与治疗前比较,P <0.05;②与对照组比较,P <0.05。
组别 n 时间 CEA/(mg/mL) CA153/(IU/mL) TPS/(IU/mL)观察组 34 治疗前治疗后9.84 ±6.395.06 ±3.14①②73.65 ±38.2937.15±23.14①②448.73 ±216.72273.54 ±153.49①②对照组 34 治疗前治疗后9.92±6.047.14 ±3.81①75.21 ±42.9756.53 ±22.83①453.85 ±227.96354.32±147.82①
乳腺癌晚期尤其HER-2表达阳性患者机体状况较差,治疗后复发率及转移率均高于HER-2表达阴性患者,在临床上需要引起重视。相关研究结果显示,HER-2阳性晚期乳腺癌患者相比其他患者的无发展生存时间及总生存时间明显缩短,无发展生存率与总生存率同样明显降低[9]。该类肿瘤负荷较大、增殖指数较高,更容易发生淋巴结转移,且组织学分级较差,而激素受体呈阴性的比例更高。以往临床上治疗乳腺癌的方式主要包括手术、放疗、化疗及内分泌治疗、生物治疗等,其中以化疗与内分泌治疗作为主要的常规治疗措施。单纯应用化疗或内分泌治疗并不能提供稳定、确切的临床效果,对HER-2阳性患者病情抑制能力较差,容易出现转移,且细胞毒性的化疗药物常会造成晚期患者无法耐受而中断治疗甚至放弃治疗的情况出现。因此临床上需要寻求疗效稳定、不良反应较轻、耐受性好的治疗方式来进一步完善对HER-2阳性晚期乳腺癌患者的治疗。
近年来肿瘤细胞学与分子生物学在我国医学界得到快速且全面的发展,在此基础上分子靶向治疗药物及作用方式得到重视并逐渐研发、应用于临床。这种治疗方式可以针对性极强地作用到细胞癌变的各个具体环节中,比如单一的介入到细胞信号传统通路、抗肿瘤血管形成,或直接作用在细胞因子与受体、原癌/抑癌基因上,进而在分子水平直接将恶性的生物学行为予以制止或逆转,以此来控制肿瘤细胞分化、生长,促使其消退。这种新型的生物治疗方式的特异性极高,可以仅针对单一的靶向目标进行攻击,选择性地治疗某一类蛋白质分子或基因产物,对肿瘤细胞形成直接杀伤,而将对其他正常组织细胞的影响、损伤降至最低,其治疗效果更为确切,而不良反应较传统化疗药物则明显降低[10]。
HER-2基因的过度表达通常意味着肿瘤恶性程度更高,更容易出现转移,且对放化疗效果较差,这也是传统治疗措施疗效不稳定、易转移的原因。曲妥珠单抗是高纯度的重组DNA衍生人源性单克隆抗体,对HER-2受体具有极高的选择性与针对性,是分子靶向治疗药物,也是针对HER-2阳性表达的晚期乳腺癌患者新型的生物治疗措施。有研究显示,曲妥珠单抗可以对HER-2蛋白表达进行有效抑制,干扰其他EGFR家族成员通过交联而生成异质二聚体,能够使细胞生长信号降低传递[11];同时可以对HER-2受体内吞降解进行介导使细胞表面密度降低,从而对肿瘤生长予以抑制。此外亦有研究表明该药物能够通过对HER-2过度表达的肿瘤细胞介导其抗体依赖的细胞介导的细胞毒性作用(ADCC)、补体依赖的细胞毒性作用(CDC)等机制对肿瘤生长进行抑制[12]。国外研究显示,使用曲妥珠单抗治疗HER-2阳性晚期乳腺癌具有较高的临床有效率,如与传统化疗方式联合应用可以进一步提高临床疗效[13]。而其他大样本量研究也表明,曲妥珠单抗治疗HER-2阳性乳腺癌后,患者血清内CA153、CEA等相关肿瘤标志物水平明显下降,相比传统化疗,其降低效果更为显著[14]。
本研究结果显示,观察组治疗后客观有效率、临床收益率均明显高于对照组,血清CEA、CA153、TPS水平明显低于对照组,提示曲妥珠单抗联合TAX化疗方案治疗HER-2阳性晚期乳腺癌患者效果更好,能够有效降低血清肿瘤标志物水平,显著控制目标病灶发展,值得临床推广应用。
[1] 王研,李俊杰,狄根红,等.曲妥珠单抗治疗141例人表皮生长因子受体2阳性乳腺癌的回顾性分析[J].中华肿瘤杂志,2010,32(11):864 -867
[2] 刘君,杨艳芳,顾林,等.曲妥珠单抗在HER-2阳性乳腺癌患者新辅助治疗中的应用研究进展[J].中国肿瘤临床,2014,21(16):1065-1068
[3] Gatta LB,Incardona P,Cadei M,et al.Simultaneous fluorescence immunophenotyping and Her-2/neu genotyping(FICTION)in breast carcinoma candidates to target therapy[J].Appl Immunohistochemmol Morphol,2012,20(4):413 -420
[4] 马飞,徐兵河,李慧慧,等.曲妥珠单抗治疗拉帕替尼耐药的人表皮生长因子受体2阳性乳腺癌的临床疗效分析[J].中华肿瘤杂志,2013,35(7):521 -524
[5] 李伟,潘燕,李学军,等.HER2阳性乳腺癌治疗药物曲妥珠单抗耐药机制及新一代靶向药物研究进展[J].中国临床药理学杂志,2014,30(1):48 -51
[6] 郭予武,吴志海,钟俊勇,等.曲妥珠单抗联合紫杉醇治疗人表皮生长因子受体2阳性晚期乳腺癌的疗效[J].实用医学杂志,2012,28(15):2648 -2649
[7] 廖宁,张国淳,李学瑞,等.新辅助紫杉醇联合曲妥珠单抗在表皮生长因子受体2阳性可手术乳腺癌患者中的疗效及安全性评价[J].中华肿瘤杂志,2010,32(7):544-547
[8] 谢奕彪,边莉,王涛,等.曲妥珠单抗联合蒽环类及紫杉类方案在乳腺癌新辅助化疗中安全性的观察和分析[J].中国癌症杂志,2012,22(5):396 -398
[9]张聚良,姚青,陈江浩,等.曲妥珠单抗对HER-2阳性早期乳腺癌外周血循环肿瘤细胞的影响[J].现代肿瘤医学,2013,21(2):279-281
[10] 宋金洁,王涛,边莉,等.曲妥珠单抗联合蒽环类药物应用于Her-2阳性乳腺癌的新辅助治疗初步临床研究[J].实用肿瘤学杂志,2013,27(2):97 -100
[11] 曹蔚云.曲妥珠单抗的药理作用与临床应用[J].现代中西医结合杂志,2008,17(21):3387 -3389
[12] 吴梅红,王梅,王薇,等.氟维司群联合曲妥珠单抗治疗芳香化酶抑制剂耐药的晚期Luminal B型(HER-2阳性)乳腺癌的疗效观察[J].临床肿瘤学杂志,2014,17(6):512-515
[13] Kuo SJ,Wang BB,Chang CS,et al.Comparison of immunohistochemical and fluorescence in situ hybridization assessment for HER-2/neu status in Taiwanese breast cancer patients[J].Taiwan J Obstet Gynecol,2007,46(2):146 - 151
[14] 郭继红,徐兵河,马飞,等.曲妥珠单抗联合不同化疗方案治疗人表皮生子因子受体2阳性晚期乳腺癌的疗效和安全性[J].中华肿瘤杂志,2014,12(5):372-376

