IDO抑制剂黄连碱对Aβ与IFN-γ联用诱导的PC12细胞凋亡的影响
朱宇雯何晓婕杨 青,2,3△
(1复旦大学生命科学院生物化学系 上海 200438;2上海生物制造产业协同创新中心 上海 200237;3上海市工业菌株工程技术研究中心 上海 200438)
IDO抑制剂黄连碱对Aβ与IFN-γ联用诱导的PC12细胞凋亡的影响
朱宇雯1何晓婕1杨 青1,2,3△
(1复旦大学生命科学院生物化学系 上海 200438;2上海生物制造产业协同创新中心 上海 200237;3上海市工业菌株工程技术研究中心 上海 200438)
阿尔兹海默症(Alzheimer′s disease,AD),又称原发性老年痴呆症,是一种致死性慢性中枢神经系统退行性疾病,发病机制复杂,主要特征包括细胞外β淀粉样斑块(amyloidβ-protein,Aβ)、细胞内神经元纤维缠结以及神经元功能紊乱或丢失[1-4]。
吲哚胺2,3-双加氧酶(indoleamine 2,3-dioxygenase,IDO)是肝脏外唯一可催化色氨酸循犬尿氨酸途径(kynurenine pathway,KP)代谢的限速酶[5]。95%以上通过饮食摄入的色氨酸进入KP,继而产生具有神经毒性的代谢中间体[6-7]。炎性因子IFN-γ能在转录水平诱导IDO表达[8]。
KP的异常上调会对周围组织产生损害,并参与AD的形成[9-11]。在认知功能严重受损的AD患者血液中,IDO过量表达、犬尿氨酸与色氨酸之比升高、神经毒素含量显著增加[12-13]。Aβ各长度前体中,Aβ(1-42)的神经毒性最强,且能诱导IDO的表达及引起KP的活化[14-17]。由此可见,IDO的过表达和KP途径的过度活化可能和AD的发病机制有密切联系。传统中药黄连解毒汤对AD具有治疗作用[18-19]。本课题组曾发现黄连解毒汤在体外对重组人IDO有较强的抑制效果[20]。黄连碱(coptisine)作为黄连解毒汤的重要成分,是优良的IDO抑制剂,具有治疗AD的潜能[21]。
有关AD和IDO关系的研究多集中在巨噬细胞、小胶质细胞和星形胶质细胞上,而使用神经元探讨IDO与AD关系的研究少有开展。大鼠肾上腺嗜铬细胞瘤细胞(PC12)系神经嵴源性,常用于神经元的研究。本实验通过Aβ与IFN-γ联用的刺激手段,探讨IDO抑制剂黄连碱对PC12细胞IDO高表达及细胞凋亡的影响,以期为IDO与AD关系及其治疗作用提供新线索。
方法
材料和设备 Aβ1-42单体(上海吉尔生化);黄连碱(上海经科宏达生物公司);1-MT、罗丹明123(美国Sigma公司);Hoechst、IFN-γ(鼎国生物技术公司);DMEM培养基、胎牛血清、青-链霉素、0.25%胰蛋白酶-0.02%EDTA(美国Gibco公司)。PCR仪(Bio-rad公司);722分光光度计(上海分析仪器总厂);凝胶成像系统(上海实验设备仪器厂);荧光显微镜(美国Molecular Devices公司);荧光分光光度计(美国Bio Tek Instruments公司);高速离心机、超低温冰箱(美国Thermo Scientific公司)。
细胞培养 采用DMEM高糖培养基(含10% FBS及0.1%青-链霉素)于37℃、5%CO2培养箱中培养。待细胞生长至80%~90%汇合度时,用0.25%胰蛋白酶-0.02%EDTA消化后,1:3传代。Hoechst荧光标记法检测细胞,用于凋亡实验的细胞按2×105/孔的密度接种至6孔板中。
RT-PCR检测 经不同刺激条件或药物处理的PC12细胞用Trizol试剂,按说明书所述操作方法抽提总RNA后,进行紫外分光光度计准确定量,以1μg RNA进行RT反应,GAPDH作为内参,引物序列如表1所示。PCR条件为:96℃预变性3 min,96℃变性1 min,56℃退火1 min,72℃延长1 min,反应循环22次,72℃延伸5 min。采用1%琼脂糖凝胶电泳检测并拍照。
real-time PCR检测 取1μg总RNA进行RT反应,用SYBER Green法对目的基因相对定量,GAPDH作为内参,引物序列如表1所示。PCR条件为:96℃预变性5 min,96℃变性1 min,56℃退火1 min,72℃延长1 min,反应循环35次。数据采用MyIQ软件分析。

表1 引物序列Tab 1 Primer sequences
Hoechst荧光标记法检测细胞凋亡 按实验要求给各组细胞加刺激条件或给药后,4%多聚赖氨酸固定10 min。PBS洗涤后,用Hoechst 33342染料对各组细胞染色。PBS洗涤后,在荧光显微镜紫色滤光器下观察细胞核大小、形态。
线粒体跨膜电位法(MMP)检测细胞凋亡 按实验要求给各组细胞加刺激条件或给药后,将细胞于含1μmol/L罗丹明123的1 m L PBS中孵育45 min,用冰浴的PBS快速洗涤两次,置于冰上,荧光显微镜下观察罗丹明123在细胞内的滞留量。荧光分光光度计检测罗丹明123在细胞内的滞留量,取150μL含0.1%Triton的PBS裂解细胞,将细胞裂解液转移至96孔板,于激发波长485 nm、发射波长530 nm处测荧光值。
统计分析 统计学分析采用SPSS 11.0统计软件,数据以±s表示,重复3次以上。两组数据间差异采用t检验,P<0.05为差异有统计学意义。
结果
Aβ与IFN-γ联用刺激条件的确定 细胞分为3组:空白组、Aβ(-)组和Aβ(+)组,各组刺激条件如表2所示。RT-PCR结果表明,PC12野生型细胞(空白组)内源性IDO的表达很弱,随着IFN-γ浓度的升高,IDO的表达上调(图1),且Aβ能诱导PC12细胞中IDO的表达(图2)。当刺激条件为25 μmol/L的Aβ和1 000 U/m L的IFN-γ联用时,IDO的表达量最高,因此将其作为刺激条件。

表2 实验组刺激条件Tab 2 Stimulus conditions
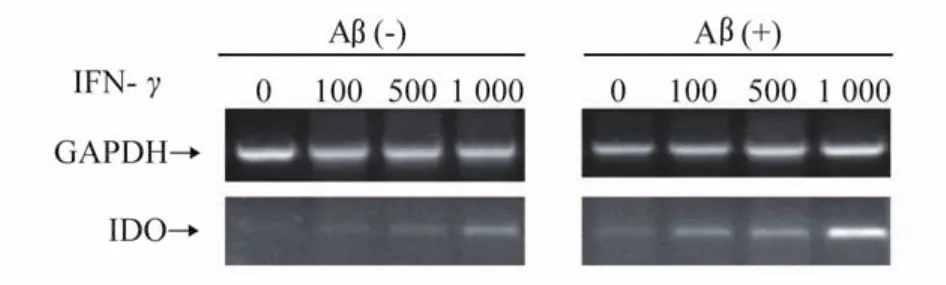
图1 Aβ与IFN-γ对PC12细胞中IDO表达的影响Fig 1 The effects of Aβand IFN-γon the expression levels of IDO mRNA in PC12 cells
黄连碱对Aβ与IFN-γ联用刺激后PC12细胞中IDO m RNA表达的影响 在前期工作中,我们发现黄连碱对IDO的抑制活力比传统的IDO抑制剂1-MT(1-methyl-tryptophan)更优异,其Ki值和IC50值分别为5.8和6.3μmol/L,比1-MT分别低5倍和10倍。而在细胞水平上,黄连碱的IC50值为7.1μmol/L,比1-MT低2倍[21]。将实验细胞分为6组:空白组,IFN-γ组(IFN-γ1 000 U/m L),Aβ组(Aβ1-4225μmol/L),Aβ与IFN-γ联用组(Aβ1-4225 μmol/L+IFN-γ1 000 U/m L),黄连碱组(黄连碱10μmol/L+Aβ1-4225μmol/L+IFN-γ1 000 U/m L),1-MT组(1-MT 20μmol/L+Aβ1-42 25μmol/L+IFN-γ1 000 U/m L)。结果表明(图2),Aβ、IFN-γ或Aβ与IFN-γ联用刺激细胞后,均使细胞中IDO m RNA表达量上调,其中Aβ与IFN-γ联用组对IDO表达的诱导效果最强,其IDO mRNA表达量对比空白组上调了75%。而在加入黄连碱或1-MT后,IDO表达量下调至与空白组相近的水平。

图2 IDO抑制剂黄连碱对Aβ与IFN-γ联用刺激的PC12细胞中IDO的mRNA表达的影响Fig 2 The effects of coptisine on IDO mRNA expression levels in PC12 cells treated by Aβ+IFN-γ
Hoechst荧光标记法检测黄连碱对细胞凋亡的影响 将实验细胞分为3组:空白组、Aβ与IFN-γ联用组和黄连碱组,各组条件与上述实验一致。实验结果表明,Aβ与IFN-γ联用组对比空白组,细胞贴壁不牢,细胞核边缘模糊,染色质凝聚,荧光强度较强;而黄连碱加药组与空白组相似,表现为细胞贴壁较牢,细胞核边缘清晰,荧光强度与空白组基本一致(图3)。这一结果说明,黄连碱可有效抑制Aβ与IFN-γ联用刺激所引起的PC12细胞凋亡。
MMP检测黄连碱对细胞凋亡的影响 将实验细胞分为3组:空白组、Aβ与IFN-γ联用组和黄连碱组,各组条件与上述实验一致。荧光显微镜观察到(图4),Aβ与IFN-γ联用组细胞内滞留的罗丹明123的荧光强度对比空白组明显减弱,而加入黄连碱后,其胞内滞留的罗丹明123的荧光强度显著升高至与空白组基本一致的水平。荧光分光光度计检测的结果(图5)显示,Aβ与IFN-γ联用组的荧光值相对于空白组下调了约40%,而加入黄连碱后,荧光值对比Aβ与IFN-γ联用组升高30%,与空白组相近。以上结果均表明,Aβ与IFN-γ联用诱导了细胞凋亡,线粒体膜完整性被破坏,线粒体通透性转运孔开放,引起膜电位崩溃,使罗丹明123由线粒体中释放,从而导致罗丹明123在胞内的滞留量减少,而黄连碱能抑制这一现象。

图3 Hoechst荧光标记法检测黄连碱对Aβ与IFN-γ联用刺激后PC12细胞凋亡的影响(×200)Fig 3 The effects of coptisine on PC12 cells apoptosis treated with Aβ+IFN-γ detected by Hoechst fluorescence labelling method(×200)

图4 荧光显微镜观察黄连碱对Aβ与IFN-γ联用刺激后PC12细胞中罗丹明123外排功能的影响(×100)Fig 4 The effects of coptisine on Rhoadmine123 efflux in PC12 cells treated with Aβ+IFN-γ under fluorescence microscopy(×100)
讨论目前关于IDO与AD关系的研究基本集中在巨噬细胞、小胶质细胞和星形胶质细胞上,而很少在神经元中研究其相关性。研究发现,AD的发生可能与神经元过早、过度凋亡有关。以往的研究通常采用具有代表性和特异性的原代培养的神经元建立模型,但其技术难度大、实验周期长、培养系统不稳定等缺点使其应用受到了一定限制。我们选择的PC12细胞是来自大鼠嗜铬细胞瘤的细胞株,属神经嵴源性,用神经生长因子(nerve growth factor,NGF)诱导后可长出突起,具有神经元特性,并能克服上述原代培养神经元的缺点[1]。
体内外实验都证实,AD的发生和发展与Aβ在神经细胞中的沉积密切相关。Aβ是一种蛋白质多肽,最初于AD患者大脑皮层及海马的老年斑中被发现,通常认为其与AD的病理改变(如神经元丢失和不良性神经炎)相关[8,22]。给成年和新生鼠的大脑皮层内注射Aβ,发现其可诱导神经元退行性变化,并引起细胞凋亡。小胶质细胞通常被认为是AD神经炎性反应的传递者,研究表明IL-1、IL-6、TNF-α、IFN-γ等促炎因子可介导脑部炎性反应,从而激活小胶质细胞[19]。另有研究发现IFN-γ可以诱导IDO的合成,而IDO参与KP途径,使血液中色氨酸含量下降,可能与神经系统症状有关。Akimoto等[23]发现,在被激活的小胶质细胞中,系统性的大脑炎性反应对IDO的诱导是必要的;Takikawa等[15]进一步证实IFN-γ与Aβ共同作用可以进一步刺激小胶质细胞,且Aβ对诱导IDO表达具有启动效应,在此基础上IFN-γ能诱导IDO高表达。根据上述理论支持,我们采用Aβ1-42和IFN-γ联用刺激PC12细胞,并最终确定两者工作浓度分别为25μmol/L和1 000 U/m L。
本研究发现Aβ与IFN-γ联用能促进PC12细胞凋亡,这提示Aβ与IFN-γ联用可能是以凋亡机制实现神经元的丢失。而预先加入黄连碱后,细胞凋亡情况得到逆转,说明黄连碱能对抗细胞凋亡,对神经元起保护作用。RT-PCR和real-time PCR结果显示,Aβ与IFN-γ联用刺激后PC12细胞中,IDO mRNA水平提高了近75%,而预先加入黄连碱或阳性对照1-MT后,IDO表达量回落至与野生型PC12细胞基本一致的水平。由此提示,黄连碱可能是通过抑制IDO表达,进而降低KP代谢效率,来抑制神经元的凋亡。我们曾发现对AD具有治疗作用的黄连解毒汤在体外对重组人IDO有较强的抑制效果[18-20],而黄连碱作为黄连解毒汤的重要成分,是优良的IDO抑制剂,可能具有治疗AD的潜能[21]。
综上所述,我们推测,在Aβ与IFN-γ联用刺激的PC12细胞中,黄连碱可能通过抑制IDO的表达,降低KP代谢效率,减少KP中具有神经毒性的代谢中间物的生成,从而抑制神经元凋亡,发挥对神经元的保护作用,这为治疗AD以及药物开发提供了新的思路。
阿尔兹海默症; 黄连碱; 吲哚胺2,3-双加氧酶; 细胞凋亡
[1]Cummings BJ,Pike CJ,Shankle R,et al.Beta-amyloid deposition and other measures of neuropathology predict cognitive status in Alzheimer′s disease[J].Neurobiol Aging,1996,17(6):921-933.
[2]Morgan C,Colombres M,Nunez MT,et al.Structure and function of amyloid in Alzheimer′s disease[J].Prog Neurobiol,2004,74(6):323-349.
[3]Yankner BA,Lu T.Amyloid beta-protein toxicity and the pathogenesis of Alzheimer disease[J].J Biol Chem,2009,284(8):4755-4759.
[4]Selkoe DJ.Toward a comprehensive theory for Alzheimer′s disease.Hypothesis:Alzheimer′s disease is caused by the cerebral accumulation and cytotoxicity of amyloid betaprotein[J].Ann N Y Acad Sci,2000,924:17-25.
[5]Takikawa O,Yoshida R,Kido R,et al.Tryptophan degradation in mice initiated by indoleamine 2,3-dioxygenase[J].J Biol Chem,1986,261(8):3648-3653.
[6]Dale WE,Dang Y,Amiridze N,et al.Evidence that kynurenine pathway metabolites mediate hyperbaric oxygen-induced convulsions[J].Toxicol Lett,2000,117(1 -2):37-43.
[7]Guillemin GJ,Brew BJ,Noonan CE,et al.Indoleamine 2,3 dioxygenase and quinolinic acid immunoreactivity in Alzheimer′s disease hippocampus[J].Neuropathol Appl Neurobiol,2005,31(4):395-404.
[8]King NJ,Thomas SR.Molecules in focus:indoleamine 2,3-dioxygenase[J].Int J Biochem Cell Biol,2007,39(12):2167-2172.
[9]Bonda DJ,Mailankot M,Stone JG,et al.Indoleamine 2,3-dioxygenase and 3-hydroxykynurenine modifications are found in the neuropathology of Alzheimer′s disease[J]. Redox Rep,2010,15(4):161-168.
[10]Guillemin GJ,Smythe GA,Veas LA,et al.A beta 1-42 induces production of quinolinic acid by human macrophages and microglia[J].Neuroreport,2003,14 (18):2311-2315.
[11]Shimohama S,Tanino H,Kawakami N,et al.Activation of NADPH oxidase in Alzheimer′s disease brains[J]. Biochem Biophys Res Commun,2000,273(1):5-9.
[12]Baran H,Jellinger K,Deecke L.Kynurenine metabolism in Alzheimer′s disease[J].J Neural Transm,1999,106(2):165-181.
[13]Heyes MP,Saito K,Crowley JS,et al.Quinolinic acid and kynurenine pathway metabolism in inflammatory and noninflammatory neurological disease[J].Brain,1992,115 (Pt 5):1249-1273.
[14]Guillemin GJ,Brew BJ,Noonan CE,et al.Indoleamine 2,3 dioxygenase and quinolinic acid immunoreactivity in Alzheimer′s disease hippocampus[J].Neuropath Appl Neuro,2005,31(4):395-404.
[15]Drouet B,Pincon-Raymond M,Chambaz J,et al. Molecular basis of Alzheimer′s disease[J].Cell Mol Life Sci 2000,57(5):705-715.
[16]Walker DG,Link J,Lue LF,et al.Gene expression changes by amyloid beta peptide-stimulated human postmortem brain microglia identify activation of multiple inflammatory processes[J].J Leukoc Biol,2006,79(3):596-610.
[17]Yamada A,Akimoto H,Kagawa S,et al.Proinflammatory cytokine interferon-gamma increases induction of indoleamine 2,3-dioxygenase in monocytic cells primed with amyloid beta peptide 1-42:implications for the pathogenesis of Alzheimer′s disease[J].J Neurochem,2009,110(3):791-800.
[18]Xu J,Murakami Y,Matsumoto K,et al.Protective effect of Oren-gedoku-to(Huang-Lian-Jie-Du-Tang)against impairment of learning and memory induced by transient cerebral ischemia in mice[J].J Ethnopharmacol,2000,73 (3):405-413.
[19]Zheng Y,Cheng X,Zhou W,et al.Gene expression patterns of hippocampus and cerebral cortex of senescence-accelerated mouse treated with Huang-Lian-Jie-Du decoction[J].Neurosci Lett,2008,439(2):119 -124.
[20]Yu CJ,Zheng MF,Kuang CX,et al.Oren-gedoku-to and its constituents with therapeutic potential in Alzheimer′s disease inhibit indoleamine 2,3-dioxygenase activity in vitro[J].J Alzheimers Dis,2010,22(1):257-266.
[21]Yu D,Tao BB,Yang YY,et al.The IDO inhibitor coptisine ameliorates cognitive impairment in a mouse model of Alzheimer′s disease[J].J Alzheimers Dis,2015,43(1):291-302.
[22]Basu A,Krady JK,Enterline JR,et al.Transforming growth factor beta1 prevents IL-1beta-induced microglial activation,whereas TNF alpha-and IL-6-stimulated activation are not antagonized[J].Glia,2002,40(1):109-120.
[23]Akimoto H,Yamada A,Takikawa O.Up-regulation of the brain indoleamine 2,3-dioxygenase activity in a mouse model of Alzheimer′s disease by systemic endotoxin challenge[J].Int Congr Ser,2007,1304:357-361.
R 592;R 34
B
10.3969/j.issn.1672-8467.2015.05.022
2015-02-10;编辑:段佳)
国家自然科学基金(81373396),高等学校博士学科点专项科研基金(20130071110037),上海市科委生物医药重点课题(12431900204)
△Corresponding author E-mail:yangqing68@fudan.edu.cn

