鞘内注射布美他尼对大鼠急性疼痛行为及钠钾氯联合转运蛋白1表达的影响
朱少飞,唐群新
鞘内注射布美他尼对大鼠急性疼痛行为及钠钾氯联合转运蛋白1表达的影响
朱少飞,唐群新
目的 探讨鞘内注射布美他尼对大鼠术后痛觉过敏形成的作用机制,为临床研究及应用提供理论参考。方法 采用随机数字表法将大鼠分为对照组、注药组、手术组及实验组。采用热辐射法(热痛敏)、von Frey细丝法(机械痛敏)及疼痛累计评分法(疼痛保护反应)观察、记录术前及术后2、4、6 h大鼠的行为学改变,采用免疫组化,荧光显微镜观察各组术后2、4、6 h背根神经节(DRG)的NKCC1表达,并行阳性细胞计数。结果 手术组与实验组术后各时间点的热痛阈均降低(P<0.05);实验组热痛阈明显高于手术组(P<0.05)。注药组大鼠在注药后2 h的机械痛阈升高(P<0.05),手术组大鼠的机械痛阈明显低于实验组(P<0.05)。手术组与实验组术后疼痛累计评分均升高(P<0.05),但手术组明显高于实验组(P<0.05)。手术组及实验组在各时间点阳性细胞计数均明显增多(P<0.01);组间比较,实验组的阳性细胞计数明显少于手术组(P<0.01)。结论 鞘内注射布美他尼能提高切口痛模型大鼠的热痛阈值及机械痛阈值,降低疼痛累计评分,减少切口痛模型大鼠DRG的NKCC1的表达,提示布美他尼对急性疼痛过敏的形成有抑制作用,其抗伤害作用可能与抑制NKCC1活动有关。NKCC1对急性痛觉过敏形成与维持起重要作用。
布美他尼;钠钾氯联合转运蛋白1;急性疼痛;痛阈
0 引言
手术创伤所致的痛觉过敏有别于各种致痛模型,包括典型的辣椒素致痛模型和福尔马林致痛模型,术后疼痛通常伴随有炎性疼痛和神经病理性疼痛[1-2]。既往的研究多集中在神经炎性疼痛模型,对于急性创伤性疼痛形成及持续过程中NKCC1表达及作用如何,目前报道较少[3]。本研究拟通过建立大鼠切口痛模型,通过鞘内注射NKCC1阻滞剂布美他尼(Bumetanide),观察其对大鼠疼痛行为学及NKCC1表达的影响,探讨NKCC1在急性痛觉过敏形成过程的作用及可能机制,为以后临床研究与治疗提供理论依据。
1 材料和方法
1.1 实验动物分组与鞘内注射方式 8~10周龄雄性SD大鼠135只,体重250~300 g,清洁级,由海南医学院实验动物中心提供。采用随机数字表法分为4组,分别为对照组(27只):不做任何处理;注药组(36只):只鞘内注药;手术组(36只):只行右足底切开手术建立切口痛模型;实验组(36只):先鞘内注药,后行右足底切开手术建立切口痛模型。以人工脑脊液配制布美他尼(批号:B3023,Sigma Aldrich公司,美国)药液,浓度为5 μg/μL。方法如下:人工脑脊液配方:1.3 mmol CaCl22 H2O,2.6 mmol KCl,0.9 mmol MgCl2,21.0 mmol NaHCO3,2.5 mmol Na2HPO47 H2O,125.0 mmol NaCl及3.5 mmol葡萄糖,以95%二氧化碳+5%氧气混合气体吹灌至pH值7.2~7.4。鞘内注药方法:大鼠予1.4%七氟醚吸入麻醉后,予背部常规备皮消毒,穿刺点位于L4-5间隙,以26 G针头破皮后,以30 G针头在穿刺点穿刺,大鼠出现甩尾或蹬腿反应提示穿刺成功后注入布美他尼溶液20 μL。
1.2 切口痛模型建立 在吸入1.4%七氟醚麻醉下,常规消毒大鼠右后爪,参照Scalbert等[4]方法,从足底近端0.5 cm处向足趾做1 cm切口,纵向切开皮肤后,以眼科镊子挑起足底肌肉并行纵向切割,但保持肌肉起止及附着完整。纱布按压止血后用0号丝线缝合皮肤两针,术毕用碘伏消毒切口并将大鼠置于温暖、安静、避强光的环境。
1.3 行为学观察 每组随机选取实验大鼠18只,建模前各组大鼠均先行环境适应3~5 d,待大鼠完全适应环境后,分别测定大鼠的热痛阈、机械痛阈和疼痛累计评分的术前基础值(n=6)。
1.4 热痛阈测定 参照Hagreaves等[5]方法,采用热刺痛仪测定各组大鼠的热痛阈值。测定方法:将大鼠置于8 mm×8 mm金属筛网上,四周以透明塑料盒环绕,采用热刺痛仪(PL-200,中国成都泰盟公司)照射右足底伤口周围0.5 mm范围,不直接照射伤口,照射强度设置为30%,同一部位照射间隔5 min,连续照射3次,记录从开始照射到右足抬高的时间,取平均值为热痛阈,单次照射不超过30 s,超过30 s者以30 s记录。记录术前、术后2、4、6 h各组大鼠的热痛阈的测定值。
1.5 机械痛阈测定 参照Keith等[6]方法,采用von Frey细丝刺激法测定各组大鼠的机械痛阈。测量方法:各组大鼠均在术前先将大鼠置于8 mm×8 mm金属筛网上,四周以透明塑料盒环绕,以不同折力(3.61,3.84,4.08,4.17,4.31,4.56,4.74,4.93,5.07,5.18,5.46,5.88 g)的von Frey细丝(Stoelting测痛包58011,美国)刺激大鼠右足底切口周围0.5 mm范围内的皮肤,不直接刺激伤口,出现抬足为阳性反应。测定首先从中等力度的von Frey纤维丝(4.56)开始,当该力度的von Frey纤维刺激不能引起阳性反应时,则给予相邻大一级力度的纤维刺激;如出现阳性反应,则给予相邻小一级力度的刺激,如此连续进行,直至出现第一次阳性和阴性(或阴性和阳性)反应的骑跨,再向下连续测定4次。不同刺激之间相隔30 s,以消除前一刺激的影响。阳性反应记为“×”,阴性反应记为“O”。记录阳性反应组合,50%缩足阈值采用下列公式计算:50%缩足阈值(g)=10[Xf+kδ]。公式中Xf为初次应用的von Frey纤维力度的log值,δ为相邻von Frey纤维力度log值之间差值的平均值,k为阳性反应组合的查表值。记录术前、术后2、4、6 h各组大鼠的机械痛阈的测定值。
1.6 疼痛累计评分 参照Zahn等[7]方法,采用疼痛累计评分法评定大鼠术后保护性行为的改变。观察方法:将大鼠置于8 mm×8 mm网格上,四周以透明塑料盒环绕,以大鼠右后足是否着地负重作为评分标准:后爪完全着地负重评为0分,后爪着地但不负重评为1分,后爪不着地评为2分。每次观察时间为1 min,每隔5 min重复一次,连续观察1 h,将每次分数累加得出为疼痛累计评分。记录术前、术后2、4、6 h各组大鼠的疼痛累计评分。
1.7 NKCC1阳性细胞表达测定 冰面上迅速分取右侧腰段第五背根神经节(DRG),组织放入4%多聚甲醛4 ℃过夜,然后放入20%蔗糖溶液(0.01 mmol/L PBS配制),充分沉底后在冰冻切片机(德国莱卡)连续额状切片,切片厚度15 μm。将切片置于24孔板,每孔4~5张,以0.01 mmol/L的PBS洗片3次,每次5 mim,加入0.5%Triton室温孵育45 min,以0.01 mmol/L的PBS洗片3次,每次5 min,再加入1%小牛血清蛋白室温孵育25 min,以0.01 mmol/L的PBS洗片3次,每次5 min。滴加山羊抗NKCC1血清(SANTA CRUZ,sc-21545),4 ℃孵育过夜,于室温下复温30 min后,以0.01 mmol/L的PBS洗片3次,每次5 min,滴加驴抗山羊荧光二抗(abcam,ab7004),室温孵育2 h,以0.01 mmol/L的PBS洗片3次,每次5 min,最后贴片,以抗淬灭甘油封片。每组取相同节段DRG切片3张,荧光显微镜下(400倍,一个视野)进行NKCC1阳性细胞计数,取平均值。

2 结果
2.1 热痛阈的变化 各组基础热痛阈值差异无统计学意义(P>0.05);与对照组比较,注药组大鼠在注药后2、4 h的热痛阈升高(P<0.05),手术组与实验组术后各时间点的热痛阈均降低(P<0.05);与手术组比较,实验组热痛阈明显高于手术组(P<0.05)。见表1。
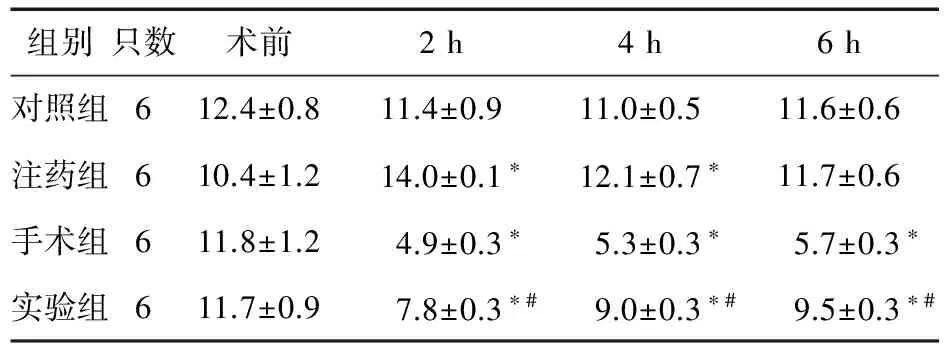
表1 各组大鼠不同时间点热痛阈值比较(s)
注:与对照组比较,*P<0.05;与手术组比较,#P<0.05
2.2 机械痛阈的变化 各组基础机械痛阈比较差异无统计学意义(P>0.05);与对照组比较,注药组大鼠在注药后2 h的机械痛阈升高(P<0.05),手术组与实验组术后各时间点的机械痛阈均降低(P<0.05),其中手术组大鼠的机械痛阈又明显低于实验组(P<0.05),见表2。
2.3 疼痛累计评分 注药组与对照组各观察时间点的疼痛累计评分比较差异无统计学意义(P>0.05);与对照组比较,手术组与实验组术后疼痛累计评分均升高(P<0.05)且手术组明显高于实验组(P<0.05)。见表3。
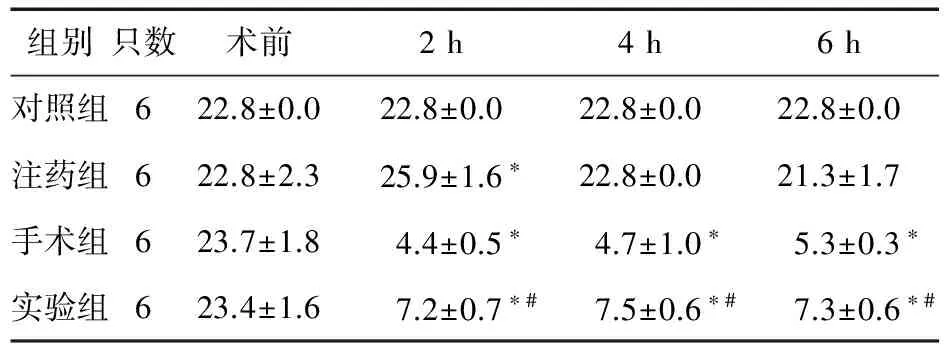
表2 各组大鼠不同时间点机械痛阈值比较(g)
注:与对照组比较,*P<0.05;与手术组比较,#P<0.05

表3 各组大鼠不同时间点疼痛累计评分的比较(中位数,四分位间距)
注:与对照组比较,*P<0.05;与手术组比较,#P<0.05
2.4 NKCC1阳性细胞表达的变化 与对照组比较,注药组在各时间点阳性细胞计数差异无统计学意义(P>0.05),手术组及实验组在各时间点阳性细胞计数均明显增多(P<0.01);组间比较,实验组的阳性细胞计数明显少于手术组(P<0.01),见表4、图1。

表4 各组大鼠不同时间点阳性细胞计数的比较(个)
注:与对照组比较,*P<0.01;与手术组比较,#P<0.01
3 讨论
术后疼痛是一种常见的机制独特而复杂的疼痛模式,其形成机制和疼痛行为与化学炎症疼痛和神经病理性疼痛有所不同。以往在炎性疼痛模型及神经病理疼痛模型中获得的新发现对于指导术后疼痛治疗有一定的局限。因此,本研究采用Brennan创立的切口痛模型,此模型大鼠的疼痛行为与临床术后疼痛行为类似,是最能模拟术后疼痛的动物模型[8-9]。手术操作致组织损伤,手术部位局部缺血,可引起包括前列腺素、激肽、5-羟色胺、氢离子和钾离子、P物质、NO和其他一些细胞因子等疼痛性介质产生、聚集;手术操作还会造成末梢神经的切断、压迫或牵拉引起神经源性疼痛[10-12]。组织损伤和持续的伤害性刺激会导致脊髓背角和其他中枢性痛觉传导通路内的神经细胞发生兴奋性改变,诱发中枢敏化。本实验观察到手术组及实验组大鼠接受手术后均出现痛阈下降和对患足的保护行为改变,提示手术创伤能使中枢敏化产生痛觉过敏。本研究结果显示,鞘内注射布美他尼能提高切口痛模型大鼠的热痛阈与机械痛阈值,改善大鼠的疼痛行为学,降低疼痛累计评分,并且能减少切口痛模型大鼠脊髓背根神经节的NKCC1的表达,提示布美他尼对急性疼痛过敏的形成有抑制作用,其抗伤害作用可能与抑制NKCC1活动有关。

图1 背根神经节神经元细胞NKCC1的表达(免疫荧光,×400)
本实验观察到注药组大鼠与对照组比较有痛阈提高,提示NKCC1参与了痛觉信号的传导。布美他尼是一种高效髓袢利尿剂,主要作用是抑制NKCC蛋白。其药理作用到达峰值时间15~30 min,作用持续时间约为4 h。注药组大鼠热痛阈、机械痛阈分别于4 min和2 h后回复正常水平,与布美他尼作用时间相符,而热痛和机械痛的不同步考虑与传入神经不同有关。而手术组和实验组大鼠术后均出现痛觉过敏,但实验组热痛阈、机械痛阈较手术组高,提示布美他尼能明显减轻大鼠急性创伤后早期疼痛程度。此外,实验组大鼠4 h后痛敏程度仍较手术组大鼠轻,考虑与布美他尼在术后早期抑制或减弱背根反射的形成有关[13],此外,脊髓在术后抑制性氨基酸类神经递质释放增多[14],减弱疼痛信号传入,起保护作用,也不排除其他内源性镇痛系统起作用。目前多数学者认为痛觉过敏形成机制与背根反射有关[15],NKCC1通过调节神经细胞内氯离子浓度,参与背根反射形成[16]。在炎症状态下,各种原因导致的NKCC1表达上调及(或者)活动增强,导致初级传入神经元内氯离子浓度增加,当中间神经元激活释放GABA作用于GABA受体导致氯离子通道开放时,由于胞内氯离子浓度极大于包膜外,导致氯离子大量外流,使PAD被扩大,导致初级传入神经元过度去极化形成逆行性动作电位向外周传导,这一过程称为“背根反射”(Dorsal root reflexes,DRRs)。
NKCC1除表达上调以外,主要通过磷酸化及通过转运蛋白由内质网转运到细胞膜上两条途径活化。磷酸化是NKCC1介导氯离子转运的重要调节机制。NKCC1蛋白位于胞浆的N-端,是磷酸化的作用位点[17],而磷酸化的结果是NKCC1活化更多的氯离子转运到细胞内[18-22]。除磷酸化以外,蛋白的转运也参与NKCC1的调节,这一活化形式缘于对NKCC2的研究[23-24]。本实验时间点设在2、4、6 h,因此,主要观察背根神经节神经元NKCC1阳性表达,基本不涉及磷酸化改变。在背根神经节切片的免疫荧光检测中,手术组切片阳性细胞较对照组明显增多,提示手术操作致组织损伤能促使DRG的NKCC1表达上调。在实验组切片阳性细胞计数也较对照组明显增多,但明显少于手术组,提示应用布美他尼后减少了NKCC1在细胞膜上表达。本实验观察到NKCC1表达减少,考虑由于布美他尼抑制NKCC1活动,减弱了背根反射及痛觉过敏的形成,继而减弱了一些目前还不完全明确的上调NKCC1表达的刺激因素,导致NKCC1表达减少。因而布美他尼的抗伤害作用与减少NKCC1的活动有关,NKCC1表达减少或许为NKCC1活动减少的继发表现。
综上所述,本研究表明鞘内注射布美他尼能提高切口痛模型大鼠的热痛阈与机械痛阈值,改善大鼠的疼痛行为学,降低疼痛累计评分,并且能减少切口痛模型大鼠脊髓背根神经节的NKCC1的表达并产生抗伤害作用。如果在恰当的时机能阻断NKCC1上调或者活化的发生,必将成为痛觉过敏治疗的药理学新靶点。
[1] Prado WA,Pontes RM.Presurgical ketoprofen,but not morphine,dipyrone,diclofenac or tenoxicam,preempts post-incisional mechanical allodynia in rats[J].Braz J Med Biol Res,2002,35(1):111-119.
[2] Dirks J,Mφiniche S,Hilsted KL,et al.Mechanisms of postoperative pain: clinical indications for a contribution of central neuronal sensitization[J].Anesthesiology,2002,97(6):1591-1596.
[3] Julius D,Basbaum AI.Molecular mechanisms of nociception[J].Nature,2001,413(6852):203-210.
[4] Scalbert A,Brennan L,Manach C,et al.The food metabolome:a window over dietary exposure[J].Am J Clin Nutr,2014,99(6):1286-1308.
[5] Hargreaves DC,Crabtree GR.ATP-dependent chromatin remodeling:genetics,genomics and mechanisms[J].Cell Res,2011,21(3):396-420.
[6] Keith JM,Apodaca R,Tichenor M,et al.Aryl piperazinyl ureas as inhibitors of fatty acid amide hydrolase(FAAH) in rat,dog,and primate[J].ACS Medicinal Chemistry Letters,2012,3(10):823-827.
[7] Zahn PK,Umali E,Brennan TJ.Intrathecal non-NMDA excitatory amino acid receptor antagonists inhibit pain behaviors in a rat model of postoperative pain[J].Pain,1998,74(2):213-223.
[8] Blaesse P,Airaksinen MS,Rivera C,et al.Cation-chloride cotransporters and neuronal function[J].Neuron,2009,61(6):820-838.
[9] Grisk O.Posttranslational regulation of the cation-chloride symporter Na+-K+-2Cl-cotransporter-2 in spontaneously hypertensive rat kidneys[J].J Hypertens,2014,32(9):1778-1779.
[10]万春燕.信息化方法实现麻醉,第一类精神药品处方专册登记[J].实用药物与临床,2013,15(11):776-777.
[11]Price TJ,Cervero F,Gold MS,et al.Chloride regulation in the pain pathway[J].Brain Res Rev,2009,60(1):149-170.
[12]Cervero F,Laird JM,García-Nicas E.Secondary hyperalgesia and presynaptic inhibition,an update[J].Eur J Pain,2003,7(4):345-351.
[13]Garcia-Nicas E,Laird JM,Cervero F.Vasodilatation in hyperalgesic rat skin evoked by stimulation of afferent A beta-fibers:further evidence for a role of dorsal root reflexes in allodynia[J].Pain,2001,94(3):283-291.
[14]Qi R,Li W.FK506 inhibits the mice glomerular mesangial cells proliferation by affecting the transforming growth factor-β and Smads signal pathways[J].Renal failure,2014,36(4):589-592.
[15]Laird JM,Garcia-Nicas E,Delpire EJ,et al.Presynaptic inhibition and spinal pain processing in mice:a possible role of the NKCC1 cation-chloride co-transporter in hyperalgesia[J].Neurosci Lett,2004,361,200-203.
[16]沈玉红,张正付,李正奇.我国药物临床试验实施问题及对策[J].实用药物与临床,2013,16(2):173-176.
[17]Morales-Aza BM,Chillingworth NL,Payne JA,et al.Inflammation alters cation chloride co-transporter expression in sensory neurons[J].Neurobiol Dis,2004,17(1):62-69.
[18]Hannaert P,Alvarez-Guerra M,Pirot D,et al.Rat NKCC2/NKCC1 cotransporter selectivity for loop diuretic drugs[J].Naunyn Schmiedebergs Arch Pharmacol,2002,365(3):193-199.
[19]Valencia-de Ita S,Lawand NB,Lin Q,et al.The role of the Na+-K+-2Cl-cotransporter in the development of capsaicin-induced neurogenic inflammation[J].Soc Neurosci,2003,34(3):450-455.
[20]Yu SY,Qi R,Zhao H.Losartan reverses glomerular podocytes injury induced by AngII via stabilizing the expression of GLUT1[J].Mol Biol Rep,2013,40(11):6295-6301.
[21]Granados-Soto V,Arguelles CF,Alvarez-Leefmans FJ.Peripheral and central antinociceptive action of Na+-K+-2Clcotransporter blockers on formalin-induced nociception in rats[J].Pain,2005,114(2):231-238.
[22]贾慧,裴凌.喉罩及其麻醉药物临床应用新进展[J].实用药物与临床,2012,15(4):238-241.
[23]Pitcher MH,Cervero F.Role of the NKCC1 co-transporter in sensitization of spinal nociceptive neurons[J].Pain,2010,151(3):756-762.
[24]Valencia-de Ita S,Lawand NB,Lin Q,et al.Role of the Na+-K+-2Cl-cotransporter in the development of capsaicin-induced neurogenic inflammation[J].J Neurophysiol,2006,95(6):3553-3561.
Effects of intrathecal injection of bumetanide on acute pain behavior and expression of Na+-K+-2Cl-cotransport 1 in rats
ZHU Shao-fei,TANG Qun-xin
(Department of Anesthesiology,Haikou People′s Hospital,Haikou 570208,China)
Objective To explore the mechanism of intrathecal injection of bumetanide in rats which formed action of postoperative hyperalgesia,and provide theoretical reference for clinical research and application.Methods The rats were randomly divided into control group,drug injection group,surgery group and experimental group.The rats behavior changes were observed and recorded by thermal radiation(heat pain sensitivity),von Frey filament method(mechanical pain sensitivity) and cumulative pain score(pain reaction) before and at 2,4,6 h after operation.The rats dorsal root ganglion(DRG) expression of NKCC1 at 2,4,6 h after operation was detected by immunohistochemistry,and positive cells were counted.Results Thermal pain threshold of surgical group and experimental group decreased at all time points(P<0.05),and experimental group was significantly higher than that of surgical group(P<0.05).Mechanical pain threshold of drug injection group increased in 2 h after drug infusion(P<0.05),but the scores of mechanical pain threshold of surgery group was significantly lower than that of experimental group(P<0.05).Postoperative pain scores of surgical group and experimental group increased cumulatively(P<0.05),but surgery group was obviously higher than that of experimental group(P<0.05).Positive cell count of surgical group and experimental group significantly increased at all time points(P<0.01),the positive cell count of experimental group was significant lower than that of surgical group(P<0.01).Conclusion Intrathecal injection of bumetanide can improve the incision pain model rats, thermal pain threshold and mechanical pain threshold,reduce cumulative pain score,and the DRG expression of NKCC1,it could inhibit the allergic to acute pain,and the effect may be related to the inhibition of NKCC1 activities.NKCC1 plays an important role in the formation and maintenance of acute hyperalgesia.
Bumetanide;Na+-K+-2Cl-cotransport 1;Acute pain;Pain threshold
2014-07-30
海南省海口市人民医院麻醉科,海口 570208
10.14053/j.cnki.ppcr.201503007

