重组人β淀粉样蛋白1-42小规模发酵及小量纯化工艺的摸索
申茉函,王全才,杨 丽
重组人β淀粉样蛋白1-42小规模发酵及小量纯化工艺的摸索
申茉函1,王全才2,杨 丽3
目的 研究重组人β淀粉样蛋白1-42(rhAβ1-42)在5 L摇瓶中的高密度发酵实验,以及小量纯化工艺的方法。方法 分别从甲醇浓度、pH、诱导时间等方面对毕赤酵母重组菌株产生rhAβ1-42的发酵过程进行了优化;通过硫酸铵沉淀目的蛋白、透析、脱盐和阴离子交换层析,对rhAβ1-42小量精确的纯化方法进行了研究。结果 确定rhAβ1-42在毕赤酵母中分泌表达的最佳条件为:在pH 6.0的条件下,以0.5%甲醇诱导72 h,经过硫酸铵沉淀目的蛋白、透析、脱盐和阴离子交换层析,rhAβ1-42纯度可达94%以上。结论 确定了rhAβ1-42在毕赤酵母中分泌表达的最佳条件,建立了小量纯化rhAβ1-42的新方法。
β淀粉样蛋白;发酵;小量纯化
0 引言
阿尔茨海默病(Alzheimer′s disease,AD)的病理特征以脑神经细胞外出现β-淀粉样蛋白(Aβ)聚集形成的神经斑或称老年斑、脑神经细胞内tau蛋白异常聚集形成的神经纤维缠结(NFT)、脑皮层神经细胞减少以及累及皮层动脉和小动脉的血管淀粉样变性为主[1]。对β淀粉样蛋白1-42(Aβ1-42)进行细胞学与动物实验学的研究需要一定的蛋白作为物质基础。鉴于此,本研究在常规方法的基础上,进一步探讨了甲醇诱导浓度、pH值和诱导时间对毕赤酵母重组工程菌表达rhAβ1-42的影响,对该表达系统进行了小量纯化方法的探索,提高了重组工程菌中rhAβ1-42的表达量。通过纯化获得高纯度的rhAβ1-42,更好地满足了研究老年性痴呆疾病细胞学和动物实验学的需要,从而为临床治疗提供指导。
1 材料与方法
1.1 主要材料及仪器 毕赤酵母重组菌株(X33,pPICZα/hAβ1-42)构建并保存;蛋白分子量Marker购自Takara Biotech公司(日本);兔抗人Aβ1-42抗体购自武汉博士德公司;辣根过氧化物酶标记的羊抗兔抗体购自武汉博士德公司;其余试剂均为分析纯。毕赤酵母生长培养基包括YPD(2%胰蛋白胨、1%酵母提取物、2%葡萄糖)和BMGY(2%胰蛋白胨、1%酵母提取物、100 mmol/L pH 6.0磷酸盐、1.34%YNB、1%甘油)。BMMY(2%胰蛋白胨、1%酵母提取物、100 mmol/L pH 6.0磷酸盐、1.34%YNB、0.5%甲醇)用于诱导蛋白表达。
1.2 方法
1.2.1 诱导时间对rhAβ1-42表达的影响 将重组菌株接种于生长培养基中,30 ℃培养24 h。离心,收集菌体接入诱导培养基。诱导培养168 h,每24 h取样一次。分离上清进行SDS-PAGE电泳,并测定菌体湿重。
1.2.2 pH对rhAβ1-42表达的影响 将生长培养基的菌体等量接入pH分别为2.2、2.8、3.4、4.0、4.6、5.2、6.0、7.0的诱导培养基内进行培养。诱导培养72 h后收获发酵液,离心取上清用于rhAβ1-42的Tricine-SDS-PAGE蛋白分析。
1.2.3 重组毕赤酵母在5 L摇瓶中的高密度发酵实验 将冻存的工程菌在YPD琼脂板上(含zeocin 100 μg/mL)30 ℃划线培养2~3 d。挑取单克隆菌落接种于10 mL YPD液体培养基中,30 ℃摇床振荡培养24 h。将上述菌液接种于2L YPD液体培养基中,30 ℃摇床振荡培养24 h,OD600≈10。收集发酵液,等体积BMMY重悬细胞沉淀,甲醇诱导表达,在表达量达到高峰时回收上清用于纯化。
1.2.4 rhAβ1-42的小量纯化 甲醇诱导培养72 h后,离心获得发酵液上清,用H2SO4调节其pH值为5.3,取50 mL发酵上清液于4 ℃加入(NH4)2SO4进行分级沉淀,使(NH4)2SO4的饱和度分别为20%、30%、40%、50%、60%、70%,加入(NH4)2SO4时一定要缓慢,并且边加边搅拌混匀,至(NH4)2SO4完全溶解后继续搅拌混匀,4 ℃沉淀2 h左右。取离心后的沉淀,将沉淀用100 μL包被液溶解,进行ELISA分析,结果发现,40%饱和度的(NH4)2SO4沉淀中含有rhAβ1-42。
分析确定rhAβ1-42的(NH4)2SO4沉淀最佳饱和度为40%,将剩余的发酵液上清用H2SO4调节其pH值为5.3,并加入(NH4)2SO4使其饱和度为40%,重复上述40%饱和度(NH4)2SO4的纯化步骤,离心收集沉淀并用10 mL PBS缓冲液(pH 7.0)溶解。
2 结果
2.1 诱导时间对rhAβ1-42表达的影响 采用含0.5%甲醇的诱导培养基(pH 6.0),225 r/min,30 ℃条件下对重组酵母进行诱导表达,不同诱导时间结果见图1。甲醇诱导24 h,发酵液上清就可检测到rhAβ1-42,随着诱导时间增加,重组蛋白的产量具有累积效应,表达72 h达到高峰。
2.2 pH对rhAβ1-42表达的影响 分别测定培养基pH为2.2、2.8、3.4、4.0、4.6、5.2、6.0、7.0时,rhAβ1-42产量的变化。在0.5%的甲醇诱导下,培养基pH为6.0时最有利于rhAβ1-42的分泌表达。见图2。
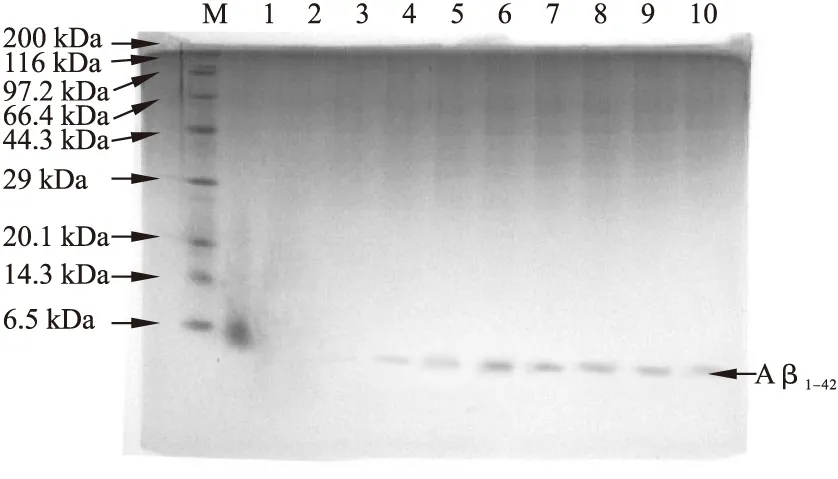
图1 Tricine-SDS-PAGE 筛选Aβ1-42表达的最佳时间图谱
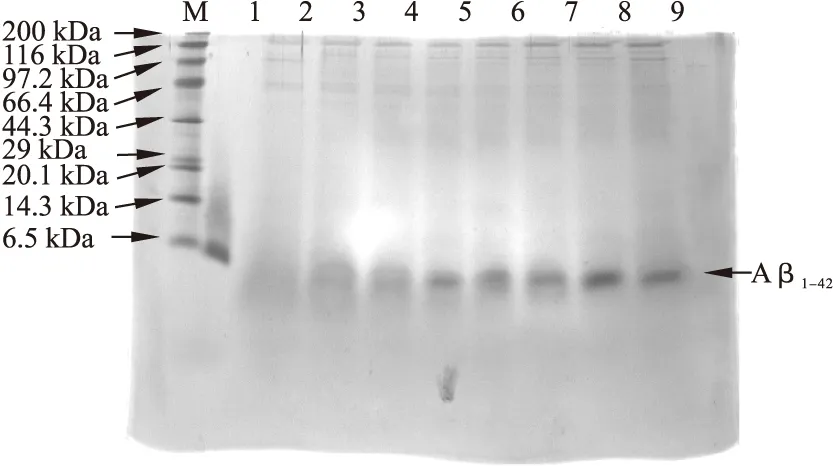
图2 Tricine-SDS-PAGE确定毕赤酵母表达Aβ1-42的最佳pH值
2.3 重组毕赤酵母在5 L摇瓶中的高密度发酵实验 将重组工程菌在上述实验确定的最佳发酵条件(pH 6.0,甲醇浓度0.5%)下诱导表达,72 h收获发酵液上清,rhAβ1-42产量可达150 mg/L。
2.4 rhAβ1-42的纯化 rhAβ1-42的2 L摇瓶水平表达结束后立即离心分离,取上清经饱和度20%~70%的(NH4)2SO4沉淀,通过ELISA检测,结果显示,(NH4)2SO4分级沉淀中40%饱和度的(NH4)2SO4沉淀中rhAβ1-42的含量最高(图3)。粗品目的蛋白用Phamacia AKTA explorer 100 中压液相层析系统纯化。通过MONO Q阴离子交换层析,获得rhAβ1-42的单一洗脱峰。

图3 ELISA检测确定(NH4)2SO4分级沉淀Aβ1-42最佳浓度
2.5 Western blotting分析纯化rhAβ1-42不同纯化阶段的蛋白经16%Tricine-SDS-PAGE分析,可见纯化后的蛋白呈单一条带,杂蛋白含量较少。rhAβ1-42产量约为350 mg/L,纯度可达94%。Western blotting鉴定结果见图4。
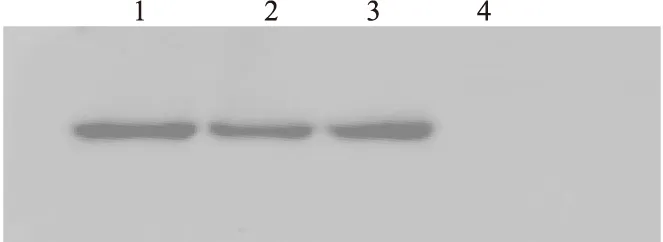
图4 小量纯化Aβ1-42 Western blotting图
3 讨论
AD由德国学者Alosi Alzheimer于1907年首次提出,Aβ蛋白是AD患者脑内神经炎斑的主要成分[2]。1984年,Glenner等[3]和Wong等[4]发现神经炎斑的主要成分是一种由39~43个氨基酸组成,具有β折叠构型的蛋白,称之为β-淀粉样蛋白。 Aβ基因疫苗是利用合成Aβ-DNA制成。其作用机制是:该疫苗注入动物细胞后,它所含有的DNA指导细胞合成Aβ,机体免疫反应促使产生针对Aβ的抗体,抗体进入脑内,清除脑内Aβ,起到治疗作用。与传统疫苗相比,基因疫苗生成抗体需更长时间,疗效相对缓和,但疗效更为持久。Kima等[5]以腺病毒作为载体,携带编码单核细胞集落刺激因子和Aβ的基因疫苗。集落刺激因子具有免疫调制特性,能够高效扩大机体对抗原的免疫反应[6]。该疫苗经过鼻黏膜给药免疫AD小鼠,诱导产生以IgG为主的抗体,并且Aβ负荷明显小于对照组。此外,Zhang等[7]利用重组腺病毒载体(AAV)在体内表达霍乱毒素B亚基(CB)和融合蛋白,霍乱毒素B亚基无毒而且是非Thl淋巴细胞诱导佐荆,能够产生强有力的体液免疫而不会诱发细胞免疫。试验结果,AAV-CB-Aβ1-42疫苗1个月后即产生高滴度IgG抗Aβ1-42抗体,2个月后达到最高浓度,持续至少达12个月。疫苗接种2个月后,试验组抗体滴度是重组腺病毒组Aβ1-42抗体滴度的10倍。
鉴于Aβ1-42蛋白在AD发病中和免疫疗法中的重要作用,需要进一步研究Aβ1-42蛋白导致AD的详细发病机制及其在免疫疗法中的作用,要进行上述发病机制的研究和免疫疗法的探索,就需要制备大量的Aβ1-42蛋白,但是现有的获取方式主要是通过人工合成来制备蛋白,成本较高,而且生物学活性低。
毕赤酵母作为一种表达体系具有如下优点:①含有特有的强有力的AOX1启动子,用甲醇可以严格地控制外源基因的表达,当细胞以葡萄糖、甘油、乙醇为碳源生长时,不能检测到AOX的活性,而在甲醇培养的细胞中,可占细胞总蛋白的30%以上,AOX1启动子的强诱导性使其下游的外源基因易于调控,并具有很高的表达率;②表达水平高,既可在胞内表达,又可以分泌表达。已报道的毕赤酵母有最高表达量的蛋白为巴西三叶胶腈水解酶,表达量高达22 g/L[8]。绝大多数外源基因比在细菌、酿酒酵母、动物细胞中表达水平高;③发酵工艺成熟,易于放大。已经有大规模工业化高密度生产的发酵工艺,且细胞干重可达130 g/L以上,表达重组蛋白时,已经成功放大到10 000 L;④培养基成分简单,杂蛋白本底低,产物易于分离纯化。已经发现多个高效的毕赤酵母分泌表达信号肽,很多外源蛋白可在毕赤酵母中高效分泌表达,而且毕赤酵母发酵所用的培养基十分简单廉价,一般为甘油或葡萄糖,其余为无机盐,培养基中不含蛋白,加之毕赤酵母本身分泌的蛋白水平低,有利于下游产品的分离纯化;⑤外源蛋白基因遗传稳定。一般外源蛋白基因整合到毕赤酵母染色体上,随染色体的复制而复制,不存在质粒丢失问题;⑤作为真核表达系统,毕赤酵母具有真核生物的亚细胞结构,具有糖基化、脂肪酸化、蛋白磷酸化等翻译后修饰加工功能;⑦无致病性,不产生内毒素等有害物质。因此,毕赤酵母表达体系非常适合于大规模发酵生产重组蛋白[9-10]。
Subrammanian等[11]在大肠杆菌中表达合成编码的Aβ1-42基因,并进行生产抗原及纯化工艺。在合成的基因结构上加了6个寡聚核苷酸,用重叠PCR的方法、采用T7启动子进行表达重组蛋白。该重组蛋白通过单向Ni2+亲和层析纯化,用ELISA方法证明重组蛋白具有免疫活性。
胡海涛等[12]研究Aβ蛋白与乙型肝炎核心抗原的融合基因(HBcAg)原核表达,检测融合蛋白的免疫反应性及免疫原性。将重组质粒pBV220/Aβ-HBcAg转化大肠杆菌DH5α,调控表达,超声破碎细菌,通过SDS-PAGE,考马斯亮蓝染色和ELISA等方法,观察Aβ-HBcAg的表达及融合蛋白的免疫反应性。用该融合蛋白免疫Balb/c小鼠法检测血清中抗Aβ抗体和抗HBc抗体滴度。结果提示,融合基因Aβ-HBcAg可在大肠杆菌DH5α中表达,表达蛋白有一定的免疫原性和免疫反应性,但表达量低,免疫反应性和免疫原性较弱。
张革等[13]在大肠杆菌中表达Aβ1-42蛋白抗原,表达量达到800 mg/L,菌液纯度大于95%。方法是通过化学合成Aβ1-42基因两个互补片段,通过PCR构建人Aβ1-42基因,将其克隆至pGEX-T表达载体中,并进行原核表达及亲和纯化GST-Aβ1-42融合蛋白。结果提示,Aβ1-42在体内能够作为自身抗原,诱导产生Aβ1-42自身抗体。
Youm等[14]利用转基因植物-马铃薯编码5个串联重复的Aβ1-42蛋白,利用ER信号肽,转基因小鼠Tg2576用该马铃薯作为药物饲养,数月后,检测表明小鼠脑内的Aβ1-42减少。Aβ1-42重复序列蛋白在转基因马铃薯中得到表达并形成有免疫功能的Aβ1-42。因此,可利用这些转基因马铃薯预防及治疗AD,其具有一定的研究潜力。
尽管毕赤酵母在表达外源蛋白上存在诸多优势,但外源基因在表达过程中受自身特性和培养条件的影响而不稳定[15]。本研究以甘油作为毕赤酵母扩增阶段的碳源,以甲醇作为诱导表达阶段的唯一碳源,YNB作为氮源,在30 ℃下培养重组酵母工程菌。分别研究pH值、甲醇含量、诱导时间对rhAβ1-42产量的影响,确定了重组工程菌分泌表达rhAβ1-42的最佳条件。对rhAβ1-42进行小量纯化,因为Aβ1-42的等电点为5.31,所以本实验首先在Aβ1-42的等电点附近用硫酸铵将目的蛋白沉淀,ELISA分析结果显示,40%的(NH4)2SO4沉淀中rhAβ1-42的含量最高。用缓冲液溶解沉淀后进行透析脱盐,脱盐处理后的溶液用AKTA explorer 100中压液相层析系统在pH 10.0条件下进行阴离子交换层析纯化,收集洗脱峰。Tricine-SDS-PAGE和Western blotting结果显示,存在相对分子量约为4 000 D的Aβ1-42蛋白,并具有生物学活性。该方法证实重组表达的hAβ1-42与天然hAβ1-42具有相同的免疫原性;该纯化方法适合于小规模纯化,产量为350 mg/L,纯度可达94%。通过纯化获得高纯度的rhAβ1-42,更好地满足了研究老年性痴呆疾病细胞学和动物实验学的需要。
[1] Marksteiner J,Hinterhuber H,Humpel C.Cerebrospinal fluid biomarkers for diagnosis of Alzheimer′s disease: beta-amyloid(1-42),tau,phospho-tau-181 and total protein[J].Drugs Today(Barc),2007,43(6):423-431.
[2] Gotz J,Chen F,Van Dorpe J,et al.Formation of neurofibrillary tangles in P301l tau transgenic mice induced by Abeta 42 fibrils[J].Science,2001,293(5534):1491-1495.
[3] Glenner GG,Wong CW.Alzheimer′s disease: initial report of the purification and characterization of a novel cerebrovascular amyloid protein[J].Biochem Biophys Res Commun,1984,120(3):885-890.
[4] Wong CW,Quaranta V,Glenner GG.Neuritic plaques and cerebrovascular amyloid in Alzheimer disease are antigenically related[J].Proc Natl Acad Sci USA,1985,82(24):8729-8732.
[5] Kima HD,Kong FK,Cao Y,et al.Immunization of Alzheimer model mice with adenovirus vectors encoding amyloid 13-protein and GM-CSF reduces amyloid load in the brain[J].Neurosci Lett,2004,370(2-3):218-221.
[6] Yei S,Bartholomew RM,Pezzoli P,et al.Novel membrane-bound GM CSF vaccines for the treatment of cancer: generation and evaluation of mbGM-CSF mouse BI6F10 melanoma cell vaccine[J].Gene Ther,2002,9(19):1302-1311.
[7] Zhang J,Wu X,Qin C,et al.A novel recombinant adenoassociated virus vaccine reduces behavioral impairment and β-amyloid plaques in a mouse model of Alzheimer′s disease[J].Neurobiol Dis,2003,14(3):365-368.
[8] Hasslacher M,Schall M,Hayn M,et al.High-level intracellular expression of hydroxynitrile lyase from the tropical rubber tree Hevea brasiliensis in microbial hosts[J].Protein Expr Purif,1997,11:61-71.
[9] Cereghino JL,Cregg JM.Heterologous protein expression in the methyl-otrophic yeast Pichia pastoris[J].FEMS Microbiol Rev,2000,24(1):45-66.
[10]Macauley-Patrick S,Fazenda ML,McNeil B,et al.Heterologous protein production using the Pichia pastoris expression system[J].Yeast,2005,22:249-70.
[11]Subramanian S,Shree AN.Expression,purification and characterization of asynthetic gene encoding human amyloid beta(Abetal-42) in Escherichia coli[J].Biochem Biophys,2007,44(2):71-75.
[12]胡海涛,冯改丰,董炜疆,等.融合基因Aβ-HBcAg的原核表达及表达蛋白的免疫反应性和免疫原性分析[J].西安交通大学学报(医学版),2004,25(3):220-222.
[13]张革,王烈峰,汪华侨,等.人Aβ42重组抗原的融合表达及Aβ抗体的检测[J].第一军医大学学报,2005,25(2):160-164.
[14]Youm JW,Kim H,Han JH,et al.Transgenic potato expressing Abeta reduce Abeta burden in Alzheimer′s disease mouse model [J].FEBS Lett,2005,579(30):6737-6744.
[15]张丞斌,傅正伟.影响外源蛋白在巴斯德毕赤酵母中表达和分泌的研究进展[J].现代生物医学进展,2008,8(7):1382-1384.
Small scale fermentation and a small purification technology of recombinant human β-amyloid peptide 1-42
SHEN Mo-han1,WANG Quan-cai2,YANG Li3
(1.Shengjing Hospital of China Medical University,Shenyang 110004,China;2.The People′s Hospital of Liaoning Province,Shenyang 110016,China;3.Key Laboratory of Zoonosis Research of Ministry of Education,Jilin University,Changchun 130021,China)
Objective To study the high-cell-density fermentation experiment of human recombinant β-amyloid protein 1-42(rhAβ1-42) in 5 L shake flask and the method of small scale purification.Methods Fermentation parameters of rhAβ1-42was further optimized mainly on concentration of methanol induction,pH value,and induced time.Secreted supernatant of rhAβ1-42was purified with ammonium sulphate sediment,dialysis desalination and anion-exchange chromatography.Results The optimal condition of rhAβ1-42expressed in Pichia pastoris was: under the condition of pH=6,induced by 0.5% methanol for 72 h,precipitation of target protein by ammonium sulfate,dialysis desalting,anion exchange chromatography,rhAβ1-42purity could reach more than 94%.Conclusion A stable fermentation and new technology of the small scale purification is successfully set up.
β-amyloid protein;Fermentation;Small scale purification
2014-09-16
1.中国医科大学附属盛京医院,沈阳 110004;2.辽宁省人民医院,沈阳 110016;3.吉林大学人兽共患研究教育部重点实验室,长春 130021
国家高技术研究发展计划(863计划)(2004AA205020)
10.14053/j.cnki.ppcr.201503003

