细叶百合冷藏过程中鳞茎保护酶活性与休眠解除的关系
刘芳,李丹丹,廉华,吴瑕,陈业雯,李雨琦,谢守峰,陈学武
(黑龙江八一农垦大学农学院,黑龙江 大庆163319)
细叶百合冷藏过程中鳞茎保护酶活性与休眠解除的关系
刘芳*,李丹丹,廉华,吴瑕,陈业雯,李雨琦,谢守峰,陈学武
(黑龙江八一农垦大学农学院,黑龙江 大庆163319)
以细叶百合为试材,通过冷藏(5℃)解除鳞茎休眠,研究了细叶百合鳞茎解除休眠过程中鳞茎保护酶活性与糖代谢的变化规律。结果表明,鳞片、顶芽及鳞茎盘SOD活性在冷藏0~24 d内下降,除顶芽外,鳞茎各部位POD活性在0~24 d内呈下降趋势,外鳞片、顶芽及鳞茎盘中CAT活性在冷藏0~12 d内下降,冷藏中后期,SOD、CAT、ASP 活性升高,鳞片中POD的活性下降,顶芽及鳞茎盘POD、PPO在冷藏中期上升。各种代谢相关酶在不同器官中的作用并不完全相同。在低温处理36~60 d内,ASP、CAT活性快速上升,后期趋于稳定。SOD活性最低点出现在冷藏36~60 d,鳞茎各部位淀粉与CAT、PPO、ASP均表现为负相关性,SOD、POD、PAL与鳞片中淀粉表现为正相关性。36 d是鳞茎解除休眠的起点,60 d时鳞茎基本解除休眠。
细叶百合;鳞茎;休眠;冷藏;保护酶
细叶百合属草本花卉,在园林和草地建设中应用很广,观赏性强,又兼有药用和食用的价值。秋季鳞茎收获后即进入休眠状态。休眠期间,鳞茎外部形态变化不明显,但其内部仍发生着非常复杂的生理生化反应。鳞茎休眠解除过程中淀粉与可溶性糖之间的转化是提供能源的重要代谢途径[1-2]。超氧化物歧化酶(SOD)、过氧化物酶(POD)和过氧化氢酶(CAT)等抗氧化酶类作为保护酶在百合鳞茎休眠解除过程中也具有重要的作用。乔永旭等[3]在研究4℃低温处理过程中东方百合鳞茎的抗氧化系统酶的动态变化中指出,SOD呈现先下降后上升的趋势。CAT的活性在低温处理前期下降,随后又上升,45 d后又迅速下降,与过氧化氢的动态变化趋势一致。抗坏血酸过氧化物酶(ascorbate peroxidase,ASP)和POD的活性在低温解除休眠过程中都呈先上升后下降的趋势。孙红梅等[4]提出低温解除休眠的鳞茎内酚类物质的含量增加可能对兰州百合鳞茎的萌发起促进作用。而苯丙氨酸解氨酶(phenylalanine ammonia lyase,PAL)、多酚氧化酶(polyphenol oxidase,PPO)是形成酚类物质的关键酶,其研究表明,随着贮藏期的延长,鳞茎盘的 PAL 活性下降,顶芽与鳞片的 PAL 活性有增加趋势。有研究表明,亚洲百合低温破眠期内PAL活性下降,PPO活性增加[5]。可见,低温处理引起的活性氧积累及抗氧化酶类的代谢变化可能是百合鳞茎低温破眠的诱因。
糖类化合物含量及鳞茎保护酶的代谢规律因百合种类的不同而存在差异,国内外对百合鳞茎在低温处理过程中鳞茎内抗氧化酶类活性及活性氧含量变化的研究也比较少。3~5℃处理对大多数百合解除休眠均有较好的效果[6],本试验前期已从细叶百合鳞茎外部形态和生物量的变化及鳞茎内部细胞组织超微结构方面进行了系统的研究,已经明确鳞茎休眠解除的时间进程,鳞茎冷藏36~72 d内,细胞生物膜系统逐渐活跃,胞内及胞间联系逐渐建立,鳞茎冷藏84 d时已经出芽,休眠彻底打破[7]。因此,本研究试图从5℃低温诱导细叶百合休眠解除过程中鳞茎保护酶活性的变化规律入手,利用相关分析对重要糖类化合物和鳞茎保护酶之间的相关性进行系统的研究。旨在阐明低温处理所诱导的百合鳞茎的适应性与抗氧化酶类之间的关系,以及抗氧化酶对鳞茎休眠解除的作用。为全面了解百合鳞茎休眠的生理生化调控机制提供参考信息。
1 材料与方法
供试材料为从凌源引种的野生种细叶百合,鳞茎周径4~6 cm。
于2012年10月中旬采收细叶百合休眠鳞茎于5℃冰箱中冷藏处理,冷藏基质为蒸汽消毒的潮湿珍珠岩。低温处理阶段,每12 d取样1次,每次随机取10个鳞茎,分成外层、内层鳞片、顶芽、鳞茎盘四部分,测定其生理指标。每处理3次重复。
淀粉和可溶性糖含量的测定,采用蒽酮比色法[8]。SOD活性测定参照高俊凤[9]的方法。 CAT活性测定,采用紫外分光光度法[10]。ASP活性测定参照沈文飚等[11]的方法。POD活性测定,采用愈创木酚法[5]。PPO活性测定,采用儿茶酚法[5]。PAL活性测定,采用巯基乙醇法[5]。试验数据采用Excel软件进行计算和处理,利用SPSS软件进行数据分析。
2 结果与分析
2.1百合鳞茎冷藏过程中糖类化合物含量的变化
糖类化合物的代谢在百合鳞茎低温贮藏过程中起着重要的作用。由表1可知,内外层鳞片淀粉含量远远高于鳞茎盘和顶芽,冷藏过程中,内外层鳞片淀粉含量随冷藏时间的延长呈逐渐下降的趋势。0~36 d内下降较快。顶芽在整个贮藏过程中淀粉含量先下降再上升再下降,在冷藏48 d时含量最高,84 d时淀粉含量最低。鳞茎盘淀粉含量的变化呈先上升后下降的抛物线变化趋势,在冷藏24 d时淀粉含量升至峰值,此后淀粉含量逐渐下降,84 d时含量最低。总体来看,在冷藏期内百合鳞茎各部位的可溶性糖含量均呈上升趋势。外层鳞片可溶性糖含量48 d后有所下降,在冷藏84 d时又出现回升现象。内层鳞片在冷藏60 d时可溶性糖含量达到峰值。鳞茎冷藏48~60 d是鳞片可溶性糖发生变化的转折点。鳞茎盘和顶芽中淀粉在冷藏各时期差异不显著,鳞片中淀粉及鳞茎各部位可溶性糖含量在冷藏0,36,60,84 d均有显著差异。
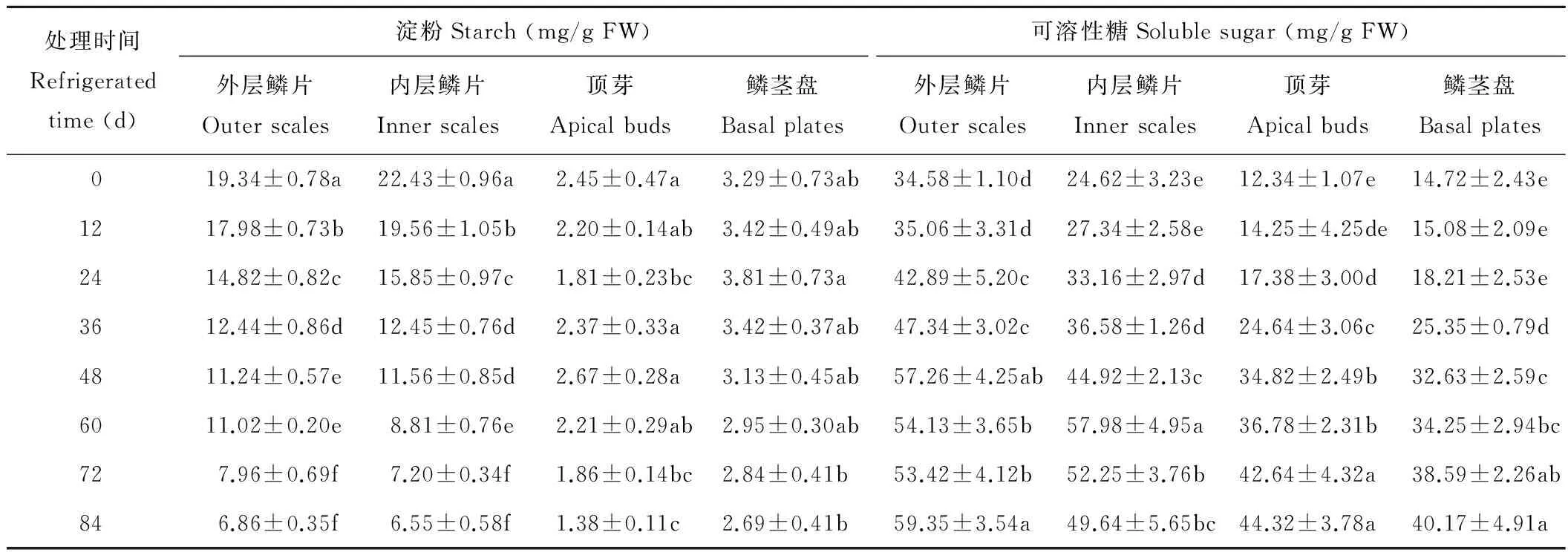
表1 百合鳞茎冷藏过程中糖含量的变化Table 1 The changes of sugar content of L.pumilum bulbs during cold storage
注:同列不同小写字母代表0.05 水平上差异显著,下同。
Note:Different lowercase letters within the same column for the same organ mean significant differences at 0.05 level,the same below.
2.2细叶百合鳞茎冷藏过程中保护酶活性的变化
从表2可以看出,内外鳞片中的SOD活性在冷藏0 d时高于顶芽和鳞茎盘。整体来看,鳞茎各部位SOD活性出现了先降低后上升的趋势。冷藏初期SOD下降幅度比较大,鳞片在冷藏48 d降至最低值之后逐渐回升。顶芽SOD活性在各个时期均比鳞茎盘高,36 d之后逐渐回升。
鳞片内CAT活性较低,0~60 d内CAT活性变化不大,60 d后缓慢升高。顶芽及鳞茎盘在冷藏初期略有下降,冷藏12 d后逐渐升高,在24~72 d内变化幅度最大,整个冷藏期间,顶芽各个取样时期CAT活性都比鳞茎盘高,顶芽及鳞茎盘CAT活性都明显高于内外层鳞片。鳞茎各部位CAT的活性在冷藏后期保持平稳。鳞茎中SOD及CAT活性在贮藏前期、中期和后期有显著差异。
内层鳞片在冷藏过程中活性逐渐降低。外层鳞片冷藏至48 d后迅速下降,POD活性在冷藏72 d时最低,84 d时活性升高。顶芽在冷藏初期,POD 活性整体呈上升趋势,鳞茎盘POD 活性随贮藏时间的延长呈先降低后升高的趋势,冷藏处理初期下降,冷藏24 d时活性最低。低温处理过程中,顶芽和鳞茎盘POD 活性远远高于内外层鳞片。60~84 d酶活性基本上趋于稳定状态。鳞茎中POD活性变化在各时期差异不明显。
鳞茎不同部位ASP的活性在低温冷藏过程中整体上表现为先上升后下降的趋势,低温处理初期无明显变化,内外层鳞片在24~60 d内活性迅速增加,外层鳞片48 d达最大值,之后缓慢降低,内层鳞片60 d达到最大值,60 d后趋于平缓。顶芽及鳞茎盘12 d内无明显变化,之后ASP的活性逐渐升高,36 d顶芽活性最高,48 d下降幅度较大,48~84 d又逐渐上升,每个时期的变化幅度不大。鳞茎盘在冷藏12~84 d缓慢上升,60 d达到峰值。冷藏0和36 d的鳞茎ASP活性差异比较显著。
从不同贮藏时间看,百合鳞茎冷藏过程中,内外层鳞片和鳞茎盘PPO的活性表现为增强的趋势。内外鳞片PPO的活性在24~84 d内变化幅度较大,0,36,60 d时PPO活性差异都很显著,48 d外层鳞片活性达到高点后基本保持平稳,内层鳞片在24~84 d内持续增加。鳞茎盘和顶芽PPO的活性在冷藏初期维持较低水平,冷藏中期有下降趋势,36 d后逐渐上升,鳞茎盘在72 d活性最高,顶芽在整个冷藏期PPO的活性变化范围不大。
鳞茎冷藏期PAL活性也发生了一定的变化。总体来看,内外层鳞片、顶芽和鳞茎盘的 PAL 活性随贮藏时间的延长而降低,鳞茎盘的 PAL 活性明显高于鳞茎其他部位,鳞茎盘24 d内PAL活性迅速下降至最低值,之后逐渐回升,0,36,60 d时PAL活性差异显著,60~84 d活性变化不大,趋于稳定。内外层鳞片、顶芽的活性水平差异不大。顶芽与内部鳞片PAL 活性在贮藏初期的36 d内变化幅度最大,36 d降至最低点,贮藏中后期又呈逐渐上升趋势,贮藏末期略有下降。外层鳞片除在贮藏12 d时有小幅度增加外,整个冷藏过程中逐渐下降。
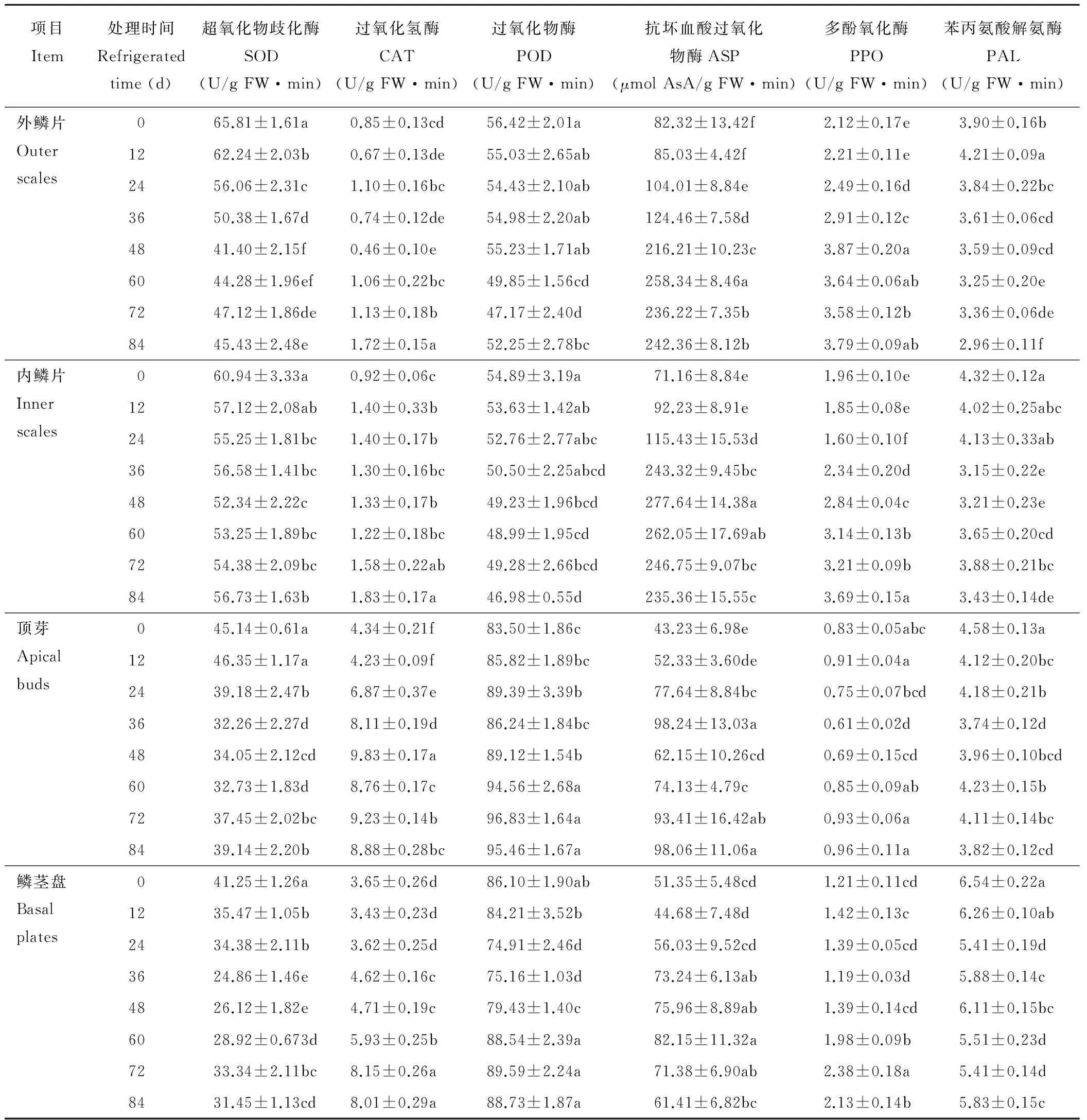
表2 百合鳞茎冷藏过程中保护酶活性的变化Table 2 Changes of protective enzymes activity of L.pumilum bulbs during cold storage
2.3细叶百合鳞茎冷藏过程中碳水化合物与鳞茎保护酶的相关性分析
从碳水化合物与鳞茎保护酶的相关性数据中分析可知(表3),鳞茎不同部位淀粉、可溶性糖与6种保护酶活性的相关性是不同的,外层鳞片与内层鳞片中各个指标的相关性是一致的,其相关系数和显著性水平不同。鳞茎各部位淀粉与CAT、PPO、ASP均表现负相关性,SOD、POD、PAL与鳞片中淀粉表现为相关系数较高的正相关性。顶芽及鳞茎盘中淀粉与POD、PAL相关性表现一致,淀粉与SOD相关性则相反。鳞片中可溶性糖与SOD、PPO、ASP 相关性都达到了显著水平,顶芽及鳞茎盘中可溶性糖与CAT活性表现为极显著正相关。各种保护酶在百合鳞茎不同部位的相关关系差异很大,SOD与CAT在鳞茎各部位中均表现为负相关,顶芽中相关系数达到了极显著水平,其他部位相关系数较低。SOD与ASP、CAT与PAL、PAL与ASP在鳞茎不同部位中均表现为负相关性,相关性水平各有差异。SOD与PAL、CAT与 ASP在鳞茎不同部位中均表现为正相关,总体来看,这4种酶类所表现的正相关系数都不是很高。
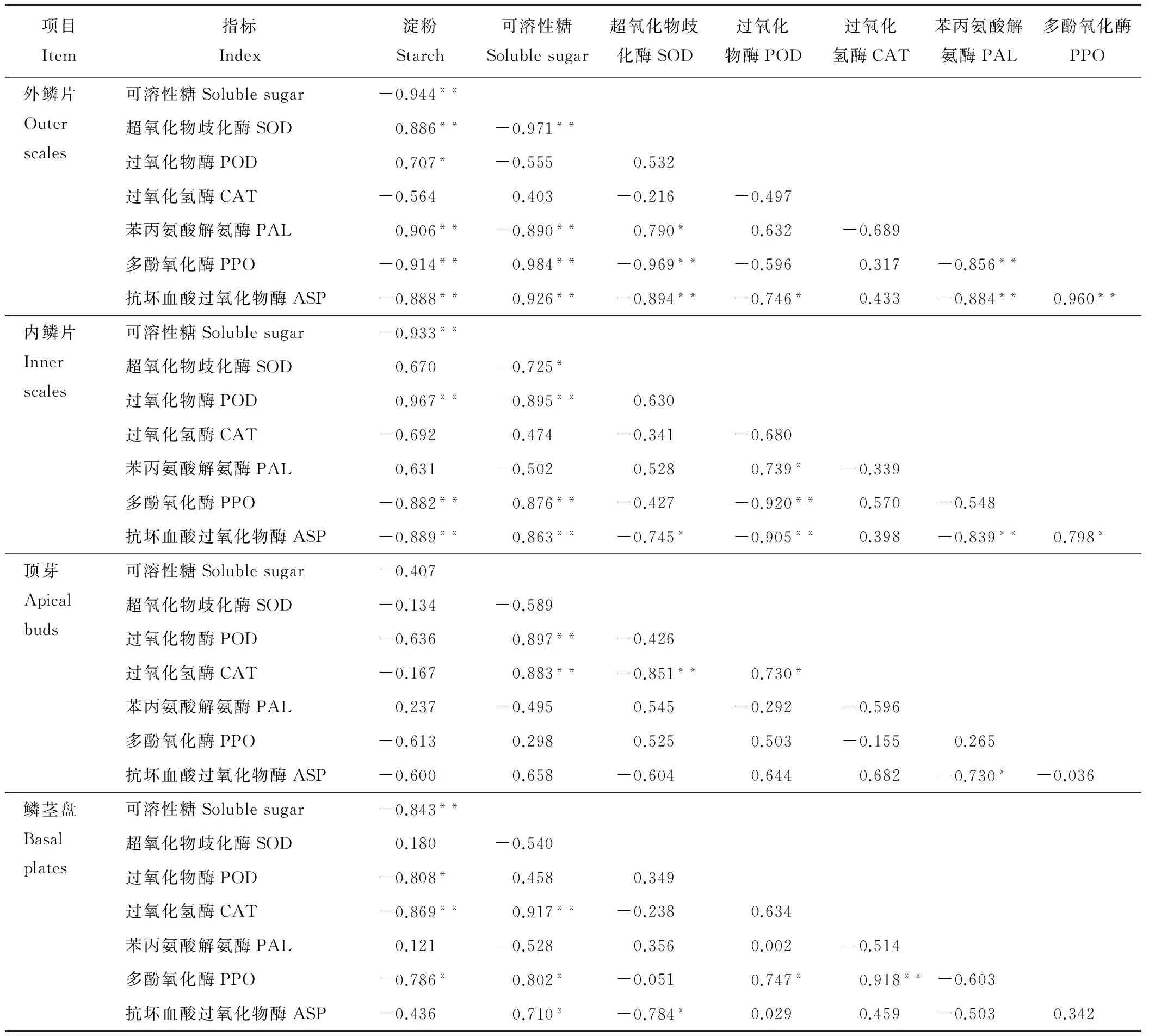
表3 鳞茎中碳水化合物与保护酶的相关分析Table 3 Correlation analysis of carbohydrates and protective enzymes in bulbs
**和*分别表示0.01和0.05水平的相关性。
**and*indicate the significance ofP<0.01 andP<0.05 respectively.
3 讨论
酶活性的变化是影响植物体一切生理生化反应变化的重要因素,它是细胞代谢的原动力之一。百合休眠鳞茎在整个低温贮藏期,从休眠的逐渐破除到芽的萌发生长,整个过程中不断伴随着一系列的物质分解和合成代谢,期间鳞茎内相关的酶也发生了复杂的变化。
鳞片、顶芽及鳞茎盘SOD、POD、CAT活性在冷藏前期都有下降趋势,低温贮藏中后期,SOD、CAT、ASP活性均升高,顶芽及鳞茎盘POD在冷藏中期也呈上升趋势,3种酶活性的增加可能是因为低温处理诱导鳞茎产生了高水平的活性氧,因此刺激了抗氧化酶活性的提高,SOD能够催化超氧化物分解生成H2O2,以此保护细胞免受氧自由基的破坏和氧化损伤。本试验中,SOD活性在冷藏前期下降可能是因为分解O2-·产生的H2O2在鳞茎内积累没有及时被降解而出现的反馈抑制作用,随着低温的积累以及各种抗氧化酶活性的增加,H2O2被分解,SOD的活性又升高。乔永旭等[3]的研究表明,东方百合“索蚌”在4℃低温处理过程中鳞茎中O2-·的释放速率在冷藏前期缓慢上升,30 d时达到最大值,以后迅速下降。H2O2含量在低温冷藏15~45 d内逐渐升高,45 d后随低温积累含量迅速下降。其测定的SOD活性变化与本试验的研究也是一致的,可见SOD活性与鳞茎内H2O2的含量变化密切相关。高东升等[12]认为H2O2含量的提高促进了植物休眠的解除,H2O2可能作为一种信号物质通过改变鳞茎的代谢途径进而促进鳞茎打破休眠状态。邵浩和马锋旺[13]认为花芽细胞内活性氧代谢影响着植物休眠解除的进程。已有研究表明在植物打破休眠时有多种与活性氧产生和信号转导相关的基因表达[14-15],H2O2含量的升高有活化戊糖磷酸途径的功能,使呼吸代谢由糖酵解途径转向戊糖磷酸途径[16]。POD和CAT是植物体内清除H2O2的重要酶类。POD是IAA 侧链氧化酶,其能影响IAA的浓度[17],POD活性与IAA含量呈反比。IAA对休眠解除起促进作用[18]。Patrick等[19]研究证明在休眠解除时期及萌发时期IAA 含量增加,马铃薯块茎处于休眠状态时POD活性较高,休眠解除过程中,POD活性下降。POD可能是调控马铃薯块茎休眠的一种关键酶[17]。本试验中鳞片中POD的活性在冷藏过程中持续下降,而顶芽和鳞茎盘中的活性在贮藏中后期却有升高的趋势,在后期POD对顶芽及鳞茎盘中H2O2的清除起了一定的作用。POD在鳞茎不同部位的活性变化说明顶芽及鳞茎盘和鳞片在解除休眠的过程并不是同步的,各种代谢相关酶在不同器官中的作用也不是完全相同的。低温处理所引起的活性氧积累可能是百合鳞茎低温破眠的原因之一。
一些报道认为抗坏血酸氧化酶参与了休眠解除的呼吸代谢过程[20],在低温处理36~60 d内,ASP、CAT活性快速上升,后期趋于稳定。可能是因为鳞茎在冷藏中后期适应低温后逐渐解除休眠,鳞茎自身找到低温条件下的代谢平衡点,当休眠破除,鳞茎萌发,细胞内代谢水平没有明显变化,导致活性不再升高。SOD、POD在冷藏后期也没有太大的波动。SOD活性最低点也出现在冷藏36~60 d,可见,36 d是鳞茎解除休眠的起点,60 d时鳞茎可能已经解除休眠。在萌发实验中,此时的鳞茎萌发率已达到75%。
PPO是植物体内普遍存在的一种末端氧化酶,和休眠块茎中呼吸代谢有关,它可催化多酚类物质氧化形成醌。孙红梅等[4]指出百合鳞茎中虽然存在PPO和其天然底物酚类物质,但由于活细胞中酶和底物定位的区域化,PPO活性与酚类物质含量并不存在显著相关关系。而且,PPO 活性变化与酚类物质含量的变化在不同百合种类及不同园艺作物之间的变化也有很大差异。本实验中,PPO在受到低温诱导之后,酶活性在冷藏中后期有一个明显上升的过程,王鹏等[17]在马铃薯冷藏试验中发现,在冷藏初期PPO活性有升高趋势,而整个冷藏期间活性变化不大。PPO与抗逆,抗病虫、鳞茎的活力都有着密切的关系。鳞茎受到低温的诱导并在破除休眠的过程中PPO活性增加。后期变化平缓,说明鳞茎没有衰老的迹象。具有较强的生活力和抗逆性。刘艳萍[5]认为酚类物质是休眠的抑制物质,5℃低温处理时,酚类物质含量与PAL活性极显著正相关,这与本实验中 PAL在解除休眠过程中酶活性呈下降的趋势是相符的,因而PAL可能是调控鳞茎休眠的一种关键酶。酚类物质的合成都是在水溶性酚类物质的基础上进行的,苯丙氨酸的脱氨基是水溶性酚类物质合成的第一步,PAL是催化这一过程的关键酶。酚类物质容易氧化,PPO是酚类物质氧化的关键酶[5]。因此,酚类物质的抑制途径可能是通过耗氧使百合鳞茎的顶芽萌发缺乏足够氧气,进而影响正常呼吸代谢过程,低温可能是改变与酚类物质合成和氧化相关酶的活性,进而影响酚类物质的合成和氧化,使总酚含量下降,消除酚类物质对百合鳞茎休眠解除的抑制作用,使顶芽恢复正常的呼吸代谢,最终休眠解除[5]。
总之,鳞茎在低温解除休眠过程中,抗氧化酶活性的变化与休眠的解除是密切相关的。这些酶的活性变化,虽然存在着一定的共性,但它们的变化幅度,峰值出现的时间等还是有较大差别。要揭示百合鳞茎保护酶在低温解除休眠过程中深层的代谢机制,抗氧化酶对鳞茎休眠解除的作用及各种酶间的互作等问题,还需要在具体的代谢途径研究中进一步明确。
[1] Xu R Y, Niimi Y, Han D S.Changes in endogenous abscisic acid and soluble sugars levels during dormancy-release in bulbs ofLiliumrubellum.HortScience, 2006, 111:68-72.
[2] Sun H M, Li T L, Li Y F.Physiological mechanism of metabolism of carbohydrate, phenols, free amino acid and endogenous hormones in middle scales ofLiliumdavidiivar.unicolorbulbs stored at low temperature for dormancy release.Scientia Agricultura Sinica, 2005, 38(2):376-382.
[3] Qiao Y X, Zhang Y P, Chen C,etal.Relationship between breaking of dormancy and antioxidative systems enzymes in low temperature treatment in bulbs of oriental lily‘sorbonne’.Southwest China Journal of Agricultural Sciences, 2010, 23(1):161-163.
[4] Sun H M, Li T L, Li Y F.Changes of phenols content and activity of enzymes related to phenols in lily bulbs stored at different cold temperatures for breaking dormancy.Scientia Agricultura Sinica, 2004, 37(11):1777-1782.
[5] Liu Y P.Studies on Physiological Mechanisms of lily Bulb Stored at Different Cold Temperatures for Breaking Dormancy[D].Haerbin:Northeast Forestry University, 2007.
[6] Tu S P, Mu D, Liu C.The physiological and biochemical changes of lily bulbs during dormancy release with cold treatment.Acta Agriculturae Universitatis Jiangxiensis, 2005, 27(3):404-407.
[7] Liu F, Wang J Y, Wang X L,etal.The apical bud cell ultra-structure changes ofLiliumpumilumbulbs during breaking dormancy under refrigerated condition.Horticulturae Sinica, 2013, 40(6):1110-1118.
[8] Li H S.Principle and Technology of Plant Physiological and Biochemical Experiments[M].Beijing:Higher Education Press, 2000.
[9] Gao J F.Plant Physiology Experiment Instruction[M].Beijing:Higher Education Press, 2006.
[10] Zou Q.Plant Physiology Experiment Instruction[M].Beijing:China Agriculture Press, 1995:36-39.
[11] Shen W B, Xu L L, Ye M B,etal.Study on determination of ASP activity.Plant Physiology Communications, 1996, 32(3):203-205.
[12] Gao D S, Shu H R, Li X L.The relationship of H2O2content changes in buds with the endodormancy of fruit trees.Acta Horticulturae Sinica, 2002, 29(3):209-213.
[13] Shao H, Ma F W.Relationship between breaking of dormancy and reactive oxygen species metabolism in flower buds of pear.Journal of Plant Physiology and Molecular Biology, 2004, 30(6):660-664.
[14] Oracz K, El-Maarouf-Bouteau H, Kranner I.The mechanisms involved in seed dormancy alleviation by hydrogen cyanide unravel the role of reactive oxygen species as key factors of cellular signaling during germination.Plant Physiology, 2009, 150:494-505.
[15] Rojas-Beltran J A, Dejaeghere F, Abd Alla Kotb M.Expression and activity of antioxidant enzymes during potato tuber dormancy.Potato Research, 2000, 43:383-393.
[16] Levy A, Erlanger M, Rosenthal M,etal.A plasmodesmata associated β-1, 3-glucanase inArabidopsis.Plant Journal, 2007, 49:669-682.
[17] Wang P, Lian Y, Jin L J.The research on the regulation of enzymes during dormancy and dormancy releasing.Acta Agriculturae Boreali-Sinica, 2003, 18(1):33-36.
[18] Fan W N, Sun X G, Ni J X,etal.Effects of photoperiod on photochromes and endogenous hormones of alfalfa with different fall dormancies.Acta Prataculturae Sinica, 2014, 23(1):177-184.
[19] Patrick R, Clare W, Hanneke M F.Low temperature sensing in tulip(Tulipagesneriana)is mediated through an increased response to auxin.Journal of Experimental Botany, 2000, 51:587-594.
[20] Siegel M R, Sisler H D.Site of action of cycloheximide in cells ofSaccharyomycespastorianus.I.Effect of the antibiotic on cellular metabolism.Biochemistry and Biophysics Acta, 1964, 81:70-82.
参考文献:
[2] 孙红梅, 李天来, 李云飞.低温解除休眠过程中兰州百合中部鳞片物质变化的生理机制.中国农业科学, 2005, 38(2):376-382.
[3] 乔永旭, 张永平, 陈超, 等.百合鳞茎低温解除休眠与抗氧化系统酶的关系.西南农业学报, 2010, 23(1):161-163.
[4] 孙红梅, 李天来, 李云飞.低温解除休眠过程中兰州百合鳞茎酚类物质含量及相关酶活性变化.中国农业科学, 2004, 37(11):1777-1782.
[5] 刘艳萍.百合鳞茎低温解除休眠过程中生理生化变化研究[D].哈尔滨:东北林业大学, 2007.
[6] 涂淑萍, 穆鼎, 刘春.百合鳞茎低温解除休眠过程中的生理生化变化研究.江西农业大学学报, 2005, 27(3):404-407.
[7] 刘芳, 王家艳, 王晓丽, 等.细叶百合鳞茎在低温解除休眠过程中茎尖细胞超微结构的变化.园艺学报, 2013, 40(6):1110-1118.
[8] 李合生.植物生理生化实验原理和技术[M].北京:高等教育出版社, 2000.
[9] 高俊凤.植物生理学实验指导[M].北京:高等教育出版社, 2006.
[10] 邹琦.植物生理生化实验指导[M].北京:中国农业出版社, 1995:36-39.
[11] 沈文飚, 徐朗莱, 叶茂炳, 等.抗坏血酸过氧化物酶活性测定的探讨.植物生理学通讯, 1996, 32(3):203-205.
[12] 高东升, 束怀瑞, 李宪利.几种落叶果树 H2O2含量变化与自然休眠关系的研究.园艺学报, 2002, 29(3):209-213.
[13] 邵浩, 马锋旺.梨树花芽休眠解除与活性氧代谢的关系.植物生理与分子生物学学报, 2004, 30(6):660-664.
[17] 王鹏, 连勇, 金黎甲.马铃薯块茎休眠及萌发过程中几种酶活性的变化.东北农学报, 2003, 18(1):33-36.
[18] 樊文娜, 孙晓格, 倪俊霞, 等.光周期对不同秋眠型苜蓿光敏色素和内源激素的影响.草业学报, 2014, 23(1):177-184.
Relationship between dormancy breaking and protective enzymes in refrigeratedLiliumpumilumbulbs
LIU Fang*, LI Dan-Dan, LIAN Hua, WU Xia, CHEN Ye-Wen, LI Yu-Qi, XIE Shou-Feng, CHEN Xue-Wu
CollegeofAgriculture,HeilongjiangBayiAgriculturalUniversity,Daqing163319,China
Changes in bulb protective enzyme activity and carbohydrate content ofLiliumpumilumbulbs held at 5℃to break dormancy were investigated.Results showed that superoxide dismutase (SOD) activity of scales, apical buds and basal plates decreased within 0-24 days (d).Except for apical buds, peroxidase (POD) activity within 0-24 d declined in all bulb parts and catalase (CAT) activity of the outer scales, apical buds and basal plates decreased within 0-12 d.During middle and later periods, SOD, CAT and ascorbate peroxidase (ASP) increased, POD activity decreased, POD and polyphenol oxidase (PPO) activity of apical buds and basal plates also increased in the middle of the cold storage period.The roles of various metabolism related enzymes in different organs were not the same.With low temperature treatment for 36-60 d, ASP and CAT activity initially rapidly increased but later stabilized.The minimum value of SOD activity was found after 36-60 d cold storage.Starch content was negatively correlated with CAT, PPO, ASP, SOD and POD in all bulb parts; phenylalanine ammonia lyase (PAL) was positively correlated with starch in the scales.Bulb dormancy breaking started at 36 d, and was mostly complete at 60 d.
Liliumpumilum; bulb; dormancy; cold storage; protective enzymes
10.11686/cyxb2015031
http://cyxb.lzu.edu.cn
2015-01-20;改回日期:2015-04-24
黑龙江省农垦总局科技攻关项目(HNK125BZD-02-17)和黑龙江八一农垦大学大学生创新创业训练计划项目(XC2015001)资助。
刘芳(1980-),女,黑龙江双城人,实验师,博士。
*通信作者Corresponding author.E-mail:byndliufang@163.com
刘芳, 李丹丹, 廉华, 吴瑕, 陈业雯, 李雨琦, 谢守峰, 陈学武.细叶百合冷藏过程中鳞茎保护酶活性与休眠解除的关系.草业学报, 2015, 24(12):180-187.
LIU Fang, LI Dan-Dan, LIAN Hua, WU Xia, CHEN Ye-Wen, LI Yu-Qi, XIE Shou-Feng, CHEN Xue-Wu.Relationship between dormancy breaking and protective enzymes in refrigeratedLiliumpumilumbulbs.Acta Prataculturae Sinica, 2015, 24(12):180-187.

