不同精粗比颗粒饲料对断奶公犊牛瘤胃发酵参数和微生物的影响
杨宏波,刘红,占今舜,林淼,赵国琦
(扬州大学动物科学与技术学院,江苏 扬州 225009)
不同精粗比颗粒饲料对断奶公犊牛瘤胃发酵参数和微生物的影响
杨宏波,刘红,占今舜,林淼,赵国琦*
(扬州大学动物科学与技术学院,江苏 扬州 225009)
本试验旨在研究不同精粗比颗粒饲料对中国荷斯坦断奶公犊牛瘤胃微生物蛋白、发酵参数和微生物数量的影响。选用12头3月龄大的中国荷斯坦断奶公犊牛,按照日龄相近(103.92±1.5 d)、体重相似(121.25±4.12 kg)的原则随机分成4组,每组3头,分别饲喂精粗比为75∶25(Ⅰ)、70∶30(Ⅱ)、65∶35(Ⅲ)、60∶40(Ⅳ)的4种全价颗粒饲料。预试期14 d,正试期56 d。测定犊牛瘤胃微生物蛋白、发酵参数和微生物数量。结果表明,处理组Ⅳ的总挥发性脂肪酸和乙酸浓度最低,且显著低于处理组Ⅰ(P<0.05);处理组Ⅳ的丁酸浓度最高,且显著高于处理组Ⅰ、Ⅲ(P<0.05);处理组Ⅲ的乙酸/丙酸最大,且显著大于处理组Ⅳ(P<0.05)。处理组Ⅳ的白色瘤胃球菌、溶纤维丁酸弧菌和真菌的相对表达量最高,且显著高于其他各处理组(P<0.05);处理组Ⅲ的黄色瘤胃球菌的相对表达量最高,且显著高于其他各处理组(P<0.05)。综上所述,高精料全价颗粒饲料虽然能提高犊牛瘤胃总挥发性脂肪酸和乙酸的水平,但会抑制瘤胃纤维降解菌和厌氧真菌的生长。
颗粒饲料;微生物蛋白;瘤胃发酵;瘤胃微生物;犊牛
断奶后3~6月龄是犊牛生长发育最强烈的时期,犊牛不仅体重逐渐增加,同时消化器官也在快速发育,各种代谢特征发生变化。因此,这时期的犊牛日粮极为重要,不同精粗比和结构的日粮对犊牛的发育及瘤胃内环境都会产生不同的影响。
瘤胃是反刍动物最主要的消化器官之一,成年动物主要靠瘤胃中纤毛虫、细菌和真菌等微生物作用,产生挥发性脂肪酸并合成微生物蛋白,为机体提供能量和蛋白质。瘤胃微生物与动物形成了相互依赖又互相制约的关系,微生物可以帮助动物降解粗饲料,从而为宿主的生长提供能量和营养物质,同时动物也为微生物的生存提供了充足的养分和适宜的环境。
目前对颗粒饲料的研究主要集中在颗粒精料对肉牛[1-3]、奶牛[4-6]和家禽[7-9]的生产性能及饲料转化率上。然而,研究利用苜蓿(Medicagosativa)和小黑麦(Loliummultiflorum)草粉作为原料制成颗粒饲料对断奶犊牛瘤胃发酵参数和微生物影响的报道很少[10-16]。因此,研究不同精粗比颗粒饲料对犊牛瘤胃内环境和微生物的影响,对颗粒饲料的运用及推广是非常重要的。本试验旨在研究不同精粗比颗粒饲料对断奶犊牛瘤胃发酵参数和微生物数量的影响,探求不同精粗比颗粒饲料影响断奶犊牛瘤胃微生物和瘤胃发酵的机理,并制定合理的断奶犊牛日粮,为科学培育优良青年牛提供一定的参考依据。
1 材料与方法
1.1试验日粮
根据NRC (2001)营养需要配制各试验组犊牛配方。试验组Ⅰ、试验组Ⅱ、试验组Ⅲ和试验组Ⅳ分别饲喂精料与粗料质量比为75∶25,70∶30,65∶35和60∶40的颗粒饲料(以上各数值均按照风干样重量计算)。4种试验日粮中粗蛋白、粗脂肪和常量元素等指标一致,能量相近,粗料按照苜蓿和小黑麦3∶1组成。所有原料经粉碎后在扬州大学农牧场采用20型颗粒饲料机组制成。各试验组颗粒料的配方见表1[10],营养成分见表2。
1.2试验设计及饲养管理
试验于2014年3月至2014年5月在扬州大学实验农牧场进行。选择日龄相近(103.92±1.5) d、平均体重为 (121.25±4.12) kg的中国荷斯坦断奶公犊牛12头,分为4组,每组3头,颗粒饲料每天于8:30,14:30,20:30饲喂3次,预试期14 d,正试期 56 d。根据3~6月龄犊牛采食量确定各试验组的饲喂量,平均每周调整1次饲喂量,并保证每组犊牛的干物质采食量基本一致。试验期每组犊牛分栏饲养,自由饮水,保证犊牛每天有6~7 h户外活动时间,每日清晨犊牛饲喂后打扫圈舍,并且每周至少对牛舍消毒2次。

表1 各试验组颗粒料配方组成(干物质基础)Table 1 Pellet diet composition of each group (DM basis) %
预混料为每kg日粮提供:铁90 mg、铜12.5 mg、锰60 mg、锌100 mg、碘1.5 mg、硒0.3 mg、钴1.0 mg、维生素A 15000 IU、维生素D 5000 IU、维生素E 50 mg。
Premix provided the following per kilogram of the diet:Fe 90 mg, Cu 12.5 mg, Mn 60 mg, Zn 100 mg, I 1.5 mg, Se 0.3 mg, Co 1.0 mg, VA 15000 IU, VD 5000 IU, VE 50 mg.
1.3瘤胃液样品的采集与处理
正式实验后每2周最后1 d,在晨饲后4 h通过口腔采液器(武汉科立博有限公司)从瘤胃不同位点采集50 mL瘤胃液样(之前的唾液舍弃),立即测定其pH,经4层纱布过滤摇匀后,分装于10 mL的离心管中[11]。
1份加入0.5 mol HCl保存于-20℃冰箱中,待测氨态氮(NH3-N)含量;1份添加25%偏磷酸,于-20℃冰箱中用于挥发性脂肪酸(volatile fatty acid, VFA)浓度测定;1份混合12.5%三氯乙酸(trichloroacetic acid, TCA)用于瘤胃微生物蛋白(microbial crude protein, MCP)合成分析;另一部分于-80℃超低温冰箱中保存,用于瘤胃液细菌定量分析,待测细菌包括黄色瘤胃球菌(Ruminococcusflavefaciens, RF)、白色瘤胃球菌(Ruminococcusalbus, RA)、溶纤维丁酸弧菌(Butyrivibriofibrisolvens, BF)、栖瘤胃普雷沃氏菌(Prevotellaruminicola, PR)和真菌(general fungi)。
1.3.1瘤胃液发酵指标及瘤胃MCP合成测定方法 氨态氮浓度测定采用苯酚-次氯酸钠比色法[12],瘤胃MCP浓度参照凯氏微量定氮法进行测定[13],VFA含量按照Kristensen[14]所述方法用气相色谱测定。

表2 各试验组日粮配方的营养水平 Table 2 Nutrition level of each group
营养水平除能量、钙、磷、赖氨酸和蛋氨酸外均为实测值。NEL、Ca、P、Lys and Met was a calculated value,while the others were measured values.DM:Dry matter; Ash:Crude ash; CP:Crude protein; EE:Crude fat; NDF:Neutral detergent fiber; ADF:Acid detergent fiber.
1.3.2瘤胃液微生物总DNA的提取与检验 瘤胃液样品于冰上溶解后振摇30次以混合均匀,取200 μL瘤胃液样品,采用粪便基因组提取试剂盒提取瘤胃液微生物总DNA(Tiangen生物科技有限公司),提取方法参照试剂盒说明书。用超微量分光光度计(NanoDrop-1000,美国赛默飞世尔科技公司)检测总DNA的浓度和纯度(OD260/280和OD260/230),用琼脂糖凝胶电泳法检测DNA的质量。然后将总DNA于-20℃冰箱中保存备用。

表3 荧光定量PCR引物Table 3 Primers used for real-time PCR quantification
引物设计是基于细菌的16S rRNA基因。Primers were based on 16S rRNA genes for bacterial groups.
1.3.3引物设计与合成 引物参照文献设计,由Invitrogen公司合成,具体引物序列见表3。
1.3.4瘤胃细菌定量方法 本试验采用相对定量法[15]对瘤胃液中部分微生物进行定量。
荧光定量PCR分析采用罗氏Light Cycler 96和序列检测软件(Version 1.1)进行。每个样品3个重复,PCR扩增采用20 μL反应体系,体系组成如表4所示。
PCR扩增反应程序为:1)95℃ 预变性30 s;2)95℃变性5 s,60℃退火/延伸20 s并采集荧光信号,共40个循环;3)溶解曲线分析,以20℃/s的速度从95℃降至 65℃,再以20℃/s的速度缓慢加热至95℃,在95℃保持0 s,在65℃保持15 s,结束时4℃保存。

表4 荧光定量PCR扩增体系Table 4 Realtime PCR reaction system
1.3.5目的基因相对定量的计算 目的基因相对定量用2-ΔΔCt法计算,以瘤胃液总细菌(general bacteria, GB) DNA作为内参基因,用对照组的基因进行校正[16]。荧光定量PCR基因相对表达量表示成目的基因相对于GB的倍数。ΔCt值表示某样品目的基因临界循环数(Ct)与内参基因Ct值的差值,而ΔΔCt值表示试验组样品平均ΔCt与对照组平均ΔCt的差值。结果以平均倍数±标准误表示。
1.4数据处理与统计分析
采用SPSS软件进行单因素方差分析,采用Duncan氏法进行差异显著者多重比较,以P<0.05作为差异显著的判断标准,试验结果以平均值±标准误表示。
2 结果与分析
2.1不同精粗比颗粒饲料对断奶犊牛瘤胃MCP浓度的影响
由表5可知,不同精粗比颗粒饲料对各处理组瘤胃MCP浓度均无显著影响(P>0.05)。

表5 不同精粗比颗粒饲料对断奶犊牛瘤胃微生物蛋白浓度的影响Table 5 Effects of diet pellets with different concentrate-roughage ratio on rumen microbial proteins (MCP) of weaned bull calves
2.2不同精粗比颗粒饲料对断奶犊牛瘤胃发酵参数的影响
由表6可知,处理组Ⅳ的总挥发性脂肪酸和乙酸浓度最低,且显著低于处理组Ⅰ(P<0.05);处理组Ⅳ的丁酸浓度最高,且显著高于处理组Ⅰ、Ⅲ(P<0.05);处理组Ⅲ的乙酸与丙酸比值最大,且显著大于处理组Ⅳ(P<0.05)。此外,不同精粗比颗粒饲料对各处理组pH、氨态氮、丙酸、异丁酸、异戊酸和戊酸的浓度无显著影响(P>0.05)。
2.3不同精粗比颗粒饲料对断奶犊牛瘤胃细菌的影响
由表7可知,处理组Ⅳ的白色瘤胃球菌、溶纤维丁酸弧菌和真菌的相对表达量最高,且显著高于其他各处理组(P<0.05);不同精粗比颗粒饲料对各处理组栖瘤胃普雷沃氏菌的数量无显著影响(P>0.05);此外,处理组Ⅲ的黄色瘤胃球菌的相对表达量最高,且显著高于其他各处理组(P<0.05)。
3 讨论
3.1不同精粗比颗粒饲料对断奶犊牛瘤胃MCP浓度的影响
能量和蛋白质是维持瘤胃微生物代谢最主要的营养来源。其中瘤胃微生物是反刍动物最主要的氮源,它能够为反刍动物提供40%~80%的蛋白需要量[20]。然而,MCP的高产是以瘤胃内氮源和能量的有效同步为基础的[21]。也有研究表明,瘤胃MCP合成量与瘤胃稀释率呈正相关[22-23]。鲁林等[24]采用单外流连续培养系统研究不同精料水平(20%, 80%)与稀释率对瘤胃MCP合成效率的影响,研究发现提高精料水平和稀释率,均能明显提高瘤胃微生物氮日产生量与微生物蛋白质的合成效率。本研究中,各处理组瘤胃细菌蛋白合成量无显著差异,可能与各处理组日粮的能量和蛋白供应基本一致有关。

表6 不同精粗比颗粒饲料对断奶公犊牛瘤胃发酵参数的影响Table 6 Effects of diet pellets with different concentrate-roughage ratio on rumen fermentation parameter of weaned bull calves
注:同行不同小写字母表示差异显著 (P<0.05),下同。
Note:In the same row, values with different lowercases mean significant differences (P<0.05),the same below.
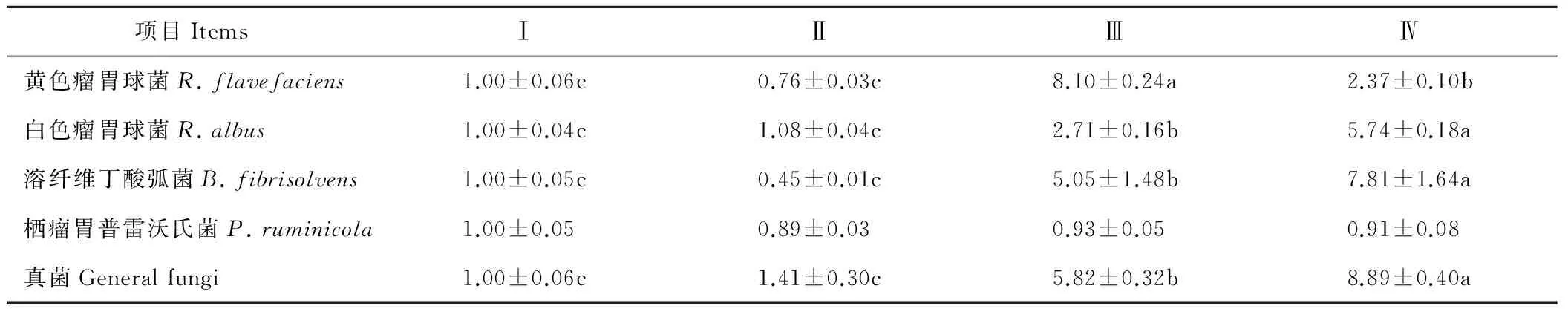
表7 不同精粗比颗粒饲料对断奶公犊牛瘤胃细菌相对表达量的影响Table 7 Effects of diet pellets with different concentrate-roughage ratio on the normalized ratio of rumen bacterias of weaned bull calves
3.2不同精粗比颗粒饲料对断奶犊牛瘤胃发酵参数的影响
瘤胃pH是反映瘤胃微生物代谢平衡状况和瘤胃发酵状况的综合指标之一,影响其最主要的一个因素是与反刍活动呈正相关的唾液缓冲液的分泌量[25]。本试验中,各处理组间的瘤胃pH无显著差异,虽然各处理组颗粒饲料中粗饲料含量不同,但所有原料经过统一粉碎后制成颗粒,使各组犊牛反刍次数相近而导致进入瘤胃中的唾液量相同,最终使瘤胃pH无显著差异。日粮中粗蛋白水平和微生物蛋白质的降解是瘤胃NH3-N重要的两种来源[26]。瘤胃微生物生长所需要的氮主要来源于NH3-N,它为微生物提供18%~100%的氮源[27]。对微生物的生长,瘤胃内NH3-N浓度不宜过高或过低,所以保持最适浓度的NH3-N是保证瘤胃MCP产量最重要的条件。影响瘤胃NH3-N浓度的主要原因是饲料中粗蛋白的水平以及蛋白质的降解速度。Michalski等[28]研究发现,日粮中非纤维性碳水化合物是限制瘤胃微生物对NH3-N利用的主要因素,适当提高日粮中非纤维性碳水化合物的水平,能促进瘤胃微生物对NH3-N的利用。Agle等[29]研究指出,奶牛采食高粗料日粮时会导致瘤胃中氨氮水平的降低,原因是结构性碳水化合物可以降低氨的产量,进而能提高瘤胃微生物对瘤胃中氨的利用率。本实验各处理组间NH3-N的浓度无显著差异,原因可能是各组瘤胃MCP合成量相近,微生物对NH3-N的利用率相同引起的。此外,各组颗粒饲料中蛋白水平相近也可能是造成瘤胃NH3-N浓度无显著差异的原因之一。
挥发性脂肪酸能为动物机体提供70%~80%的可消化能,是反刍动物赖以生存、保持正常活动的主要能源,同时它参与各种机体代谢[30]。瘤胃液VFA主要由乙酸、丙酸、丁酸以及少量超过四碳的酸和支链脂肪酸组成。通常根据乙、丙、丁酸相对比例的高低,将瘤胃发酵类型分为乙酸发酵、丙酸发酵、丁酸发酵3种,一般用乙酸/丙酸来表示瘤胃发酵类型的变化。有研究表明,日粮精粗比对瘤胃总挥发性脂肪酸(total volatile fatty acid, TVFA)的产生影响不大[31-32],然而也有研究发现瘤胃TVFA的产量与日粮精粗比和组成有关[33]。本试验结果表明,瘤胃TVFA和乙酸的产量随颗粒饲料中精料水平的降低而减少,原因可能是由于高精料组能为微生物提供更多的可发酵底物而造成的。此外,处理组Ⅳ的乙酸/丙酸与其他处理组相比降低,且丙酸比例与其他处理组相比有增加的趋势,这说明随着颗粒饲料中粗料水平的升高,犊牛瘤胃的发酵类型会由乙酸发酵型往丙酸发酵型转变,这是因为增加日粮中精料水平会降低瘤胃中乙酸浓度,苜蓿的含量逐渐升高且动物采食苜蓿比采食其他干草会产生更多的丙酸[31]。
3.3不同精粗比颗粒饲料对断奶犊牛瘤胃细菌的影响
Grubb和Dehority[34]研究表明,在干物质采食量相同的条件下,随着绵羊日粮中精粗比的增大,其中细菌的数量会显著升高,而纤维降解菌的数量会降低。Leedle和Bryant[35]研究发现,给绵羊分别饲喂精粗比为68∶32和23∶77的两种日粮,绵羊采食高粗料日粮时,在特异性菌群中纤维分解菌的数量较少,而分解木聚糖和胶质菌的数量较多,两种日粮中总细菌的数量是没有差异性的。也有报道称[36-37],随着日粮精粗比的改变,瘤胃纤维降解菌的数量不会产生显著性的改变。然而本实验结果表明,瘤胃中黄色瘤胃球菌、白色瘤胃球菌和溶纤维丁酸弧菌等纤维分解菌的数量随着颗粒饲料中粗饲料水平的升高而显著升高。这与Varel和Dehority[38]的研究结果一致。溶纤维丁酸弧菌不仅有降解纤维物质产生VFA的功能,而且能吸收乙酸转化成丁酸的作用,因此也可以解释处理组Ⅳ的乙酸浓度最低而丁酸浓度最高。黄色瘤胃球菌和白色瘤胃球菌是瘤胃中主要的纤维降解菌,能产生大量的纤维素酶和半纤维素酶,其中主要为木聚糖酶,从而对纤维的降解起着重要的作用。黄色瘤胃球菌发酵的产物主要为琥珀酸、乙酸和甲酸,还有少量的氢气、乙醇和乳酸,而白色瘤胃球菌几乎不产生琥珀酸,但可以产生大量的氢气和乙醇。处理组Ⅲ的黄色瘤胃球菌的数量显著高于处理组Ⅳ,这是由于这两种纤维分解菌具有相互抑制的作用,白色瘤胃球菌可产生细菌素,对黄色瘤胃球菌的生长产生抑制作用[39],本试验中处理组Ⅳ的白色瘤胃球菌数量显著高于处理组Ⅲ,因此导致对处理组Ⅳ的黄色瘤胃球菌生长的抑制作用强于处理组Ⅲ,最终使处理组Ⅳ的黄色瘤胃球菌的数量显著低于处理组Ⅲ。
栖瘤胃普雷沃氏菌是瘤胃中主要蛋白降解菌之一,本实验中各处理组间的栖瘤胃普雷沃氏菌的数量无显著差异,这可能是由于各组颗粒饲料中粗蛋白水平一致造成的。此外,各处理组真菌的数量随着颗粒饲料中粗饲料水平的增加而显著升高,这说明日粮精粗比过高会显著抑制瘤胃真菌的生长[40]。原因可能是瘤胃厌氧真菌一般是附着于细胞壁厚、木质化程度较高的组织进行生长[41],然而木质化程度较高组织的含量会随着颗粒饲料中粗饲料添加量的升高而增加,所以才会导致真菌数量的显著升高。
从本试验结果来看,当犊牛采食等能等蛋的不同精粗比颗粒饲料时,对瘤胃TVFA、乙酸、丁酸和乙酸/丙酸均有显著影响,其中TVFA、乙酸和乙酸/丙酸基本上表现为随精料水平的降低而减少。此外,高精料的颗粒饲料对犊牛瘤胃纤维降解菌和厌氧真菌的生长有显著的抑制作用。
[1] Diao Q Y, Yang Z M, Chen J F,etal.Degradation in rumen and feeding value of pelletized forage and fodder for beef cattles.Pratacultural Science, 2011, 18(6):43-47.
[2] Gao J, Ding L Y, Chen L M.Comparison on the fattening effects of TMR pellet feed in different species of growing cattle.Acta Ecologae Animalis Domastici, 2013, 34(5):71-74.
[3] Chen L, Zhang L Q, Hong L.Analysis of nutritional composition for feedingCaraganaintermediapellets and the test for the fattening effect on beef cattle.Heilongjiang Animal Science and Veterinary Medicine, 2014, 11:95-98.
[4] Hein M, Grings E, Roffler R.Evaluation of a pellet formulated to replace whole cotton seed in the diet of dairy cows in early lactation.Journal of Dairy Science, 1990, 3(9):2469-2472.
[5] Marston S P, Clark G W, Anderson G W,etal.Maximizing profit on New England organic dairy farms:An economic comparison of 4 total mixed rations for organic Holsteins and Jerseys.Journal of Dairy Science, 2011, 94(6):3184-3201.
[6] Lai J T, Li N, Ma S C,etal.The effects of concentrate and forage mixed pellet feed on the apparent digestibility of fiber and protein of dairy cows.Chinese Journal of animal Science, 2007, 13(1):35-36.
[7] Frikha M, Safaa H M, Jimenez-moreno E,etal.Influence of energy concentration and feed form of the diet on growth performance and digestive traits of brown egg-laying pullets from 1 to 120 days of age.Animal Feed Science and Technology, 2009, 153(3):292-302.
[8] Abdollahi M R, Ravindran V, Svihus B.Pelleting of broiler diets:An overview with emphasis on pellet quality and nutritional value.Animal Feed Science and Technology, 2013, 179(1):1-23.
[9] Marston S P, Clark G W, Anderson G W,etal.Effect of pelleting temperature and probiotic supplementation on growth performance and immune function of broilers fed maize/soy-based diets.Animal Feed Science and Technology, 2013, 180(1):55-63.
[10] Yu A B, Zhuang T, Zhang J G.The effects of different cNFC/cNDF ratio on the degradation rate and fermentation in rumen of weaned calves.China Feed, 2012, (14):22-26.
[11] Xu J, Hou Y J, Yang H B.Effect of forage sources on rumen fermentation characteristics, performance, and microbial protein synthesis in midlactation cows.Asian-Australasian Journal of Animal Science, 2014, 27(5):667-673.
[12] Weatherburn M W.Phenol-hypochrolite reaction for determination of ammonia.Analytical Chemistry,1967, 39:971-974.
[13] Hall M B, Herejk C.Differences in yields of microbial crude protein frominvitrofermentation of carbohydrates.Journal of Dairy Science, 2001, 84:2486-2493.
[14] Kristensen N B.Quantification of whole blood short-chain fatty acids by gas chromatographic determination of plasma 2-chloroethyl derivatives and correction for dilution space in erythrocytes.Acta Agriculture Acandinavica Section A-Animal Science, 2000, 50:231-236.
[15] Denman S E, McSweeney C S.Development of a real-time PCR assay for monitoring anaerobic fungal and cellulolytic bacterial populations within the rumen.Fems Microbiology Ecology, 2006, 58:572-582.
[16] Livak K I, Schmittgen T D.Analysis of relative gene expression data using real-time PCR quantitative PCR and the 2-method.Methods, 2001, 25:402-428.
[17] Wang R F, Cao W W, Cerniglia C E.PCR detection ofRuminococcusspp.in human and animal faecal samples.Molecular and Cellular Probes, 1997, 11:259-265.
[18] Stevenson D M, Weimer P J.Dominance ofPrevotellaand low abundance of classical ruminal bacterial species in the bovine rumen revealed by relative quantification real-time PCR.Applied Microbiology and Biotechnology, 2007, 75:165-174.
[19] Ehsan K, Li S, Plaizier J C,etal.Rumen microbiome composition determined using two nutritional models of subacute ruminal acidosis.Applied and Environmental Microbiology, 2009, 75:7115-7124.
[20] Church K.A stochastic parts programme and noun phase parser for unrestricited text.Second conference.Applied Natural Language Processing, 1988, 23:214-216.
[21] Moscardini S, Wright T C, Luimes P H,etal.Effects of rumenundegradable protein and feed intake on purine derivative and urea nitrogen:Comparison with predictions from the cornell net carbohydrate and protein system.Journal of Dairy Science, 1998, 81:2421-2429.
[22] Meng Q X, Kerley M S.Protein fermentation by ruminal microorganisms and microbial growth efficiency as affected by dilution rate in continuous culture.Journal of Agricultural Science, 1998, 31:1-4.
[23] Thomson D J, Beever D E, Latham M J,etal.The effect of inclusion of mineral salts in the diet on dilution rate, the pattern of rumen fermentation and the composition of rumen microflora.Journal of Agricultural Science, 1978, 91:1-7.
[24] Lu L, Xia Z G, Meng Q X.Effects of concentrate and dilution rate on rumen microbial and fermentation.Feed Research, 2007, 4:52-55.
[25] Anantasook N, Wanapat M, Cherdthong A,etal.Effect of plants containing secondary compounds with palm oil on feed intake, digestibility, microbial protein synthesis and microbial population in dairy cows.Journal of Animal Science, 2013, 26(6):820-826.
[26] Srinivas B, Gupta B.Rumen fermentation, bacterial and total volatile fatty acid (TVFA) production rates in cattle fed on urea-molasses-mineral block licks supplemen.Animal Feed Science and Technology, 1997, 65(1):275-286.
[27] Salter D N, Daneshvar K, Smith R H.The origin of nitrogen incorporated into compounds in the rumen bacteria of steers given protein and urea containing diets.The British Journal of Nutrition, 1979, 41(1):197-209.
[28] Michalski J, Kowalczyk J, Czauderna M,etal.Incorporation of endogenous urea nitrogen into the amino acids of bacterial protein in the rumen of goats fed diets with various protein levels.Journal of Animal Science, 2013, 516:49.
[29] Agle M, Hristov A, Zaman S,etal.Effect of dietary concentrate on rumen fermentation, digestibility, and nitrogen losses in dairy cows.Journal of Dairy Science, 2010, 93(9):4211-4222.
[30] Van H M.Challenging the retinal for altering VFA ratios in growing ruminates.Feed Mix, 1996, 4(1):8-12.
[31] Cantalapiedra H G, Yanez R D, Martin G A,etal.Effects of forage:concentrate ratio and forage type on apparent digestibility, ruminal fermentation, and microbial growth in goats.Journal of Animal Science, 2009, 87(2):622-631.
[32] Cerrillo M, Russell J, Crump M.The effects of hay maturity and forage to concentrate ratio on digestion kinetics in goats.Small Ruminant Research, 1999, 32(1):51-60.
[33] Wang S P, Wang W J, Wang J Q,etal.Effects of dietary concentrate-to-forage ratio on rumen fermentation and performance of dairy cows.Journal of Northwest A & F University, 2007, 35(6):44-50.
[34] Grubb J A, Dehority B A.Effects of an abrupt change in ration from all roughage to high concentrate upon rumen microbial numbers in sheep.Applied Environmental Microbiology, 1975, 30:404-412.
[35] Leedle J A Z, Bryant M P.Diurnal variations in bacterial numbers and fluid parameters in ruminal contents of animals fed low or high forage diets.Applied and Environmental Microbiology, 1982, 44(2):402-412.
[36] Dehority B A, Tirabasso P A.Effect of ruminal cellulolytic bacterial concentrations oninsitudigestion of forage cellulose.Journal of Animal Science, 1998, 76:2905-2911.
[37] Mackie R I, Gilchrist M C.Microbiological and chemical changes in the rumen during the stepwise adaptation of sheep to high concentrate diets.Journal of Agricultural Science, 1978, 90:241-254.
[38] Varel V H, Dehority B A.Ruminal cellulolytic bacteria and protozoa from bison, cattle-bison hybrids, and cattle fed three alfalfa-corn diets.Applied and Environmental Microbiology, 1989, 55:148-153.
[39] Sun Y Z, Mao S Y, Yao W,etal.The dynamics of microorganism populations and fermentation characters of co-cultures of rumen fungi and cellulolytic bacteria on different substrates.Acta Microbiologica Sinica, 2006, 46(3):422-426.
[40] Feng Y L.Ruminant Nutrition[M].Beijing:Science Press, 2004:2-10.
[41] Williams A G, Joblin K N, Fonty G.Interactions between the Rumen Chytrid Fungi and other Microorganisms[M].New York:Marcel Dekker, 1995.
参考文献:
[1] 刁其玉, 杨茁萌, 陈荆芬, 等.草颗粒饲料在牛瘤胃内的降解与饲养价值.草业科学, 2001, 18(6):43-47.
[2] 高健, 丁洛阳, 陈连民.颗粒饲料对不同品种生长期牛育肥效果的比较研究.家畜生态学报, 2013, 34 (5):71-74.
[3] 陈亮, 张凌青, 洪龙.饲喂柠条颗粒饲料营养成分分析及对肉牛育肥效果试验.黑龙江畜牧兽医, 2014, 11:95-98.
[6] 赖景涛, 李宁, 马松成, 等.精粗配合颗粒饲料对奶牛纤维性物质和蛋白质表观消化率的影响.中国畜牧杂志, 2007, 13(1):35-36.
[10] 禹爱兵, 庄涛, 张建刚.不同cNFC/cNDF日粮在断奶犊牛瘤胃内的降解规律及对瘤胃发酵参数的影响.中国饲料, 2012, (14):22-26.
[24] 鲁琳, 夏兆刚, 孟庆翔.精料与稀释率对瘤胃发酵与微生物蛋白的影响.饲料研究, 2007, 4:52-55.
[33] 汪水平, 王文娟, 王加启, 等.日粮精粗比对奶牛瘤胃发酵及泌乳性能的影响.西北农林科技大学学报, 2007, 35(6):44-50.
[39] 孙云章, 毛胜勇, 姚文, 等.不同精粗比底物下瘤胃真菌和纤维降解细菌共培养发酵特性及菌群变化.微生物学报, 2006, 46(3):422-426.
[40] 冯仰廉.反刍动物营养学[M].北京:科学出版社, 2004:2-10.
Effects of diet pellets with different concentrate-roughage ratios on rumen fermentation parameters and microorganism abundance in weaned bull calves
YANG Hong-Bo, LIU Hong, ZHAN Jin-Shun, LIN Miao, ZHAO Guo-Qi*
CollegeofAnimalScienceandTechnology,YangzhouUniversity,Yangzhou225009,China
This study was conducted to investigate the effects of diet pellets with different concentrate-roughage ratios on rumen microbial protein synthesis, fermentation and microorganism abundance in weaned bull calves.A total of 12 healthy, weaned Holstein bull calves (age=103.92±1.5 d; weight=121.25±4.12 kg) were randomly assigned to 4 groups (Ⅰ, Ⅱ, Ⅲ and Ⅳ), with 3 calves in each group.The treatment diets were complete-diet pellets with four concentrate-roughage ratios (75∶25, Ⅰ; 70∶30, Ⅱ; 65∶35, Ⅲ; 60∶40, Ⅳ).The experiment ran for 70 days in total, including 14 d for adaptation and 56 d for the trial itself.Rumen microbial protein synthesis, fermentation and microbial abundance were measured.The results showed that total volatile fatty acids (VFA) and acetate concentration in group Ⅳ were the lowest, and were significantly lower than those in groupⅠ(P<0.05).The butyrate level of group Ⅳ was significantly higher than groupsⅠand Ⅲ (P<0.05).Group Ⅲ had the highest A∶P, which was significantly greater than group Ⅳ(P<0.05).The relative abundance ofRuminococcusalbus,Butyrivibriofibrisolvensand general fungi in group Ⅳ was significantly higher than the other three groups (P<0.05).Ruminococcusflavefaciensabundance was the highest in group Ⅲ when compared with the other groups (P<0.05).The results indicate that rumen total VFA and acetate concentration can be increased in high-concentrate groups, while it will inhibit growth of the fibre-adherent rumen bacteria and anaerobic fungi.
pellet feed; microbial protein; fermentation; microorganism; calves
10.11686/cyxb2015022
http://cyxb.lzu.edu.cn
2015-01-13;改回日期:2015-03-30
江苏省科技支撑项目(BE2013387)和江苏省高校优势学科建设工程项目资助。
杨宏波(1988-),男,内蒙古包头人,硕士。E-mail:yanghongbo333@outlook.com
*通信作者Corresponding author.E-mail:jszhaoguoqi@sohu.com
杨宏波, 刘红, 占今舜, 林淼, 赵国琦.不同精粗比颗粒饲料对断奶公犊牛瘤胃发酵参数和微生物的影响.草业学报, 2015, 24(12):131-138.
YANG Hong-Bo, LIU Hong, ZHAN Jin-Shun, LIN Miao, ZHAO Guo-Qi.Effects of diet pellets with different concentrate-roughage ratios on rumen fermentation parameters and microorganism abundance in weaned bull calves.Acta Prataculturae Sinica, 2015, 24(12):131-138.

