复合酵母培养物对奶牛产奶性能、氮排放及血液生化指标的影响
王玲,吕永艳,程志伟,杜高唐,李金林,付石军,孙国强*
(1.青岛农业大学动物科技学院,山东 青岛 266109;2.山东滨州市滨城区畜牧兽医局,山东 滨州256620;3.山东滨州市畜牧兽医局,山东 滨州256618;4.山东滨州畜牧兽医研究院,山东 滨州256618)
复合酵母培养物对奶牛产奶性能、氮排放及血液生化指标的影响
王玲1,吕永艳1,程志伟2,杜高唐3,李金林4,付石军4,孙国强1*
(1.青岛农业大学动物科技学院,山东 青岛 266109;2.山东滨州市滨城区畜牧兽医局,山东 滨州256620;3.山东滨州市畜牧兽医局,山东 滨州256618;4.山东滨州畜牧兽医研究院,山东 滨州256618)
为研究饲料中添加复合酵母培养物对奶牛产奶性能、氮排放及血液生化指标的影响,选取年龄、体重、产奶量及泌乳期相近(135±15) d的荷斯坦奶牛24头,随机分为4组,每个处理6个重复,对照组和3个试验组的复合酵母培养物添加量分别为精料浓度的0,0.8%,1.0%,1.2%,随精料饲喂,测定产奶量、乳成分、氮排放及血液生化指标,结果表明,1)试验2组日均产奶量显著高于对照组(P<0.05),各试验组分别比对照组提高8.48%,10.05%,8.97%。2)复合酵母培养物能显著提高乳脂和乳蛋白率(P<0.05),显著降低牛奶体细胞数(P<0.05),以试验2组最低。3)在氮排放量上,试验2组显著低于对照组(P<0.05),各试验组比对照组分别降低8.47%,12.01%,9.36%。4)在血液生化指标方面,复合酵母培养物能提高血清中总蛋白、球蛋白、血糖、胰岛素水平(P<0.05),降低尿素氮水平(P<0.05)。由此可见,本试验条件下,综合考虑产奶量、乳成分、氮排放及血液生化指标,复合酵母培养物的最佳添加量为精料浓度的1.0%。
复合酵母培养物;产奶性能;氮排放;血液生化指标
复合酵母培养物是经严格控制条件发酵后连同培养基一起加工制得的产品,其主要由假丝酵母菌、酿酒酵母菌的代谢产物组成,同时还含有少量枯草芽孢杆菌、乳酸菌的代谢产物。那日苏等[1]研究发现育肥绵羊日饲喂10 g/(只·d)酵母培养物日增重提高11.1%,饲喂5 h后pH比饲喂前降低0.23%,氨氮浓度降低25.10%,复合酵母培养物能改善瘤胃内环境指标。宋丽华等[2]饲喂150 g/(头·d)酵母培养物后发现产奶量平均每天增加0.88 kg/头,乳脂率提高0.23%,乳蛋白率提高0.37%,乳糖降低0.11%,体细胞数降低45.8%,乳品质得到显著提高。然而,龚月生等[3]对国内外大量关于酵母培养物的研究进行总结后得出酵母培养物对采食量的影响范围为-4.4%~27.3%,乳产量为-7.3%~17.5%,乳脂率为5.77%~33.46%,由此可以看出,对采食量、产奶量、乳品质的影响不尽相同,且酵母培养物的最佳饲喂量差异也较大。近年来,我国学者们通过调整饲粮结构、添加瘤胃调控剂等方法在提高奶牛生产性能和免疫功能方面取得了一定的效果[4-7],促进了奶牛养殖业的快速发展。随着奶牛养殖规模的扩大,饲料的需求量日益增长,每年大豆进口数量不断激增,我国已经成为世界上主要的大豆进口国家,蛋白饲料资源紧缺和蛋白饲料利用率偏低已经成为制约奶牛业进一步发展的关键因素。通过营养调控手段提高蛋白饲料的利用率,不仅能节约蛋白饲料资源,同时对降低环境污染和减少奶牛饲养成本具有重要的意义。由于酵母培养物具有提高瘤胃微生物活性和提高瘤胃内氨氮利用率的作用,目前酵母培养物在奶牛上的研究主要集中在提高泌乳初期奶牛的产奶量上,且市场上使用的酵母培养物多为单一酵母菌种制成,而关于两个酵母菌种与少量枯草芽孢杆菌、乳酸菌共同制成复合酵母培养物的应用效果鲜有研究,同样,奶牛饲粮中添加复合酵母培养物对蛋白饲料利用率、氮排放、血液生化指标的影响情况以及复合酵母培养物在泌乳中期奶牛饲粮中适宜添加水平的研究也鲜有报道。本试验拟通过在泌乳中期奶牛饲粮中添加不同水平复合酵母培养物,探讨复合酵母培养物对奶牛主要养分采食量、日均产奶量、乳成分、氮排放及血液生化指标的影响,以期在提高奶牛产奶性能的同时节省蛋白质饲料资源和降低奶牛氮排放,同时确定复合酵母培养物在泌乳中期奶牛饲粮中的适宜添加水平。为实现奶牛业的健康可持续发展提供技术参考。
1 材料与方法
1.1试验设计
本试验采用单因素随机区组设计,于2014年10月-2014年12月在青岛某奶牛原种场进行。选用体况良好、日均产奶量、胎次(2.55±1.24)、体重和泌乳期相近(135±15) d的荷斯坦奶牛24头,随机分为4组,每组6个重复。对照组和3个试验组的复合酵母培养物添加量分别为精料浓度的0,0.8%,1.0%,1.2%,采用逐级混匀的方法将复合酵母培养物与精料混匀,即先与复合酵母培养物等重量的精料混合均匀,将此混合物再与等重量的精料混匀,依此进行直到最后,将与复合酵母培养物混匀的精料分为3份,每次取其中1份与粗饲料混匀制成全混合日粮(total mixed ration,TMR)饲喂奶牛。整个试验期为70 d,其中预试期14 d,正试期56 d。 试验中所用复合酵母培养物购自深圳某公司,其主要由假丝酵母菌、酿酒酵母菌的代谢产物组成,同时还含有少量枯草芽孢杆菌、乳酸菌的代谢产物。
1.2饲养管理
试验牛采用舍饲饲养,采用利拉伐挤奶设备日挤奶2次(3:30,15:00),日饲喂TMR饲粮3次(4:00,11:00,16:00),每次采食均用颈夹将其固定。奶牛采食后在运动场自由运动和饮水,常规光照、驱虫和管理。TMR组成及其营养水平见表1。其中精料补充料购自潍坊某公司。
1.3样品采集及处理
1.3.1饲料样 预试期每隔2 d逐次称每头牛的TMR投料量和剩料量,正式期每隔10 d逐个称1次每头牛的TMR投料量和剩料量,参照张丽英[8]主编的《饲料分析及饲料质量检测技术》中的四分法收集TMR料样和剩料样,65℃烘箱中烘干,制成风干样,用于后续营养成分分析。
1.3.2粪样 于预试期开始当天,正试期第28天、正试期结束时采集3次粪样,采用全收粪法,连续3 d进行24 h全收粪,混合每天所收集的粪样,称重留样,按每100 g 粪样加10%硫酸25 mL 进行固氮处理后,放入冰箱-20℃冷冻保存,采样期的最后1 d按每天收集到的粪样比例混合3 d经固氮处理后的粪样,放入烘箱中65℃烘干,制成风干样。

表1 TMR料组成和营养水平(干物质基础)Table 1 Composition and nutrient levels of the diets TMR (DM basis)
1)产奶净能为计算值,其他指标为实测值。NEL was a calculated value and others were measured values.
1.3.3奶样 预试期开始,正试期每隔15 d采样1次,均按早、晚产奶量的比例共收集65 mL乳样,其中50 mL乳样加入重铬酸钾防腐剂(0.6 mg/mL)混合均匀,4℃冷藏用于乳成分检测。剩余15 mL经3000 r/min离心10 min,取4 mL离心乳样,加入等体积的三氯乙酸(TCA)(25%),静置5 min后于4500 r/min下离心20 min去蛋白,取1.5 mL处理好的奶样-20℃冷冻用于乳中尿素氮指标测定。
1.3.4尿样 预试期开始,正试期第28天,正试期结束时采样,采用点收尿法,采取人工接尿结合膀胱取尿的方式,即每次采样时,将牛用颈夹固定后,把导尿管插到膀胱里采取膀胱取尿的方式依次采集每头牛的尿样,若采集过程中牛出现自主排尿的姿势,有专人负责接尿,连续收集3 d,每天收集2次,每隔12 h收集1次,每天在前1 d的基础上延后4 h收集,浓 H2SO4调整尿液pH为2~3,-20℃保存。
1.3.5血样 于预试期开始当天,正试期第28天,正试期结束当天,晨饲前颈静脉采血20 mL/头,于3500 r/min离心15 min,取上层血清,-20℃冷冻保存。
1.4测定指标与方法
1.4.1采食量 预试期每隔2 d逐次称每头牛的TMR投料量和剩料量,并取样测定TMR料样和剩料样的DM含量,正试期每隔10 d逐个称1次每头牛的TMR投料量和剩料量,并取样测定TMR料样和剩料样的DM含量,根据TMR投料量、剩料量及其DM含量计算每头牛的DM采食量,每次根据上次测定的采食量调整下一阶段的TMR投料量。
1.4.2产奶量及奶成分 产奶量用利拉伐鱼骨式挤奶机测定,电子显示奶量。预试期、正试期每隔5 d记录1次奶量,每次连记2 d,以其平均值作为该阶段日均产奶量。
乳成分采用乳成分自动分析仪(CombiFoss FT+)测定乳蛋白、乳脂率、乳糖及乳中体细胞数等指标,采用加权平均法计算正试期乳成分含量。
1.4.3料样及氮代谢指标 参照张丽英[8]主编的《饲料分析及饲料质量检测技术》中的方法测定饲粮中干物质(dry matter,DM)、粗蛋白(crude protein,CP)、中性洗涤纤维(neutral detergent fiber,NDF)、酸性洗涤纤维(acid detergent fiber,ADF)、钙(calcium,Ca)、磷(phosphorus,P)的含量及粪样中CP含量,其中CP测定采用凯氏定氮法[8]、NDF和ADF采用Van Soest 洗涤纤维法[8]、Ca采用高锰酸钾滴定法[8]、P采用钒钼酸氨比色法[8]。
尿中总氮采用凯氏定氮法分析;尿素氮采用脲酶法、尿肌酐采用苦味酸比色法(试剂盒均购自南京建成生物有限公司)。参照 Valadares等[9]的方法,以尿液中尿肌酐含量计算奶牛的日排尿量。日排尿量计算公式:
Y=BW×29÷X
式中,Y为奶牛日排尿量(L);BW为奶牛体重(kg);X为奶牛尿液中尿肌酐含量(mg)。氮代谢计算公式:
粪氮=日排粪量×粪中CP含量×0.16 乳氮=产奶量×乳蛋白率×0.16
可消化氮=饲粮食入氮-粪氮
氮排放量=粪氮+尿氮
氮表观消化率(%)=(饲粮食入氮-粪氮)/饲粮食入氮×100
1.4.4血液生化指标 用ELISA试剂盒和科研试剂盒检测血清中血糖、总蛋白、白蛋白、谷丙转氨酶等含量,所用试剂盒均购自南京建成生物有限公司。
1.5数据处理与分析
用Excel 2010软件进行数据的基本处理。采用SPSS 17.0软件进行单因素方差分析,Turkey多重比较进行组间差异显著性检验,以P<0.05表示差异显著,结果以平均值±标准误表示。
2 结果与分析
2.1复合酵母培养物添加水平对奶牛主要养分采食量的影响
由表2可知,复合酵母培养物能提高135~205 d奶牛的干物质采食量,试验2组干物质采食量显著高于对照组(P<0.05),各试验组间差异不显著(P>0.05),试验1组、3组与对照组差异不显著(P>0.05);粗蛋白、中性洗涤纤维的采食量有提高的趋势(P>0.05),对酸性洗涤纤维、钙、磷的采食量影响较小(P>0.05)。

表2 不同水平复合酵母培养物对主要养分采食量的影响Table 2 Effects of different levels of compound yeast cultures on main nutrient intake
注:同行不同小写字母表示差异显著(P<0.05),下同。
Note:In the same row, values with different small letters mean significant differences (P<0.05), the same below.
2.2复合酵母培养物添加水平对奶牛日均产奶量和乳成分的影响
由表3可知,试验1组、2组、3组日均产奶量均显著高于对照组(P<0.05),各试验组间差异不显著(P>0.05),各试验组日均产奶量分别比对照组提高8.48%,10.05%,8.97%。在乳脂率方面,试验2组显著高于对照组(P<0.05),各试验组间差异不显著(P>0.05),试验1组、3组与对照组差异不显著(P>0.05);试验2组乳蛋白率显著高于对照组(P<0.05),各试验组间差异不显著(P>0.05),试验1组、3组与对照组差异不显著(P>0.05);试验2组乳体细胞数显著低于对照组(P<0.05),各试验组间差异不显著(P>0.05),试验1组、3组与对照组差异不显著(P>0.05);饲粮中添加复合酵母培养物对乳糖无影响(P>0.05)。

表3 不同水平复合酵母培养物对日均产奶量和乳成分的影响Table 3 Effects of different levels of compound yeast cultures on daily milk yield and milk composition
2.3复合酵母培养物添加水平对奶牛氮素表观消化率和氮排放的影响
饲粮中添加复合酵母培养物对各组氮排放的影响见表4。试验1组、2组、3组粪氮排放量显著低于对照组(P<0.05),各试验组间差异不显著(P>0.05);试验1组、2组、3组尿氮排放量显著低于对照组(P<0.05),各试验组间差异不显著(P>0.05);各试验组乳氮排放量均显著高于对照组(P<0.05),各试验组间无显著差异(P>0.05);试验2组乳尿素氮含量显著低于对照组(P<0.05),各试验组间差异不显著(P>0.05),试验1组、3组与对照组间也无显著差异(P>0.05);试验1组、2组、3组可消化氮水平显著高于对照组(P<0.05),各试验组间差异不显著(P>0.05);各试验组氮的表观消化率显著高于对照组(P<0.05),各试验组间差异不显著(P>0.05);各试验组总氮排放量分别比对照组降低8.47%,12.01%,9.36%,各试验组均显著高于对照组(P<0.05),其中试验2组显著低于试验1组(P<0.05),试验3组与试验2组间差异不显著(P>0.05),试验1组与试验3组间差异不显著(P>0.05)。

表4 不同水平复合酵母培养物对氮素表观消化率和氮排放的影响Table 4 Effects of different levels of compound yeast cultures on apparent digestibility and excretion of nitrogen
2.4复合酵母培养物添加水平对奶牛血液生化指标的影响
由表5可以看到,试验2组血清中血糖含量显著高于对照组(P<0.05),各试验组间差异不显著(P>0.05),试验1组、3组与对照组无显著差异(P>0.05);试验2组血清中总蛋白含量显著高于对照组(P<0.05),各试验组间差异不显著(P>0.05),试验1组、3组与对照组无显著差异(P>0.05);试验2组血清中球蛋白含量显著高于对照组(P<0.05),各试验组间差异不显著(P>0.05),试验1组、3组与对照组无显著差异(P>0.05);试验2组血清中尿素氮含量显著低于对照组(P<0.05),各试验组间差异不显著(P>0.05),试验1组、3组与对照组无显著差异(P>0.05);试验2组血清中胰岛素含量显著高于对照组(P<0.05),各试验组间差异不显著(P>0.05),试验1组、3组与对照组无显著差异(P>0.05);饲粮中加入复合酵母培养物对血清中白蛋白含量、谷丙转氨酶、肌酐酸、生长激素含量无显著影响(P>0.05)。
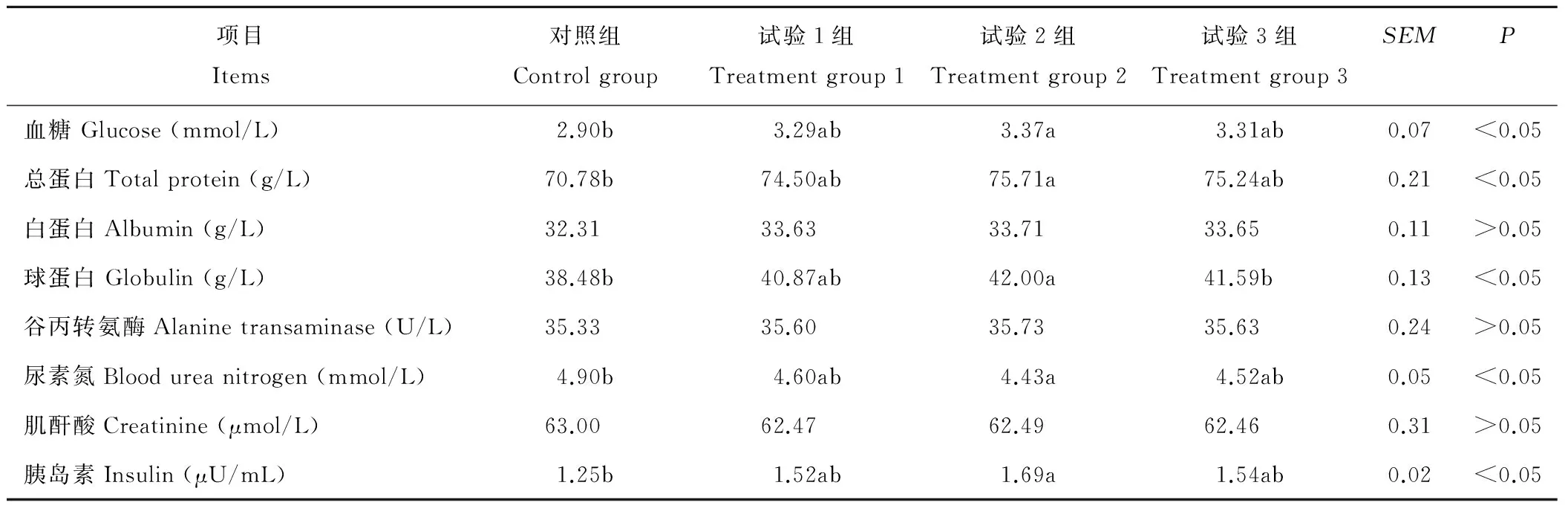
表5 不同水平复合酵母培养物对血液生化指标的影响Table 5 Effects of different levels of compound yeast cultures on blood biochemical parameters
3 讨论
3.1复合酵母培养物添加水平对奶牛主要养分采食量的影响
提高饲粮主要养分采食量对维持中后期奶牛的生产性能具有重要的意义,复合酵母培养物在制作过程中含有一定的酿酒酵母,该酵母在发酵的过程中能产生奶牛所喜欢的芳香气味。在本试验中,补饲复合酵母培养物后奶牛的干物质和主要养分采食量都得到一定提高,当复合酵母培养物添加量为精料浓度的1%时养分采食量最高,与Kim等[10]和刘强等[11]得出的结论一致。分析原因为与补饲复合酵母培养物后瘤胃内纤维分解菌活性提高[1]有关,纤维物质分解速度加快,奶牛的胃肠道排空速度较对照组更快,奶牛饱腹感减弱,导致DMI增加;另一方面,复合酵母培养物也能促进有益菌群在瘤胃内的生长繁殖,加快饲粮中养分的消化利用,并且还会合成B族维生素、氨基酸以及促生长因子等营养物质[12],从而增加动物体对养分的消化吸收,也能够使试验组DMI增加。
3.2复合酵母培养物添加水平对奶牛日均产奶量和乳成分的影响
生产性能是决定奶牛养殖效益的主要因素,因此,采取一定的营养调控措施,延缓中期奶牛产奶量下降幅度,提高产奶性能仍是当前奶牛生产研究的热点。刘国娟等[13]用两种复合酵母菌制成的复合酵母培养物饲喂奶牛发现产奶量得到极显著提高,与本试验结果一致。分析原因可能为复合酵母培养物自身含有的有机酸、酶类、生物活性小肽、氨基酸、未知生长因子等大量的营养物质有利于奶牛对各种养分的消化、吸收利用[14],养分采食量和利用率的提高会给泌乳活动提供充足的营养物质;同时,与对照组相比复合酵母培养物中含有的大量有益菌群能够抑制有害微生物的生长繁殖,促进有益菌群的形成,通过对瘤胃微生物自身的调控,提高了进入小肠中的营养物质浓度;有研究表明[15],在泌乳牛饲粮中添加小肽可以极显著提高奶牛的日均产奶量,因此,复合酵母培养物中的生物活性小肽和氨基酸等成分对产奶量的提高也起到一定的作用;瘤胃微生物蛋白(rumen microbial protein,MCP)合成量的提高能为泌乳活动提供更多的可消化氮源,瘤胃内短链脂肪酸浓度的增加以及各种乳成分合成前体物质的增加;复合酵母培养物中的β-葡聚糖和甘露聚糖能增强机体的免疫功能,降低乳房炎疾病的发病率,提高乳房健康程度,利于充分发挥奶牛的泌乳性能,也利于泌乳量的提高。
乳脂率、乳蛋白率及乳中体细胞数对原料奶品质的好坏起到关键作用,是衡量奶品质的重要指标,也影响着原料奶的收购价格。Lesmeister等[16]研究发现酵母培养物可以很好地改善牛乳的乳成分;吴小燕等[17]用微生物发酵饲料饲喂奶牛发现,乳成分得到显著改善,乳蛋白、乳脂肪、乳糖含量分别比对照组高出3.11%,6.71%,2.92%;王晓宏等[18]用复合酵母培养物饲喂奶牛得出乳体细胞数显著降低,对乳脂、乳氮、乳糖均无显著影响;张连忠[19]用120 g/(d·头)的酵母培养物饲喂泌乳中期奶牛42 d后发现产奶量提高12.8%,乳蛋白率、乳糖率、乳非脂固形物率、乳密度分别极显著提高8.2%,6.8%,7.9%,11.7%。复合酵母培养物对乳品质的影响结果间差异较大,在本试验中,饲粮中加入复合酵母培养物后,乳脂和乳蛋白得到显著提高、对乳糖率的影响较小。王典等[20]在研究中发现,不同的酵母菌种对乳成分和产奶量有不同程度的影响;Williams等[21]指出酵母培养物对产奶量和乳成分的改善程度,随着饲粮的精粗比增加而增加,特别是易发酵碳水化合物含量的提高改善效果更明显;Hoyos等[22]发现,添加酵母培养物对高产奶牛的作用效果比低产奶牛更加明显。因此,饲喂效果的差异性可能是由于饲粮组成、泌乳期、复合菌种的组成不同、饲喂时间的长短及外界环境因素的不同造成的。采食量的提高能为乳成分的合成提供更多的营养物质,有利于乳成分改善;瘤胃内氨氮的平衡和瘤胃微生物利用氨氮能力的提高能合成更多的MCP,有利于乳蛋白的提高;瘤胃内乳酸利用菌活性的增强可以更好地维持瘤胃pH,纤维分解菌活动的增强能分解产生大量挥发性脂肪酸(volatile fatty acids,VFA),而乙酸是合成乳脂的前体物质,大量乙酸的产生会促进乳脂的合成,丙酸可分解产生葡萄糖,用于乳糖的合成,丙酸的大量产生有益于乳糖的稳定。
乳中体细胞数可以反映乳房的健康程度和乳房炎的发病率,在本试验中,饲喂复合酵母培养物后乳体细胞数显著下降,表明复合酵母培养物可以提高奶牛乳房健康程度。复合酵母培养物中含有的酵母β-葡聚糖是一种免疫促进剂,能提高牛体的非特异性免疫、改善消化道的菌群结构,可以作为真菌毒素的吸附剂与玉米赤霉烯酮和黄曲霉毒素结合[23],甘露糖的主要成分是细胞壁多糖,其免疫功能较强,能吸附部分外源性毒素和病原菌[24]。两种免疫活性多糖相互作用,能激活牛体免疫系统、提高牛体的免疫能力[25],因此,饲喂复合酵母培养物后有利于减少乳房炎的发病率,进而减少乳中体细胞数。
3.3复合酵母培养物添加水平对奶牛氮排放的影响
在本试验中,饲粮中加入复合酵母培养物后,粪氮和尿氮的排泄量显著降低,乳氮排放增加,氮总排泄减少,氮的利用率提高,减少了氮素对环境的污染。瘤胃内氨氮的浓度和微生物蛋白(MCP)的产量共同反映了瘤胃微生物降解产生氨氮的速度和微生物利用氨氮的能力,当氨氮浓度较低时,会减少MCP的产生,影响奶牛的生产性能;当奶牛瘤胃微生物降解氮源释放氨态氮的速率超过微生物利用氨态氮合成自身蛋白质的速率时会增加瘤胃氮循环中氮素的损失,也会减少MCP产量,过多的氨氮最终被排放到环境中,不仅导致氮素利用率降低,还会带来环境污染问题,因此氨态氮的生成和利用相对平衡是提高氮素利用率,降低氮排放的重要措施。一方面,复合酵母培养物促进瘤胃微生物的生长繁殖,提高瘤胃微生物对氨态氮利用速度和能力,使更多的氨态氮转化为MCP,减少瘤胃内氨氮的损失;纤维利用菌活力的增强能分解纤维提供更多的能量,让瘤胃内能氮更加平衡,也有利于瘤胃微生物利用氨态氮合成更多的MCP;复合酵母培养物中丰富的营养活性物质能增加瘤胃内的有益菌群的活动,更好地维持稳定的瘤胃pH和厌氧环境,利于提高饲粮中粗蛋白的表观消化率,减少氮损失;MCP合成的提高,有利于产奶性能的提高和乳脂率的增加,进而使更多的饲料蛋白被转化利用到动物产品中,也有利于减少氮的排泄量;由于该复合酵母培养物产品是由多种酵母菌发酵制成,其中假丝酵母等的蛋白质含量较高,而酿酒酵母等发酵能够产生芬芳的醇香,酿酒酵母等能够利用硫酸铵为氮源,而假丝酵母等能以尿素和硝酸盐为氮源,同单一菌种发酵的复合酵母培养物产品相比,该复合酵母利用的底物更为广泛,产生代谢产物更为丰富,从而能更好地平衡氨态氮的生成和利用速度,降低氮排放量。因此MCP产量的提高、瘤胃微生物生长繁殖的加快等,都有利于提高饲粮中粗蛋白的消化率、吸收率和利用率,减少氮排放量,从而减少氮素对环境带来的污染。
3.4复合酵母培养物添加水平对奶牛血液生化指标的影响
血清总蛋白(TP)、白蛋白(ALB)、尿素氮(BUN)、肌酐酸(CRE)共同反映了机体对蛋白质的吸收、合成、分解情况[26]。血清ALB作为营养物质的载体还具有维持血浆渗透压的作用,奶牛的ALB正常范围在29.0~36.6 g/L[27],若其浓度长期较低则意味着蛋白质缺乏;血清球蛋白(GLOB)是一种免疫活性蛋白,能反映动物机体免疫机能;机体摄入的过量而未被利用的蛋白则最终代谢为BUN由肾脏排出体外;CRE反映了肝脏中氮素循环情况,还反映着机体蛋白分解的情况。在本试验中,添加复合酵母培养物后各试验组ALB无显著差异,且都在正常范围内,GLOB明显升高,BUN浓度降低,CRE浓度无显著差异,但较对照组有所降低,说明试验牛蛋白营养水平良好,消化利用情况较好,瘤胃内氨氮损失降低,奶牛动用自身的机体蛋白减少,氮沉积有所增加,有利于体况的恢复。这可能与复合酵母培养物能提高瘤胃微生物,利用氨氮合成微生物蛋白的速度和能力有关,饲料中含氮物质在瘤胃内降解、氨的释放速度与瘤胃微生物利用氨氮合成菌体蛋白的速度相对一致,瘤胃内氨氮相对稳定,从而减少了氨氮的损失,蛋白饲料利用率相对提高。奶牛血糖(GLU)的正常浓度水平为(3.10±0.47) mmol/L[28],其主要来源是体内生糖物质的转化,瘤胃微生物分解碳水化合物产生的丙酸是奶牛GLU的最大来源,其浓度主要受胰岛素(INS)调节。本试验中试验组血糖水平明显升高,但都在正常范围内,血清INS水平明显升高。GLU水平的升高表明奶牛日粮中能量供应较为充足,而INS的升高说明机体能量代谢加快,GLU是乳糖的唯一前提物质,因此GLU和INS浓度的升高有利于提高奶牛的产奶量。谷丙转氨酶(ALT)是广泛存在于动物细胞中的重要氨基转移酶,其浓度过高或过低都可以反映肝脏和心脏有损伤[29]。在本试验中ALT浓度无明显变化,表明复合酵母培养物不会损伤肝脏和心脏,且ALT有升高的趋势,表明复合酵母培养物能促进氨基酸代谢和蛋白质、脂肪及糖的转化。
4 结论
综合考虑奶牛产奶量、乳成分、氮排放及血液生化指标,在本试验条件下,复合酵母培养物的最佳添加量为精料浓度的1%。
[1] Na R S, Gui R, Ao C J,etal.Effects of yeast culture on rumen fermentation and production performance of sheep.Chinese Animal Husbandry and Veterinary Medicine, 2004, 31(1):6-9.
[2] Song L H, Liu D C, Zhou Z F.Effect of yeast activity on milk yield and milk composition.Chinese Animal Husbandry and Veterinary Medicine, 2006, 33(5):14-15.
[3] Gong Y S, Ren Z L, Liu H B,etal.Effect of yeast culture on ruminant performance.Journal of Yellow Cattle Science, 2002, 28(5):30-33.
[4] Sun G Q, Lv Y Y, Zhang J J.A study on the associative effect of whole corn silage-peanut vine andLeymuschinensisby rumen fermentationinvitro.Acta Prataculturae Sinica, 2014, 23(3):224-231.
[5] Li Q F, Li C F, Cao Y F,etal.Influence of different nutrition levels on the digestion metabolism and beef quality of Holstein culling cows.Acta Prataculturae Sinica, 2014, 23(6):126-135.
[6] Zhan J S, Wu L Z, Li L L,etal.Effect of metallothionein on lymphocyte apoptosis of the dairy cow culturedinvitrounder heat stress.Acta Prataculturae Sinica, 2014, 23(3):215-223.
[7] Wang Y, Yuan X J, Guo G,etal.Fermentation and aerobic stability of mixed ration forages in Tibet.Acta Prataculturae Sinica, 2014, 23(6):95-102.
[8] Zhang L Y.Feed Analysis and Quality Inspection Technology[M].Beijing:Beijing Kasetsart University Press, 2002.
[9] Valadares R F D, Broderick G A, Valadares F S C,etal.Effect of replacing alfalfa silage with high moisture corn on ruminal protein synthesis estimated from excretion of total purine derivatives.Journal of Dairy Science, 1999, 82(12):2686-2696.
[10] Kim S H, Ahn B S, Chung S G,etal.Effect of yeast culture, fungal fermentation extract and non-ionic surfactant on performance of Holstein cows during transition period.Animal Feed Science and Technology, 2006, 126(1):23-30.
[11] Liu Q, Jiang B, Cao F C,etal.Study on the effect of probiotic yeast on performance and rumen fermentation of dairy cows.Modern Animal Husbandry, 2004, (4):28-30.
[12] Ma Y F, Fu C Q, Wang H Y,etal.Studies on the effects of probiotics on milk performance and milk quality of dairy cow.Zhejiang Agricultural Sciences,2008, (4):493-495.
[13] Liu G J, Sun G, Zhou X L,etal.Effect of compound bacteria culture on milk production and somatic cell counts of dairy cattle.Chinese Animal Husbandry and Veterinary Medicine, 2013, 40(2):214-216.
[14] Sune R W, Muhlbach P R F.Effect of yeast culture strain 1026 addition on milk yield and milk quality of holstein cows in pasture.Revista Brasileira de Zootecnia, 1998, 27(6):1248-1252.
[15] Lv Z L, Yin Z H, Xing S F,etal.Studies on the effects of probiotics on milk performance and milk quality of dairy cow.Zhejiang Agricultural Sciences, 2008, (6):209-211.
[16] Lesmeister K E, Heinrichs A J, Gabler E T.Effects of supplemental yeast (Saccharomycescerevisiae) culture on rumen development, growth characteristics, and blood parameters in neonatal dairy calves.Journal of Dairy Science, 2004, 87(6):1832-1839.
[17] Wu X Y, Guo C H, Wang Z S,etal.Microbiology fermented feed:effects on performance and nutrient apparent digestibility of lactating dairy cows.Chinese Journal of Animal Nutrition, 2014, 26(8):2296-2302.
[18] Wang X H, Liu D C,Yin Z L,etal.The composite effect of yeast culture on production performance of dairy cows.Animal Husbandry and Feed Science, 2011, 32(9-10):167-168.
[19] Zhang L Z.Effects of yeast culture on milk production and milk quality of Holstein dairy cows at Mid-lactation.Southwest China Journal of Agricultural Sciences, 2011, 24(3):1132-1135.
[20] Wang D, Wang J Q, Song L H.Effect of a supplemental yeast or yeast culture on milk production of dairy cow.Chinese Animal Husbandry and Veterinary Medicine, 2012, 39(5):82-85.
[21] Williams P E, Tait C A, Innes G M,etal.Effects of the inclusion of yeast culture (Saccharomycescerevisiaeplus growth medium) in the diet of dairy cows on milk yield and forage degradation and fermentation patterns in the rumen of steers.Journal of Dairy Science, 1991, 69(7):3016-3026.
[22] Hoyos G, Garcia L, Medina F.Effects of feeding viable microbial feed additives on performance of lactating cows in a large dairy herd.Journal of Dairy Science, 1987, 70(Suppl 1):217.
[23] Yiannikouris A, Franois J, Poughon L,etal.Influence of pH on complexing of model beta-d-glucans with zearalenone.Journal of Food Protection, 2004, 67(12):2741-2746.
[24] Castro D P, Moraes C S, Garcia E S,etal.Inhibitory effects D-mannose on trypanosomatid lysis induced bySerratiamarcescens.Experimental Parasitology, 2007, 115(2):200-204.
[25] Jawhara S, Habib K, Maggiotto F,etal.Modulation of intestinal inflammation by yeasts and cell wall extracts:strain dependence and unexpected anti-inflammatory role of glucan fractions.PLoS ONE, 2012, 7(7):e40648.
[26] Yang L L, Lv Y Y, Sun G Q.Effect of brewer’s grains on milk production and blood biochemical parameters of dairy cows.Chinese Animal Husbandry and Veterinary Medicine, 2014, 50(13):51-56.
[27] Song P.The Detection and Analysis of Dairy Cow’s Blood Biochemical Indexes Under Different Rearing Conditions[D].Harbin:Northeast Agricultural University, 2007.
[28] Lu C.Effect of Roughage Combinations on N,P Emission and Study on Farmland Carrying Capacity of Dairy Cow[D].Zhengzhou:Henan Agricultural University, 2012.
[29] Zhang J J, Zhao H B, You W,etal.Influence of dietary rapeseed levels on growth performance, rumen fermentation characteristics and blood biochemical indices in beef cattle.Scientia Agricultura Sinica, 2014, 47(11):2233-2241.
参考文献:
[1] 那日苏, 桂荣, 敖长金, 等.酵母培养物对绵羊瘤胃发酵及生产性能的影响.中国畜牧兽医, 2004, 31(1):6-9.
[2] 宋丽华, 刘大程, 周振峰.酵母活性物对奶牛产奶量及乳成分的影响.中国畜牧兽医, 2006, 33(5):14-15.
[3] 龚月生, 任转龙, 刘宏斌, 等.酵母及其培养物对反刍动物生产性能的影响.黄牛杂志, 2002, 28(5):30-33.
[4] 孙国强, 吕永艳, 张杰杰.利用体外瘤胃发酵法研究全株玉米青贮与花生蔓和羊草间的组合效应.草业学报, 2014, 23(3):224-231.
[5] 李秋凤, 李春芳, 曹玉凤, 等.不同营养水平对淘汰荷斯坦奶牛消化代谢、肉品质的影响.草业学报, 2014, 23(6):126-135.
[6] 占今舜, 吴力专, 李丽立, 等.金属硫蛋白对热应激下体外培养奶牛淋巴细胞的影响.草业学报, 2014, 23(3):215-223.
[7] 王勇, 原现军, 郭刚, 等.西藏不同饲草全混合日粮发酵品质和有氧稳定性的研究.草业学报, 2014, 23(6):95-102.
[8] 张丽英.饲料分析及饲料质量检测技术[M].北京:北京农业大学出版社, 2007.
[11] 刘强, 姜彬, 曹福存, 等.益生酵母对奶牛泌乳性能及瘤胃发酵影响的研究.当代畜牧, 2004, (4):28-30.
[12] 麻延峰, 傅春泉, 王宏艳, 等.益生素对奶牛泌乳性能及乳品质影响的研究.浙江农业科学, 2008, (4):493-495.
[13] 刘国娟, 孙鸽, 周向丽, 等.复合菌培养物对奶牛产奶性能及体细胞数的影响.中国畜牧兽医, 2013, 40(2):214-216.
[15] 吕贞龙, 尹召华, 邢淑芳, 等.小肽营养素对奶牛泌乳性能的影响.江苏农业科学, 2008, (6):209-211.
[17] 吴小燕, 郭春华, 王之盛, 等.微生物发酵饲料对泌乳奶牛生产性能和饲粮养分表观消化率的影响.动物营养学报, 2014, 26(8):2296-2302.
[18] 王晓宏, 刘大程, 殷兆丽, 等.复合酵母培养物对奶牛生产性能的影响.畜牧与饲料科学, 2011, 32(9-10):167-168.
[19] 张连忠.酵母培养物对泌乳中期荷斯坦奶牛产奶量及乳品质的影响.西南农业学报, 2011, 24(3):1132-1135.
[20] 王典, 王加启, 宋丽华.日粮中添加酵母或酵母培养物对奶牛生产性能的影响.中国畜牧兽医, 2012, 39(5):82-85.
[26] 杨璐玲, 吕永艳, 孙国强.啤酒糟对奶牛产能性能及血液生化指标的影响.中国畜牧杂志, 2014, 50(13):51-56.
[27] 宋平.不同饲养方式下奶牛血液生化指标测定与分析[D].哈尔滨:东北农业大学, 2007.
[28] 吕超.粗饲料组合对奶牛氮磷排放的影响及农田承载力研究[D].郑州:河南农业大学, 2012.
[29] 张杰杰, 赵红波, 游伟, 等.饲粮油菜籽水平对肉牛生长性能、瘤胃发酵及血液生化指标的影响.中国农业科学, 2014, 47(11):2233-2241.
Milk production,nitrogen excretion and blood biochemical parameter responses to dietary addition of compound yeast cultures in dairy cows
WANG Ling1, LV Yong-Yan1, CHENG Zhi-Wei2, DU Gao-Tang3, LI Jin-Lin4, FU Shi-Jun4, SUN Guo-Qiang1*
1.CollegeofAnimalScienceandTechnology,QingdaoAgriculturalUniversity,Qingdao266109,China; 2.AnimalHusbandryandVeterinaryBureauofBinzhouCityinShandongBinzhou,Binzhou256620,China; 3.AnimalHusbandryandVeterinaryBureauofShandongBinzhou,Binzhou256618,China; 4.InstituteofAnimalHusbandryandVeterinaryMedicineofShandongBinzhou,Binzhou256618,China
This experiment was conducted to determine the effects of compound yeast cultures on the milk production, nitrogen excretion and blood biochemical parameters of dairy cows.A total of 24 Holstein lactating cows with similar parity, weight, milk yield and lactation stage (135±15 day in milk) were equally assigned to four groups, including one control group and 3 treatment groups, with dietary supplementation of compound yeast cultures at concentrations of 0, 0.8%, 1.0% and 1.2%, respectively.Milk yield, milk composition, nitrogen excretion and blood biochemical parameters of each cow were recorded.The results showed:1) The cows in the respective treatment groups had 8.48%, 10.05%, 8.97% higher daily milk yield than cows in the control group (P<0.05).2) Compound yeast cultures significantly increased milk fat and protein concentration (P<0.05), and reduced somatic cell counts (P<0.05), with treatment group 2 again the greatest response.3) The supply of compound yeast cultures in dairy cow feed concentrate reduced nitrogen excretion by 8.47%, 12.01%, 9.36% compared to the control group (P<0.05).4) Dietary supplementation with compound yeast cultures significantly increased the levels of glucose (GLU), total protein (TP), globulin (GLOB), and insulin (INS) (P<0.05) in the serum, and reduced blood urea nitrogen (BUN) (P<0.05).Based on the data for milk yield, milk composition, nitrogen excretion and blood biochemical parameters, the optimal concentration of compound yeast cultures administered as a supplement for dairy cow diets is 1.0%.
compound yeast cultures; milk production and quality; nitrogen excretion; blood biochemical parameters
10.11686/cyxb2015124
http://cyxb.lzu.edu.cn
2015-03-10;改回日期:2015-06-29
山东省现代农业产业技术体系牛产业创新团队(SDAIT-12-011-08)资助。
王玲(1990-),女,山东淄博人,在读硕士。E-mail:xiaguang_66@163.com
*通信作者Corresponding author.E-mail:qdnydxsgq@126.com
王玲, 吕永艳, 程志伟, 杜高唐, 李金林, 付石军, 孙国强.复合酵母培养物对奶牛产奶性能、氮排放及血液生化指标的影响.草业学报, 2015, 24(12):121-130.
WANG Ling, LV Yong-Yan, CHENG Zhi-Wei, DU Gao-Tang, LI Jin-Lin, FU Shi-Jun, SUN Guo-Qiang.Milk production,nitrogen excretion and blood biochemical parameter responses to dietary addition of compound yeast cultures in dairy cows.Acta Prataculturae Sinica, 2015, 24(12):121-130.

