导管分离表皮葡萄球菌生物被膜形成能力相关研究*
邹自英,刘 媛,朱 冰,吴丽娟,胡宗海,曾 平
(成都军区总医院微生物免疫科,成都 610083)
论著·临床研究
导管分离表皮葡萄球菌生物被膜形成能力相关研究*
邹自英,刘 媛#,朱 冰,吴丽娟△,胡宗海,曾 平
(成都军区总医院微生物免疫科,成都 610083)
目的 探讨导管分离表皮葡萄球菌的生物被膜形成能力和耐受应激环境能力。方法 采用结晶紫半定量法和细菌计数法检测表皮葡萄球菌的生物被膜形成能力和应激环境耐受能力。结果 表皮葡萄球菌1457菌株和5株导管分离菌株均具有生物被膜形成能力,菌株之间生物被膜形成能力差异无统计学意义(P>0.05);导管分离菌株与1457菌株的游离细菌和被膜细菌的生长能力、对高分子材料的黏附能力、对过氧化氢的氧化应激耐受能力和对乙醇耐受能力差异无统计学意义(P>0.05)。结论 表皮葡萄球菌导管分离菌株与产生生物被膜的表皮葡萄球菌1457菌株具有相近的生物被膜形成能力和耐受应激环境能力。
葡萄球菌,表皮;氧化性应激;生物被膜
表皮葡萄球菌是典型的生物被膜菌,它可以通过黏附在一些植入医疗器械表面形成生物被膜而造成持续性感染,具有迁延不愈的特征[1-2]。表皮葡萄球菌的生物被膜不仅对抗菌药物具有非常强的抵抗能力,而且对机体免疫机制也具有非常强的适应能力,因而非常难以清除。本研究探讨导管来源表皮葡萄球菌形成生物被膜能力和耐受应激环境能力,为临床治疗由表皮葡萄球菌引起的导管相关性感染提供实验室依据,现报道如下。
1 材料与方法
1.1 材料 临床送检导管和血液培养同时检测出表皮葡萄球菌生长,导管分离株和血液培养分离株耐药表型一致的病例,选择导管分离菌株共计5株(SE1-5)。表皮葡萄球菌1457(SE1457)购自中国工业菌种保藏中心。
1.2 方法
1.2.1 菌株鉴定 采用梅里埃公司的VITEK2 COMPACT 全自动微生物分析仪和GP鉴定卡对细菌进行鉴定。
1.2.2 表皮葡萄球菌生物被膜半定量检测 参照文献[1],调节菌液浓度使光密度(OD)600=0.01,接种96孔板:200 μL/孔,每组4孔,对照组为新鲜培养基,37 ℃ 24 h,200 μL/孔PBS清洗4次。50 μL/孔 Bouin固定液固定1 h,PBS清洗4次,50 μL/孔结晶紫染色1 min。自来水清洗残余染料,室温晾干。用酶标仪读取波长570 nm的OD值。将测定组每孔测得值减去对照组平均值后即为测定组每孔最终值。
1.2.3 生物被膜细菌计数 调节菌液浓度使OD600=0.01,接种24孔平板,37 ℃ 24 h。收集上清液到一个无菌试管。0.5 mL PBS轻轻洗脱未黏附的细菌与上清液混合。再次加入0.5 mL PBS,用平头牙签刮下被膜菌,收集到另一个无菌试管。上清液和生物被膜中的细菌分别进行计数。
1.2.4 表皮葡萄球菌的黏附能力 调节菌液浓度使OD600=0.02,37 ℃培养直到OD600=1.00,200 μL/孔接种96孔平板,37 ℃ 1 h。200 μL/孔 PBS洗涤4次。50 μL/孔Bouin固定液固定1 h,再次以PBS清洗4次。50 μL/孔结晶紫染色1 min,自来水洗去残余染料,室温晾干。用酶标仪读取波长570 nm的OD值。将测定组每孔测得值减去对照组平均值后即为测定组每孔最终值。
1.2.5 氧化应激耐受实验 调节菌液浓度使OD600=0.02,37 ℃培养直到OD600=0.30。在一个无菌试管中加入1.8 mL菌液,然后加入2 mol/L的过氧化氢0.2 mL振荡混匀,室温静置15 min,涂板计数,分别计数过氧化氢处理前后的细菌数,计算存活率。
1.2.6 乙醇耐受实验 调节菌液浓度使OD600=0.02,37 ℃培养直到OD600=0.30。在一个无菌试管中加入2 mL菌液,然后加入无水乙醇353 μL振荡混匀,室温静置15 min,涂板计数,分别计数乙醇处理前后的细菌总数,计算存活率。
1.3 统计学处理 采用SPSS17.0统计软件进行单因素方差分析,以P<0.05为差异有统计学意义。
2 结果
2.1 表皮葡萄球菌的生物被膜形成能力 表皮葡萄球菌1457和5株导管分离菌株均具有生物被膜形成能力,菌株之间生物被膜形成能力差异无统计学意义(P>0.05),见图1。

SE1457:表皮葡萄球菌1457菌株;SE1~SE5:临床菌株1~5号。
图1 不同菌株的生物被膜形成能力
2.2 生物被膜细菌计数 为了比较不同菌株生物被膜形成能力差异是否是由于菌株的生长能力不同引起的,分别对检测菌株的游离细菌和被膜细菌进行计数,与1457菌株比较,游离细菌和被膜细菌的生长能力差异无统计学意义(P>0.05),见图2。

SE1457:表皮葡萄球菌1457菌株;SE1~SE5:临床菌株1~5号;Planktonic:浮游生长的细菌;Biofilm:生物被膜细菌;Total:Planktonic与Biofilm之和。
图2 生物被膜细菌计数
2.3 菌株对高分子材料的黏附能力 与1457菌株比较,临床菌株与1457菌株对高分子材料的黏附能力差异无统计学意义(P>0.05),见图3。
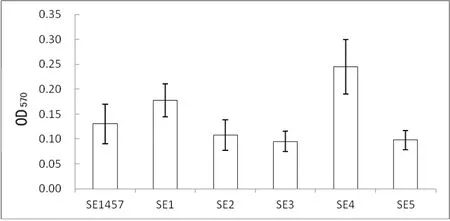
SE1457:表皮葡萄球菌1457菌株;SE1~SE5:临床菌株1~5号。
图3 菌株对高分子材料的黏附能力
2.4 菌株氧化应激耐受能力和乙醇耐受能力 临床菌株与1457菌株对过氧化氢的氧化应激耐受能力和乙醇耐受能力差异无统计学意义(P>0.05),见图4。

SE1457:表皮葡萄球菌1457菌株;SE1~SE5:临床菌株1~5号。
图4 细菌氧化应激耐受能力和乙醇耐受能力
3 讨论
1457菌株是能形成生物被膜的野生菌株,通过与1457菌株进行对比分析,可以了解临床菌株生物被膜形成能力的高低。同属葡萄球菌属,金黄色葡萄球菌可以产生多种毒素致病,而表皮葡萄球菌则主要通过在一些人工植入的医疗器械如深静脉置管、导尿管、人工瓣膜等表面形成生物被膜,成为新的感染灶,持续释放病原菌[3-4]。本研究选取的5例均为导管和血液均检测出一致耐药表型的表皮葡萄球菌病例,所选择的导管分离菌株均具有野生菌株1457的生物被膜形成能力。
表皮葡萄球菌分两个步骤形成生物被膜:(1)黏附;(2)通过增殖和合成黏性的细胞外基质,形成多层细胞结构,覆盖在植入物表面[5]。因而生物膜形成能力的差异可能由黏附能力不同或增殖能力差异造成。本结果显示,导管分离表皮葡萄球菌与1457菌株均具有对高分子材料相近的黏附能力和生长能力,其生物被膜形成机制有待进一步研究。有研究报道,多种基因分别在表皮葡萄球菌生物被膜形成的各个阶段发生作用,如atlE、sdrG、embp基因在初始黏附过程中发挥重要作用[6];而ica操纵子、aap基因则参与被膜细菌的增殖[7-9]。Agr和luxS细菌数量感应系统也参与表皮葡萄球菌生物被膜的形成调控。
渗透压、乙醇、葡萄糖等环境条件均可以影响表皮葡萄球菌的生物被膜形成,乙醇通过抑制icaR的转录从而刺激表皮葡萄球菌生物被膜形成,而ClpP蛋白酶通常参与细菌对各种应激环境的适应机制[10-12]。导管分离的5株表皮葡萄球菌与1457菌株均具有对强氧化剂过氧化氢和常用消毒剂乙醇的耐受能力,其中是否有ClpP蛋白酶的参有待进一步的研究。
生物被膜阳性的表皮葡萄球菌能在静脉插管上形成生物被膜,通过形成感染灶持续性的脱落细菌入血,侵犯机体,有必要深入研究生物被膜阳性和生物被膜阴性细菌的致病能力差异和致病机制,从而找到抑制表皮葡萄球菌生物被膜形成的可能药物靶标。
[1]Li M,Wang X,Gao Q,et al.Molecular characterization of Staphylococcus epidermidis strains isolated from a teaching hospital in Shanghai,China[J].J Med Microbiol,2009,58(5):456-461.
[2]陈颖,雷玉洁,黄云超,等.聚集相关蛋白基因与转化生长因子β1对肺癌相关生物材料表皮葡萄球菌生物膜形成的影响[J].中国肺癌杂志,2014,14(4):308-314.
[3]Pozzi C,Waters EM,Rudkin JK,et al.Methicillin resistance alters the biofilm phenotype and attenuates virulence in Staphylococcus aureus device-associated infections[J].PLoS Pathog,2012,8(4):e10026.
[4]Hu J,Xu T,Zhu T,et al.Monoclonal antibodies against accumulation-associated protein affect EPS biosynthesis and enhance bacterial accumulation of Staphylococcus epidermidis[J].PLoS One,2011,6(6):e20918.
[5]姜越,张德纯.表皮葡萄球菌生物膜形成机制及调控[J].中国微生态学杂志,2011,23(11):1056-1057.
[6]Vadyvaloo V,Otto M.Molecular genetics of Staphylococcus epidermidis biofilms on indwelling medical devices[J].Int J Artif Organs,2005,28(11):1069-1078.
[7]刘瑾,罗少锋.血培养中表皮葡萄球菌与ica、mecA基因研究[J].中华医院感染学杂志,2014,24(3):524-525.
[8]汤琦,袁兵,黄云超,等.乳腺外科表皮葡萄球菌icaA、icaD及聚集相关蛋白基因对细菌生物膜形成的影响[J].中国修复重建外科杂志,2014,28(2):244-249.
[9]龚凤云,刘丽娜,邢铭友,等.表皮葡萄球菌的耐药与生物膜的相关研究[J].中华医院感染学杂志,2011,21(1):20-23.
[10]Mack D,Davies AP,Harris LG,et al.Microbial interactions in Staphylococcus epidermidis biofilms[J].Anal Bioanal Chem,2007,387(2):399-408.
[11]Wang C,Li M,Dong D,et al.Role of clpP in biofilm formation and virulence of staphylococcus epidermidis[J].Microbes Infect,2007,9(11):1376-1383.
[12]Wang C,Fan J,Niu C,et al.Role of spx in biofilm formation of staphylococcus epidermidis[J].FEMS Immunol Med Microbiol,2010,59(2):152-160.
Biofilm forming ability of staphylococcus epidermidis strains isolated from catheters*
ZouZiying,LiuYuan#,ZhuBing,WuLijuan△,HuZonghai,ZengPing
(DepartmentofMicrobialImmune,ChengduMilitaryCommandGeneralHospital,Chengdu,Sichuan610083,China)
Objective To explore the biofilm forming ability and the ability to survive in stress environment of staphylococcus epidermidis strains isolated from catheters.Methods Semiquantitative biofilm assay and bacteria cell counting were performed to explore the biofilm forming ability and the ability to survive in stress environment of staphylococcus epidermidis strains.Results Staphylococcus epidermidis strain of 1457 and 5 clinical strains isolated from catheters had the similar ability of biofilm formation(P>0.05),similar growth ability of planktonic and biofilm cells,similar attachment ability to polystyrene,similar ability to survive in an oxidative and ethanol stress environment (P>0.05).Conclusion The biofilm forming ability and the ability to survive in stress environment of staphylococcus epidermidis strains isolated from catheters were similar to staphylococcus epidermidis 1457 strain.
staphylococcus epidermidis;oxidative stress;biofilm
10.3969/j.issn.1671-8348.2015.05.016
四川省卫生厅科研课题(130318)。 作者简介:邹自英(1977-),主治医师,主要从事细菌耐药机制研究。#共同第一作者。△
,E-mail:wulijuan1638@126.com。
R378
A
1671-8348(2015)05-0626-02
2014-09-20
2014-11-10)

