硫化氢分解制取氢和单质硫研究进展
彭仁杰,周继承,罗羽裳,胡晓宁
(湘潭大学化工学院,绿色催化与反应工程湖南省高校重点实验室,湖南 湘潭 411105)
硫化氢分解制取氢和单质硫研究进展
彭仁杰,周继承*,罗羽裳,胡晓宁
(湘潭大学化工学院,绿色催化与反应工程湖南省高校重点实验室,湖南 湘潭 411105)
综述了硫化氢分解制氢和硫技术的研究进展,包括反应原理,高温热分解法、催化热分解法、超绝热分解法、电化学法、微波分解法、等离子体法和光催化分解法等硫化氢分解制氢和硫技术,并比较和分析了各技术的优缺点,展望了的未来发展趋势。
硫化氢;分解;制氢;硫
随着全球人口与经济的快速增长,人类对石油和天然气的需求日益增大。目前我国进口的石油和天然气主要出产于中东及俄罗斯,这些地区所产石油含硫量较高。工业上硫的脱除会产生大量的H2S废气,加之我国天然气田中H2S含量较高,有的甚至占90%以上[1]。这些H2S废气会对油、汽输送管道和其他设备造成腐蚀,将其排放到空气中还会造成环境污染,严重威胁到人类的健康和生存的空间。
目前工业上主要采用克劳斯工艺(Claus process)来处理H2S废气,即先将H2S不完全燃烧生成SO2,再使生成的SO2与H2S反应生成硫磺和水。该工艺过程虽然能够回收硫磺,但其中的氢被氧化成了水,造成了氢能的严重浪费。通过分解H2S工业废气制氢,不仅能制得硫磺,还能充分利用其中的氢能,同时也保护了环境,实现绿色化工业生产,因此具有研究意义。
1 H2S分解制氢技术的基本反应原理
H2S分解为氢气及单质硫的反应方程式为:
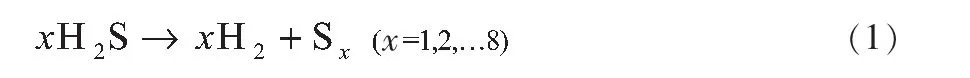
式中,Sx表示硫的同素异形体;x的值则取决于操作温度。由此可知,在H2S分解制氢反应中,硫存在多种同素异形体,因而使得该反应的进行变得尤为复杂。
2 H2S分解制氢和硫的方法
2.1 高温热分解法
高温热分解法是指不加催化剂,直接通过高温将H2S热裂解为氢气和硫的方法。对反应2H2S→2H2+S2进行热力学分析,在标准状况下,该反应的焓变为171.59kJ,熵变为0.078kJ/K,由热力学第二定律可知,其吉布斯自由能变为148.3kJ。因此该反应是一个热力学不利的吸热反应,在常温常压下H2S不能自发进行分解,只有在高温条件下H2S才会发生分解。
Slimane等[2]研究了纯H2S高温热分解制氢的反应。研究表明,当反应温度低于850℃时,几乎没有H2S发生分解;1000℃时,H2S的转化率为20%;而1200℃时转化率仅为38%;只有在高于1375℃的条件下,H2S转化率才能达到50%以上。
Faraji等[3]在1000℃~1200℃内,研究了H2S与He或者N2混合后的高温热分解反应。研究发现H2S的转化率随温度的上升和分压的降低而升高;增加空速可以抑制氢气和硫逆反应再生成H2S。在反应器中填充石英片以加快传热,1200℃下,控制流速50mL/min,停留时间48s,纯H2S热分解转化率可达35.6%;控制H2S分压5.05kPa,1200℃下转化率达65.8%。
采用高温热分解法,升高温度和降低H2S分压可提高H2S的转化率,但是该工艺需要大量供热,消耗热能过多,处理的H2S浓度又太稀薄,因此受到经济上的严重制约。
2.2 催化热分解法
催化热分解法是指在较温和条件下加入催化剂催化分解H2S的方法。目前催化分解法常用到的催化剂包括Al、Fe、Mo、Co、V等过渡金属元素的氧化物和硫化物。
Reshetenko等[4]研究了γ-Al2O3、α-Fe2O3和V2O5催化剂在500℃~900℃内催化H2S多相热分解的反应。反应中α-Fe2O3和V2O5被还原成Fe3+和V4+的硫化物;低温下H2S与γ-Al2O3作用,H2S转化为HS-和S-,再热转化生成单质硫;升高温度,被吸附的H2S增多,此时H2S与表面氧相互作用形成硫的氧化物,后者会进一步形成单质硫。三种催化剂中,α-Fe2O3催化剂的催化效果最好,900℃时,氢气收率达30%以上;γ-Al2O3催化剂的效果稍次,V2O5的效果最差。
David系统与技术公司[5]设计出一种沉积了MoS2的多孔薄膜管式陶瓷元件。利用这种元件进行实验,既可起催化作用产生氢气和硫,其陶瓷多孔薄膜又选择性分离出氢气,从而能够打破反应平衡,促进反应进行。用该反应器在400℃~700℃、50.5kPa~101kPa下处理φ(H2S)为4%的混合气体,其转化率可达35%~56%。而同一条件下在普通反应器中,H2S转化率最高只达40%。
Startsev等[6-7]在低温下进行了金属催化剂催化H2S分解制氢和气态双原子硫的实验。实验表明,在室温下反应,H2S的转化率可接近15%,升高温度,其转化率反而下降,到250℃时,几乎就不发生反应了。反应制得的气态双原子硫可能是一种硫元素的新形态,因为普通的S2分子只能在200℃下的硫蒸汽中形成。当在该固体催化体系中,增加可以溶解硫的溶液,此时室温下反应的平衡可以被打破,H2S转化率可接近100%。
引入高活性催化剂来降低反应活化能,可提高较低温度下H2S的热分解率,但不能改变化学平衡。据此将催化热分解与膜反应器或者其它抑制可逆反应发生的装置相结合是今后研究的新方向。该方法的重点在于开发更高效的催化剂和耐高温、低成本的膜材料。
2.3 超绝热分解法
超绝热分解法是指不加催化剂,也无外加热源供能,直接利用H2S在多孔介质中部分氧化产生热量,从而实现H2S自发热分解的方法。利用该方法可避免H2S热分解能耗过高的问题。
Slimane等[8]利用一种热力学模型,通过改变氧气进料组成,来研究H2S部分氧化下超绝热分解的情况。研究发现,当实际供氧量与理论完全燃烧1mol H2S需氧量的当量比大于6时,可获得较高的H2收率和较低的SO2产率;以纯氧操作时可达热力学最佳,即实际供氧量与理论需氧量的当量比超过12。
Bingue等[9]利用一种惰性多孔介质研究了φ(H2S)为20%的混合气体的超绝热燃烧分解情况。实验表明当量比为0.1~5.5时,H2S混合气体可得到稳定的燃烧,当量比为2时,H2产率可达到最大值20%,随着当量比继续增大,氢气产率逐渐下降,直到当量比为5.5时,不再有氢气产生。当量比为4时,S2的产率达到最大值50%。
凌忠钱等[10]将化学动力学研究与流体力学数值模拟结合,利用一个有17个组分和57步反应的化学机理,进行了H2S多孔介质缺氧燃烧制氢的模拟。结果表明H2S在多孔介质内,富燃条件下的燃烧温度比绝热燃烧温度高260℃,从而形成了超绝热燃烧环境,为H2S的裂解提供了高温条件,实现了同时回收H2S中的氢和硫的目的。
H2S的部分氧化可为其热分解提供能量,使工艺脱离外加热源,且超绝热分解法不受H2S含量的制约,因此未来发展前景广阔。该工艺应用的关键在于开发蓄热能力强、透气性能好、耐热耐酸且成本低廉的多孔材料。
2.4 电化学法
电化学法分为直接法和间接法。采用直接电解法有硫磺沉积在阳极表面,造成电极钝化,因此当前的研究更集中于间接法。间接电解法是将一种氧化剂作为中间循环剂与H2S进行氧化还原反应产生硫磺,经微孔过滤,被还原的中间循环剂在阳极上再生,同时在阴极上析出氢气,从而避免了阳极钝化。
罗文利等[11]利用含Fe3+的强酸性反应液作为中间循环剂氧化吸收H2S气体,反应方程式为:

微孔过滤脱硫后,含Fe2+的氧化液在电解反应器的阳极循环再生成含Fe3+的氧化液。同时H2从阴极析出,电极反应为:
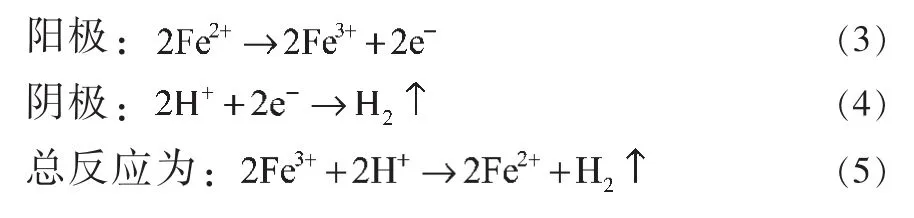
25℃时,理论上该总反应的分解电压为0.771V,低于分解水的1.23V。该方法目前可达85%的H2S吸收率,Fe2+转化为Fe3+与析氢的效率都接近100%。
李永发等[12]利用100L/h~120L/h规模的间接电解扩大装置,对φ(H2S)为85%~95%的废气进行了处理。结果发现当氧化吸收过程的操作温度控制在60℃,以高于2.5mol/L的Fe3+浓度及高于1.5的液气体积比反应,此时制氢电耗约为2.9kWh/m3,H2S吸收率超过99%,制得的硫磺纯度高于99.8%。
袁长忠等[13]通过研究H2S间接电解法制氢中试的阴极过程,考察了电化学反应过程和传质过程,从而建立起H2S间接电解制氢阴极反应的宏观动力学模型。研究表明,影响该反应的主要因素包括槽压、氢离子浓度和电解液温度,三者中槽压对反应的影响最大。该模型的建立可为后续的中试放大实验以及工业生产提供一定的理论依据。
间接电化学法制氢单位电耗较低,可处理H2S含量高的酸性废气。但该方法还存在产生大量硫磺、电极材料的使用寿命太短等缺点,因此研发使用寿命长、性能优异而又廉价的电极材料和电解装置,发现高效、循环性更好的中间循环氧化剂是该工艺应用的关键。
2.5 微波分解法
张洵立等[14]在常压下进行了间歇操作微波分解H2S制氢的实验。实验结果表明,微波对纯H2S气体的分解没有显著作用;微波的作用效果随作用时间延长先增加,达到最高后降低;随着微波功率的增大,最佳反应时间会缩短,但继续增大微波功率,这种趋势会减缓。当反应气体以体积分数为76.7%的H2S和23.3%的H2混合,在850W微波功率下反应60s时,H2S最大转化率可达84%。
马文等[15]利用间歇式微波反应器,研究了FeS催化剂微波催化H2S分解制氢的反应。结果显示,减小H2S浓度、增加FeS催化剂用量及延长微波作用时间,都可提高H2S转化率。当以850W微波功率、4.3g FeS催化剂、15%体积分数的H2S反应120s时,H2S转化率最高可达87.95%。
Zhang等[16]利用一种管式填充床石英反应器,来进行微波和传统加热分解H2S制氢的研究。当加入 MoS2/γ-Al2O3催化剂 0.482g,控制 H2S流速为31mL/min,H2S转化率会随反应温度上升而增加,而且微波加热比传统加热增加得更显著,后者的增幅则与热力学平衡转化率大致相当;当温度为800℃,微波条件下H2S转化率可达12%,而常规加热仅为6.5%。实验还表明,反应前将气体预热至230℃比未加预热处理对H2S的转化率并无多少提升。
微波直接作用于H2S分子,而不加热其它非极性分子,且分解H2S的时间短,能量利用效率高。有研究表明,微波除致热效应外,还存在非热催化效应[17],但这些研究仍处实验室阶段,对于微波非热效应的机理尚无定论。目前该方法大多局限于间歇操作,H2S连续分解率较低,因此使其工业应用受到制约。该技术的重点在于开发催化性能良好的微波催化剂,设计合理的反应装置和工艺路线以及深入探讨微波催化机理、全面揭示微波催化作用。
2.6 等离子体法
等离子体被称为除了固态、液态和气态之外的第四种状态,是一种被离子化的气体。它富含大量正负电荷相等的电子、离子、中性原子以及自由基,因此呈现出电中性。等离子体分为高温与低温等离子体两种,后者不仅拥有较高电子能量,其离子和气体的温度也较低,这种非平衡特性能促进化学反应的进行,因而使其相较高温等离子体而言应用得更广泛[18]。
Mohamed等[19]利用微波诱导等离子体炬技术进行了H2S分解制氢的研究。实验先研究了单一反应器模型的等离子体解离反应平衡,之后进行全混流反应器(PSR)和平推流反应器(PFR)的研究。由此做出的平衡曲线,可直观显示出微波等离子分解H2S制氢过程中的最佳产量点,然后再进行PSR和PFR模型化学动力学模拟,得出了更贴近实际的数据,从而选择最佳反应条件,得到收率更高的目的产物。实验结果表明,该体系下的最优解离温度为2027℃,此时反应器出口的H2和S2的物质的量分数分别占进口纯H2S原料气的0.57和0.27。
Reddy等[20]研究了低温等离子体介质阻挡放电(NTP-DBD)反应器分解H2S制氢的实验,利用该反应器操作可在153℃下实现原位去除硫的凝聚。H2S的分解主要由激发的载气(Ar)通过电子碰撞而引发,被激发的载气量则决定着反应速率的快慢。实验结果表明,在DBD反应器中进行H2S分解反应,当φ(H2S)控制在5%~25%,流量控制为150mL/min,温度控制在153℃时,H2S的转化率随着输入功率的增加而增加,而H2S浓度越低,这种正比效果就更明显。当输入功率控制在 0.55W~1.13W之间,φ(H2S)为5%时,H2S转化率可达18%~30%,而当φ(H2S)增加至25%时,在输入功率为1.92W的情况下,H2S转化率最大只达12%。
Subrahmanyam等[21]利用带有一个内电极的介质阻挡放电反应器来研究H2S分解制氢反应。这种内电极由烧结金属纤维制成,在反应中能起到一定催化反应进行的作用。研究发现当反应气体以体积分数为25%的H2S和75%的Ar混合,停留时间为6s,在注入体系的能量密度为1.1eV时进行反应,H2S的转化率可达40%,此时的产氢能耗为2.8eV。实验结果还表明, 采用该方法制氢的能耗(2kWh/m3)要小于常规蒸汽甲烷重整方法制氢能耗(4.3kWh/m3)。
王安杰等[22]研究了介质阻挡放电与光催化协同作用分解H2S制氢的实验。实验考察了CdS/Al2O3、CdO/Al2O3、ZnS/Al2O3和ZnO/Al2O3四种光催化剂在介质阻挡放电反应器中的催化效果。当在发生器输入电压为60V的条件下,以10kHz的等离子体放电频率,填装催化剂1.5mL,φ(H2S)控制为10%和φ(Ar)控制为90%的混合反应气的流速为60mL/min,此时四种光催化剂在反应中都表现出良好的催化剂活性,H2S转化率可达95.8%至100%;当在相同条件下,以CdS/Al2O3光催化剂连续反应60h,期间H2S转化率均能稳定在 100%,此时产氢能耗为2.56eV/mol。
低温等离子体技术中H2S直接被离解为正负离子和原子,在低温下拥有了较高的电子能量。此时引入催化剂,既能避免常规方法催化剂高温失活的问题,又能与等离子体同时作用,降低产氢能耗,提高转化率。但该工艺目前不能处理H2S含量高的气体,反应机理也还未摸清。因此改进等离子体反应器的结构以及优化运行参数,逐步摸清等离子体和催化剂共同作用的反应机理是该技术未来发展的重点。
2.7 光催化分解法
1972年Fujishima[23]发现利用TiO2半导体电极可光催化水分解生成 H2。由于分解 H2S只需39.3kJ/mol的能量,要低于分解水的284.5kJ/mol,因此光催化分解H2S制氢更引人注意。白雪峰等[24]研究了H2S光催化分解的基理,认为H2S光催化分解所使用的半导体催化剂,能级非连续,当照射大于其禁带能级的光子时,电子会从价带跃迁到导带,形成电子-空穴对。当反应物分子与这种电子-空穴对相接触时,即会发生光催化氧化还原反应。H2S分解发生的反应方程式为:
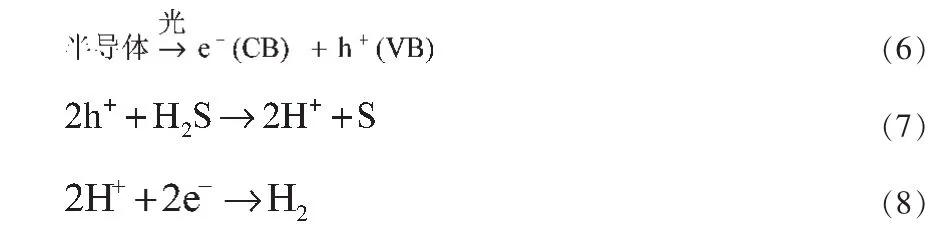
2.7.1 气-固相光催化分解法
气-固相光催化分解法是指在反应体系中加入光催化剂,H2S气体经光照的作用,直接分解成氢和硫的方法。
马贵军等[25]利用气-固相反应研究了TiO2、CdS、ZnS、ZnO以及ZnIn2S4等半导体光催化剂分解H2S制氢的催化活性。当以体积分数为5%的H2S与Ar混合气为反应气体,控制混合气的流量为6mL/min,在无氧的条件下,经300W紫外氙灯照射下进行实验。结果表明,在上述催化剂中,ZnS的光催化活性较高;将贵金属Ir担载在ZnS上可明显提高反应的产氢速率;在ZnS制备的过程中加入少量阳离子Cu2+也可极大地提高催化剂分解H2S制氢的催化活性;以特征波长λ>420nm的可见光为光源,在ZnS中掺杂物质的量分数为0.5%的Cu2+时,产氢速率可达最高,为17μmol/h。
付晓红[26]利用自制的气-固相反应装置,进行了紫外光分解H2S制氢的实验。实验发现,当不加入光催化剂,直接照射特征波长λ为253.7nm的紫外光时,体系中有部分H2S发生了分解,且H2S的初始浓度越高,分解反应就进行的越快;当以体积分数为20%的H2S与N2混合气为反应气体,在特征波长λ为253.7nm的10W低压汞灯照射下,加入0.05g TiO2-P25光催化剂,进行气-固相反应6h,最终产氢速率可达0.0208mL/(W·h)。
2.7.2 液-固相光催化分解法
液-固相光催化分解法是指用碱性水溶液吸收H2S气体,在光照条件下与半导体光催化剂作用,实现H2S光催化分解制氢的方法。
Preethi等[27]研究了尖晶石光催化剂催化分解H2S制氢的实验。所用的尖晶石型金属氧化物催化剂(CuGa2-xFexO4,其中x=0.4,0.6或0.8)先以陶瓷合成的路线制得前驱体,再于其上担载质量分数0.5%或1%的贵金属氧化物RuO2而制得。XRD表征结果显示催化剂为单相立方尖晶石晶体结构,SEM表征则显示小立方晶体的粒径随铁含量的降低而减小。可见光条件下(特征波长λ≥420nm),在 0.5mol/L的KOH水溶液中,使用担载质量分数1%RuO2的CuGa1.6Fe0.4O4催化剂光催化H2S分解制氢,产氢速率达10.045mmol/h,而在特征波长λ为520nm的条件下,量子效率可达最高,为21%。
Jing等[28]以纳米 Cd0.5Zn0.5S为光催化剂,在Na2S/Na2SO3溶液中进行了H2S光催化分解制氢的实验研究。实验比较了间歇式光催化反应器(BPR)和流化床光催化反应器(FBPR)分解H2S制氢反应的反应速率常数,结果发现FBPR的反应速率常数为1.12,而BPR则仅为0.083,进而证实增加有效初始反应物浓度对该反应的进行尤为重要。在FBPR中,光催化H2S分解制氢的最佳反应条件为在1.5mol/L NaOH和0.25mol/L Na2SO3混合溶液中通入40±5mL/min的H2S气体,加入光催化剂0.4g,控制反应温度40℃,此时可获得最佳产氢效果。
2.7.3 其它光催化分解法
最近,Zong等[29]研究出一种光电催化-化学耦合的新方法来分解H2S制取H2及硫磺。该方法分两步进行,第一步为一个简单的化学反应,即利用Fe3+/Fe2+或者I3-/I-电对的氧化态,实现H2S的高效捕获,从而制得还原态H+和硫磺,实验的第二步利用光电催化作用来还原质子H+,从而产生H2,与此同时在光生空穴的作用下,电对的还原态被氧化。如此经过Fe3+/Fe2+或者I3-/I-的不断循环,将化学反应与光电催化反应耦合,实现了H2S光电驱动分解制氢。实验中,在P-Si光电阴极表面镀上n+半导体薄层,然后沉积防护TiO2/Ti涂层,并载上产氢催化剂,从而制得Pt/TiO2/Ti/n+P-Si光电阴极,利用这种光电阴极进行反应,能表现出良好的产氢性能和稳定性,经光照3h,产生的H2的量为8.3mL。
反应方程式为:
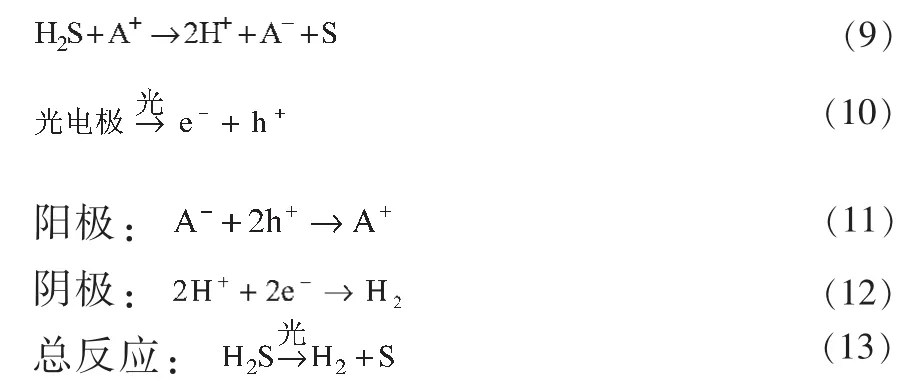
反应式中,A-表示Fe2+或I-,A+表示Fe3+或I3-。
光催化分解法以廉价易得的太阳能为能源,反应条件温和,生产成本较低。但该方法目前存在光利用率不高,可见光响应催化剂制备成本高、难回收,容易中毒失活等缺点。该工艺未来发展的关键在于开发具备较好的可见光响应性、较高的催化活性和生产成本低廉的光催化剂,以及设计简单、易操作的反应设备。
3 结语与展望
随着我国经济的快速发展,能源需求的缺口日益增大,石油进口量随之递增,在炼油过程中产生了大量的H2S废气。因此无论是分解H2S制氢和硫,以获得清洁的能源,还是处理H2S废气,保护环境不被污染,H2S分解制氢技术都具有非常大的研究潜力。目前可用来分解H2S制氢的方法已有多种,但技术上都不成熟,尚不能实现工业化应用。因此研究H2S分解制氢工艺,找到一种能量利用率高、温和条件下反应快、收率好而又成本低廉的方法,来代替传统的克劳斯工艺,其应用前景广阔。
[1]朱光有,戴金星,张水昌,等.含硫化氢天然气的形成机制及分布规律研究 [J].天然气地球科学,2004,15(2):166-170.
[2]Slimane R B,Lau F S,Dihu R J,et al.Production of hydrogen by superadiabatic decomposition of hydrogen sulfide [C]//Proceedings of the 2002 U S,DOE Hydrogen Program Review, NREL/CP-610-32405, University of Illinois at Chicago,Chicago,2002.
[3]Faraji F,Safarik I,Strausz O P,et al.The direct conversion of hydrogen sulfide to hydrogen and sulfur[J].Int J Hydrogen Energy,1998,23(6):451-456.
[4]Reshetenko T V,Khairulin S R,Ismagilov Z R,et al.Study of the reaction of high-temperature H2S decomposition on metal oxides (γ-Al2O3;α-Fe2O3;V2O5)[J].Int J Hydrogen Energy,2002,27(4):387-394.
[5]David Systems and Technology S L.Catalytic membrane reactor that is used for the decomposition of hydrogen sulphide into hydrogen and sulphur and the separation of the products of said decomposition[P].EP:1411029A1, 2004.
[6]Startsev A N,Kruglyakova O V,Chesalov A Y,et al.Low temperature catalytic decomposition of hydrogen sulfide into hydrogen and diatomic gaseous sulfur[J].Top Catal, 2013,56:969-980.
[7]Startsev A N,Kruglyakova O V.Diatomic gaseous sulfurobtained at low temperature catalytic decomposition of hydrogen sulfide[J]. J Chem Chem Eng,2013,7:1007-1013.
[8]Slimane R B,Lau F S,Khinkis M,et al.Conversion of hydrogen sulfide to hydrogen by superadiabatic partial oxidation:thermodynamic consideration[J].Int J Hydrogen Energy,2004,29(14):1471-1477.
[9]Bingue J P,Saveliev A V,Fridman A A.Hydrogen production in ultra-rich filtration combustion of methane and hydrogen sulfide[J].Int J Hydrogen Energy,2002,27 (6):643-649.
[10]凌忠钱,周昊,钱欣平,等.多孔介质内H2S贫氧燃烧制氢数值模拟[J].环境科学学报,2006,26(1):22-26.
[11]罗文利,赵永丰.从硫化氢中回收氢气和硫磺的方法[J].石油大学学报,1994,18(4):95-101.
[12]李永发,曹作刚,张海鹏,等.由硫化氢制取硫磺及氢气扩大实验研究[J].化工进展,200l,20(7):38-40.
[13]袁长忠,邢定峰,俞英.硫化氢间接电解制氢中试阴极动力学研究[J].化工学报,2005,56(7):1317-1321.
[14]张洵立,马宝岐,倪炳华.天然气微波法脱硫实验研究[J].西安石油学院学报,1994,9(3):70-71.
[15]马文,王新强,倪炳华.微波催化法分解硫化氢的研究[J].石油与天然气化工,1997,26(1):37-38.
[16]Zhang X L,Hayward D O,Mingos D M P.Effects of microwave dielectric heating on heterogeneous catalysis [J].Catal Lett,2003,88:33-38.
[17]黄卡玛,杨晓庆.微波加快化学反应中非热效应研究的新进展[J].自然科学进展,2006,16(3):273-279.
[18]赵璐,王瑶,李翔,等.低温等离子体法直接分解硫化氢制氢的研究进展[J].化学反应工程与工艺,2012,28(4): 364-370.
[19]Mohamed S,Naji A.Chemical reactor network modeling of a microwave plasma thermal decomposition of H2S into hydrogen and sulfur[J].Int J Hydrogen Energy,2012,37: 10010-10019.
[20]Reddy E L,Karuppiah J,Subrahmanyam C.Kinetics of hydrogen sulfide decomposition in a DBD plasma reactor operated at high temperature[J].J Energy Chem,2013,22: 382-386.
[21]Subrahmanyam C H,Renken A,Kiwi-minsker L.Nonthermal plasma catalytic reactor for hydrogen production by direct decomposition of H2S[J].J Optoelectron Adv Mater,2008,10(8):1991-1993.
[22]王安杰,赵璐,金亮,等.一种分解硫化氢制备氢气和单质硫的方法[P].CN:10240809B,2013.
[23]Fujishima A,Honda K.Electrochemical photolysis of water at a semiconductor electrode[J].Nature,1972,238 (7):37-38.
[24]白雪峰,吴丹,王鹏.硫化氢光催化分解制氢[J].太阳能学报,2008,29(10):1256-1261.
[25]马贵军,鄢洪建,宗旭,等.气-固相光催化分解硫化氢制氢[J].催化学报,2008,29(4):313-315.
[26]付晓红.气相分解硫化氢制氢的实验探索[J].应用能源技术,2011,(1):13-16.
[27]Preethi V,Kanmani S.Photocatalytic hydrogen production over CuGa2-xFexO4spinel[J].Int J Hydrogen Energy,2012, 37:18740-18746.
[28]Jing D W,Jing L,Liu H,et al.Photocatalytic hydrogen production from refinery gas over a fluidized-bed reactor (II):Parametric study[J].Ind Eng Chem Res,2013,52: 1992-1999.
[29]Zong X,Han J F,Seger B,et al.An integrated photoelectrochemical-chemical loop for solar-driven overall splitting of hydrogen sulfide[J].Angew Chem Int Ed,2014,53(17):4399-4403.
Research progress in hydrogen and sulfur production from hydrogen sulfide
PENG Ren-jie,ZHOU Ji-cheng,LUO Yu-shang,HU Xiao-ning
(Key Laboratory of Green Catalysis and Chemical Reaction Engineering of Hunan,School of Chemical Engineering,Xiangtan University,Xiangtan 411105,China)
The research progresses in the reaction of decomposition of hydrogen sulfide to hydrogen and sulfur were summarized, including reaction principles and various methods for decomposition of hydrogen sulfide,such as high-temperature thermolysis, catalytic thermolysis,superadiabatic thermolysis,electrochemical technology,microwave decomposition,plasma technology and photocatalytic decomposition.The advantages and disadvantages of each method were discussed and the development trends were prospected.
hydrogen sulfide;decomposition;hydrogen production;sulfur
TQ125.1;TQ116.2
:A
:1001-9219(2015)01-89-06
2014-04-13;
:湖南省高校创新平台开放基金项目(12K047);
:彭仁杰(1989-),男,硕士研究生;*
:周继承(1964-),男,教授,博士生导师,电话0731-58298173,电邮zhoujicheng@sohu.com。

